Ensayos que utilizan partículas activas en espectroscopia Raman potenciada en superficie (SERS).
Un procedimiento de detección de la presencia o cantidad de uno o más analitos en una muestra biológica,
comprendiendo el procedimiento:
(a) proporcionar una muestra biológica sospechosa de contener uno o más analitos;
(b) disponer la muestra biológica en un recipiente de ensayo, en el que el recipiente de ensayo: (i) tiene dispuesto en él mismo un reactivo que comprende una o más nanopartículas activas en SERS que tienen asociadas con las mismas al menos un miembro de unión específico que tiene una afinidad por el o los analitos y al menos una molécula indicadora activa en SERS; y una o más partículas de captura magnética, teniendo la o las partículas de captura magnética asociadas con las mismas al menos un miembro de unión específico que tiene una afinidad por el o los analitos y al menos un marcador de referencia capaz de generar una señal detectable, en el que el miembro de unión asociado con las nanopartículas activas en SERS puede ser igual o diferente que el miembro de unión asociado con las partículas de captura magnética; o
(ii) está adaptado para tener dispuesto en el mismo el reactivo de la etapa (b)(i), disponiéndose el reactivo de la etapa (b)(i) en el recipiente de ensayo antes de, simultáneamente con, o después de disponer la muestra en el mismo;
(c) incubar la muestra biológica durante un periodo de tiempo para formar un complejo de partícula de captura magnética-analito-nanopartícula activa en SERS si el o los analitos están presentes en la muestra biológica;
(d) exponer el complejo de partícula de captura magnética-analito-nanopartícula activa en SERS a un campo magnético para inducir que el complejo migre a un área localizada del recipiente de ensayo;
(e) iluminar el área localizada del recipiente de ensayo con radiación incidente a una o más longitudes de onda para inducir que la nanopartícula activa en SERS produzca una primera señal detectable y el marcador de referencia produzca una segunda señal detectable; y
(f) comparar la primera señal detectable de la nanopartícula activa en SERS con la segunda señal detectable del marcador de referencia para detectar la presencia o cantidad del o los analitos en la muestra biológica.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2008/057700.
Solicitante: BECTON, DICKINSON AND COMPANY.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 1 BECTON DRIVE FRANKLIN LAKES, NEW JERSEY 07417 ESTADOS UNIDOS DE AMERICA.
Inventor/es: SCHRAM, JAMES L., LASTOVICH, ALEXANDER, G., KEITH, STEVEN, WEIDEMAIER,Kristin, SANDMANN,CHRISTIAN, DILLMORE,W. SHANNON, STEWART,W. WILLIAM, PEARSON,ROBERT E, HSIEH,HELEN, BHAT,RAJENDRA R, LIEBMANN-VINSON,ANDREA, CURRY,ADAM CRAIG.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- G01N21/65 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 21/00 Investigación o análisis de los materiales por la utilización de medios ópticos, es decir, utilizando rayos infrarrojos, visibles o ultravioletas (G01N 3/00 - G01N 19/00 tienen prioridad). › Difusión de Raman.
- G01N33/543 G01N […] › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › con un soporte insoluble para la inmovilización de compuestos inmunoquímicos.
- G01N33/58 G01N 33/00 […] › en los que intervienen sustancias marcadas (G01N 33/53 tiene prioridad).
PDF original: ES-2500219_T3.pdf



Fragmento de la descripción:
Ensayos que utilizan partículas activas en espectroscopia Raman potenciada en superficie (SERS)
Campo técnico
La materia objeto desvelada en el presente documento se refiere a ensayos de diagnóstico que utilizan partículas activas en espectroscopia Raman potenciada en superficie (SERS).
Antecedentes
Se han desarrollado diversas técnicas para detectar la presencia de uno o más analitos en un ensayo. Por ejemplo, se han usado técnicas fluorescentes, luminiscentes, quimioluminiscentes o electroquimioluminiscentes para detectar analitos dentro de una muestra biológica. En muchos ensayos biológicos, incluyendo ensayos en los que se usan micro o nanopartículas para detectar la presencia y/o cantidad de uno o más analitos en una muestra biológica, se usa la generación de un acontecimiento de señalización para detectar la presencia del analito. Dichos ensayos biológicos conocidos en la técnica, sin embargo, tienen limitaciones. Por lo tanto, podría ser ventajoso proporcionar un ensayo que tuviera una o más características potenciadas, incluyendo, pero sin limitación, sensibilidad, especificidad, precisión, repetibilidad potenciadas y combinaciones de las mismas.
Breve sumario
La presente invención proporciona un procedimiento de ensayo basado en líquidos que incluye partículas de captura magnética que tienen unidas a las mismas un miembro de unión que tiene una afinidad por uno o más analitos de interés y nanopartículas activas en SERS, que también tienen unidas a las mismas un miembro de unión que tiene una afinidad por el o los analitos de interés. Cuando se pone en contacto con una muestra biológica que contiene uno o más analitos, se forma un complejo de partícula de captura magnética-analito-nanopartículas activas en SERS. Las propiedades magnéticas de las partículas de captura magnética pueden usarse para localizar el complejo de partícula de captura magnética-analito-nanopartículas activas en SERS en un área predeterminada dentro de un recipiente de ensayo para detectar la señal de SERS.
El procedimiento de ensayo de la invención es un ensayo basado en líquido/de captura magnética que incorpora un marcador de referencia. En dicho procedimiento de ensayo, las partículas magnéticas usadas para la sedimentación magnética se marcan con un marcador de referencia capaz de producir una señal detectable, además del miembro de unión específico del analito de interés. La señal emitida por la nanopartícula activa en SERS del complejo de partícula de captura magnética-analito-nanopartícula activa en SERS puede compararse con la del marcador de referencia unido con la partícula de captura magnética para compensar variaciones en el tamaño, forma y posición del sedimento.
En algunas realizaciones, el procedimiento de ensayo utiliza nanoestructuras compuestas, incluyendo una estructura compuesta, denominada en el presente documento estructura "satélite", que comprende una pluralidad de partículas portadoras de señal, por ejemplo, nanopartículas, unidas con una partícula núcleo. En otras realizaciones, se utiliza una estructura compuesta, denominada en el presente documento estructura de "núcleo-cubierta", que incluye una partícula núcleo, un material activo, tal como un material activo en Raman, que rodea la partícula núcleo, y una o más cubiertas, tales como una cubierta metálica, que rodea el material activo. Dichas estructuras satélite y núcleo- cubierta pueden usarse para amplificar o potenciar de otro modo una señal en un ensayo, tal como un ensayo de SERS.
Habiéndose indicado anteriormente en el presente documento ciertos aspectos del procedimiento de ensayo desvelado en el presente documento, otros objetos resultarán evidentes a medida que avance la descripción cuando se toman junto con los ejemplos y dibujos adjuntos como se describe mejor posteriormente en el presente documento.
Breve descripción de las diversas vistas de los dibujos
Habiéndose descrito la materia objeto desvelada en el presente documento en términos generales, se hará ahora referencia a los dibujos adjuntos, que no están dibujados necesariamente a escala, y en los que:
La Figura 1 es un diagrama esquemático de un ensayo de captura magnética desvelado en el presente documento representativo;
La Figura 2 es un diagrama esquemático que representa el uso de un marcador de referencia, por ejemplo, una nanopartícula activa en SERS, como una referencia en una partícula de captura magnética;
La Figura 3 es una representación gráfica de una comparación de una señal sin referencia y una señal con referencia. La señal sin referencia (B) es la intensidad máxima a 159 cm'1 de un indicador de Raman trans-1,2- bis(4-pirridil)etileno (BPE) y la señal con referencia (A) es la relación de las intensidades máximas a 159 cm'1 y 118 cm'1, que es la intensidad máxima correspondiente a un indicador 4,4-dipiridilo (DPY). Obsérvese que la escala del lado izquierdo de la gráfica corresponde a la señal con referencia (A), mientras que la escala en el lado derecho de la gráfica corresponde a la señal sin referencia (B);
La Figura 4 es un diagrama esquemático de un ejemplo de un sistema óptico adecuado para su uso con los ensayos desvelados en el presente documento;
Las Figuras 5A-5D son representaciones esquemáticas de la formación de sedimentos por rotación de tubo de ensayo;
La Figura 6 es una representación gráfica de una comparación de la señal indicadora de 4,4-dipiridilo (DPY) en tampón, plasma y sangre lisada con y sin reactivo de lisado (rcts),
La Figura 7 es un diagrama esquemático representativo de un ensayo desvelado en el presente documento que usa un procedimiento de amplificación de señal;
Las Figuras 8A y 8B son una comparación de inmunoensayos basados en líquidos procesados con reactivos idénticos en ausencia (8A) y en presencia (8B) del procedimiento de amplificación de señal desvelado en el presente documento;
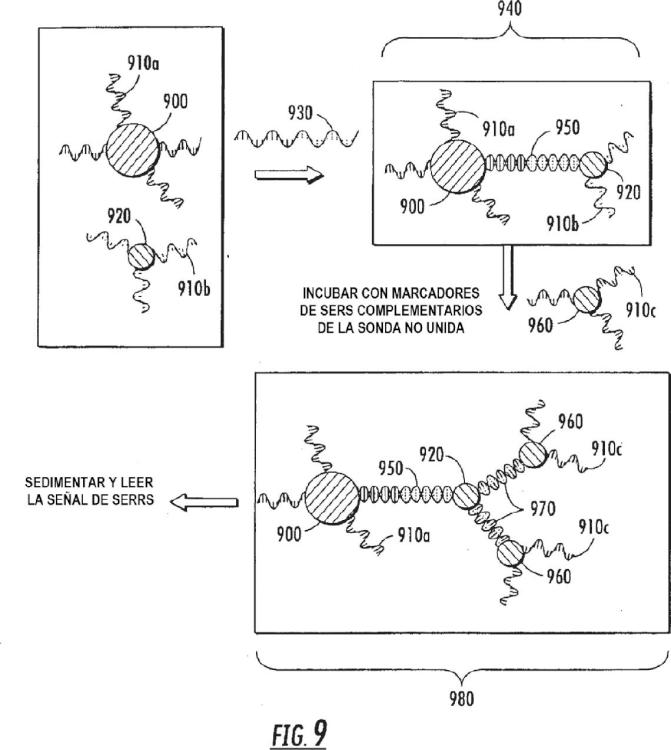
La Figura 9 es un diagrama esquemático representativo del procedimiento de amplificación desvelado en el presente documento en un formato de detección de polinucleótidos;
Las Figuras 1A y 1B presentan resultados de un ensayo de hibridación de ADN en ausencia (1A) y presencia (1B) del procedimiento de amplificación de señal desvelado en el presente documento;
Las Figuras 11A y 11B muestran que puede asignarse erróneamente una señal aleatoria a variables de entrada debido al alineamiento engañoso de elementos. Se ajustó el ruido aleatorio distribuido de forma normal con una desviación típica de 1. usando una rutina de mínimos cuadráticos. En este ejemplo, se asignó al marcador 4 un peso de ,5 para equilibrar los pesos negativos de otros marcadores;
Las Figuras 12A y 12B muestran espectros de referencia representativos obtenidos en solución (A) y en un sedimento de partículas magnéticas (B). El máximo del marcador 5 (cerca de 865 nm) en relación con el marcador 1 es mayor en el sedimento, y la forma del máximo en 88 nm es ligeramente diferente;
La Figura 13 es una representación gráfica de estimaciones de la concentración de uno de cinco marcadores en un experimento múltiple. El nivel de concentración 2 se corresponde con 2,5E8 partículas de marcador/ml.
Las estimaciones usando espectros de referencia basados en sedimentos (rombos cerrados) muestran mejor precisión y exactitud, especialmente a menores concentraciones, que los espectros de referencia basados en solución (círculos abiertos). La línea recta muestra una relación 1:1 (los puntos de datos basados en solución se compensan a partir de los puntos basados en sedimentos en el eje x para mayor claridad);
La Figura 14 muestra una microfotografla electrónica de transmisión (TEM) de una estructura satélite de acuerdo con una realización de la materia objeto desvelada en el presente documento;
La Figura 15 ¡lustra un ensayo de tipo sándwich usando una estructura satélite para amplificar una señal de analito de acuerdo con una realización de la materia objeto desvelada en el presente documento;
La Figura 16A representa un ensayo de tipo sándwich usando una estructura satélite para amplificar una señal de analito de acuerdo con una realización de la materia objeto desvelada en el presente documento, y la Figura 16B muestra el ensayo de tipo sándwich de la Figura 16A después de la aplicación de un campo magnético;
La Figura 17 ¡lustra una sección transversal de una partícula compuesta núcleo-cubierta de acuerdo con una realización de la materia objeto desvelada en el presente documento;
La Figura 18A es un dibujo que muestra una vista lateral de un tubo de ensayo de acuerdo con una realización de la materia... [Seguir leyendo]
Reivindicaciones:
1. Un procedimiento de detección de la presencia o cantidad de uno o más analitos en una muestra biológica, comprendiendo el procedimiento:
(a) proporcionar una muestra biológica sospechosa de contener uno o más analitos;
(b) disponer la muestra biológica en un recipiente de ensayo, en el que el recipiente de ensayo:
(i) tiene dispuesto en él mismo un reactivo que comprende una o más nanopartículas activas en SERS que tienen asociadas con las mismas al menos un miembro de unión específico que tiene una afinidad por el o los analitos y al menos una molécula indicadora activa en SERS; y una o más partículas de captura magnética, teniendo la o las partículas de captura magnética asociadas con las mismas al menos un miembro de unión específico que tiene una afinidad por el o los analitos y al menos un marcador de referencia capaz de generar una señal detectable, en el que el miembro de unión asociado con las nanopartículas activas en SERS puede ser igual o diferente que el miembro de unión asociado con las partículas de captura magnética; o
(ii) está adaptado para tener dispuesto en el mismo el reactivo de la etapa (b)(¡), disponiéndose el reactivo de la etapa (b)(¡) en el recipiente de ensayo antes de, simultáneamente con, o después de disponer la muestra en el mismo;
(c) incubar la muestra biológica durante un periodo de tiempo para formar un complejo de partícula de captura magnética-analito-nanopartícula activa en SERS si el o los analitos están presentes en la muestra biológica;
(d) exponer el complejo de partícula de captura magnética-analito-nanopartícula activa en SERS a un campo magnético para inducir que el complejo migre a un área localizada del recipiente de ensayo;
(e) iluminar el área localizada del recipiente de ensayo con radiación incidente a una o más longitudes de onda para inducir que la nanopartícula activa en SERS produzca una primera señal detectable y el marcador de referencia produzca una segunda señal detectable; y
(f) comparar la primera señal detectable de la nanopartícula activa en SERS con la segunda señal detectable del marcador de referencia para detectar la presencia o cantidad del o los analitos en la muestra biológica.
2. El procedimiento de la reivindicación 1, en el que el marcador de referencia comprende una segunda nanopartícula activa en SERS que tiene una molécula Indicadora diferente a la o las nanopartículas activas en SERS que forman un complejo con el o los analitos.
3. El procedimiento de la reivindicación 1 o 2, en el que el imán está seleccionado de un imán permanente y un electroimán.
4. El procedimiento de una cualquiera de las reivindicaciones 1 a 3, en el que las partículas magnéticas tienen una estructura satélite que comprende una pluralidad de partículas unidas con una partícula núcleo, en el que la pluralidad de partículas comprende una molécula indicadora.
5. El procedimiento de la reivindicación 4, en el que la estructura satélite comprende además una primera estructura satélite que tiene una pluralidad de un primer tipo de partículas unidas con una primera partícula núcleo, en el que la primera estructura satélite tiene una primera señal detectable, y una segunda estructura satélite que tiene una pluralidad de un segundo tipo de partículas unidas con una segunda partícula núcleo, en el que la segunda estructura satélite tiene una segunda señal detectable, en el que la primera señal detectable y la segunda señal detectable son diferentes, y en el que la primera y segunda partículas núcleo pueden ser iguales o diferentes.
6. El procedimiento de la reivindicación 4, en el que la estructura satélite comprende una pluralidad de estructuras satélite, en el que cada estructura satélite tiene una señal detectable que puede distinguirse de la señal detectable de otra estructura satélite.
7. El procedimiento de una cualquiera de las reivindicaciones 1 a 6, en el que la nanopartícula comprende un núcleo, un material activo que rodea al núcleo y una cubierta contigua en torno al material activo, en el que el núcleo y la cubierta contigua pueden ser iguales o diferentes.
8. El procedimiento de la reivindicación 7, en el que la cubierta contigua comprende una pluralidad de nanopartículas, preferentemente el núcleo tiene un diámetro de 2 nm a 2 nm y la pluralidad de nanopartículas que comprende la cubierta contigua tiene cada una un diámetro de 2 nm al diámetro del núcleo.
9. El procedimiento de cualquiera de las reivindicaciones 1 a 8, en el que la muestra biológica está seleccionada de una muestra de sangre completa, suero sanguíneo, plasma sanguíneo, líquido ascítico, orina, saliva, sudor, leche; líquido sinovial, líquido peritoneal, líquido amniótico, líquido percefalorraquídeo, líquido linfático, embolia pulmonar, líquido cefalorraquídeo, líquido pericárdico, muestra cervicovaginal, extracto tisular, extracto celular y combinaciones de los mismos.
1. El procedimiento de las reivindicaciones 1 a 8, en el que el o los analitos están seleccionados de un ácido nucleico, un fragmento de ADN, un nucleótido, un polinucleótido y un oligonucleótido.
11. El procedimiento de las reivindicaciones 1 a 8, en el que el o los analitos son una célula.
Patentes similares o relacionadas:
Método de determinación de la presencia y/o cantidad de moléculas diana, del 22 de Julio de 2020, de Canopy Biosciences, LLC: Método para el análisis de células individuales en una muestra de sangre mediante la determinación de la presencia y/o cantidad de una o más moléculas […]
Kit de reactivos utilizado para detectar gastrina-17 y método de preparación y aplicación para el kit de reactivos, del 15 de Julio de 2020, de Shenzhen New Industries Biomedical Engineering Co., Ltd: Un kit para detectar gastrina-17, caracterizado porque comprende un componente A y un componente B, en donde el componente A es un primer […]
Un sustrato para inmovilizar sustancias funcionales y un método para preparar las mismas, del 15 de Julio de 2020, de Temasek Polytechnic: Un sustrato sólido que tiene compuestos dispuestos sobre el mismo, en donde se inmoviliza una molécula funcional sobre los compuestos, teniendo cada compuesto una cadena que […]
Chip de análisis y aparato de análisis de muestras, del 1 de Julio de 2020, de Takano Co., Ltd: Un chip de análisis que comprende: un sustrato conformado sustancialmente en forma de disco; un puerto de inyección formado […]
Dispositivo para la detección de analitos, del 1 de Julio de 2020, de TECHLAB, INC.: Un dispositivo para detectar por lo menos una sustancia de interés en una muestra líquida, comprendiendo el dispositivo: (a) una unidad que […]
Análisis biológico autónomo de alta densidad, del 1 de Julio de 2020, de BioFire Diagnostics, LLC: Recipiente para realizar reacciones de amplificación en un sistema cerrado que comprende una porción flexible que tiene una serie de blísteres […]
Estructuras para controlar la interacción de luz con dispositivos microfluídicos, del 3 de Junio de 2020, de Opko Diagnostics, LLC: Un sistema de ensayo múltiplex que comprende: un artículo que soporta ensayos en fase sólida, comprendiendo dicho artículo un sustrato plano rígido y comprendiendo […]
Uso de un estándar para la detección de agregados de proteínas de una enfermedad por plegamiento incorrecto de proteínas, del 27 de Mayo de 2020, de FORSCHUNGSZENTRUM JULICH GMBH: Uso de un estándar, que comprende una nanopartícula inorgánica con un tamaño de 2 a 200 nm, en cuya superficie ya sea mediante i) ácido carboxílico-espaciador-maleimida […]