Proteínas de fusión que comprenden dos dominios de unión TGF-β.
Agente de unión bivalente de la estructura general II con afinidad por un miembro de la superfamilia TGF-ß:
bd1>-enlazador- (II)
donde:
bd1 y bd2 son los mismos y son dominios de unión al polipéptido con una afinidad por el mismo miembro de la superfamilia TGF-ß;
y, el enlazador comprende la sec. con núm. de ident.: 49 o sec. con núm. de ident.: 50.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/CA2008/000547.
Solicitante: NATIONAL RESEARCH COUNCIL OF CANADA.
Nacionalidad solicitante: Canadá.
Dirección: 1200 MONTREAL ROAD OTTAWA, ON K1A 0R6 CANADA.
Inventor/es: O\'CONNOR-MCCOURT,MAUREEN D, SULEA,TRAIAN, ZWAAGSTRA,JOHN C, BAARDSNES,JASON.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K39/395 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- A61K47/48
- A61K49/00 A61K […] › Preparaciones para examen in vivo.
- C07K1/22 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 1/00 Procedimientos generales de preparación de péptidos. › Cromatografía de afinidad o técnicas análogas basadas en procesos de absorción selectiva.
- C07K14/495 C07K […] › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Factor de crecimiento transformante (TGF).
- C07K14/71 C07K 14/00 […] › para factores de crecimiento; para reguladores de crecimiento.
- C12N15/12 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Genes que codifican proteínas animales.
- C12N15/18 C12N 15/00 […] › Hormonas de crecimiento.
- G01N1/34 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 1/00 Muestreo; Preparación de muestras para la investigación (manipulación de materiales para un análisis automático G01N 35/00). › Purificación; Limpieza.
- G01N1/40 G01N 1/00 […] › Concentración de muestras.
- G01N33/53 G01N […] › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › Ensayos inmunológicos; Ensayos en los que interviene la formación de uniones bioespecíficas; Materiales a este efecto.
PDF original: ES-2449753_T3.pdf
Fragmento de la descripción:
Proteínas de fusión que comprenden dos dominios de unión TGF-º
Campo de la invención La invención se relaciona con el campo de los antagonistas y, más específicamente, con antagonistas de polipéptidos capaces de usar como trampas de ligando multivalente de una sola cadena.
Antecedentes de la invención Muchos procesos biológicos indeseables se producen a través de la unión del ligando a receptores de superficie celular. Por lo tanto, a veces es deseable contar con compuestos y métodos para reducir o modular dicha unión.
La superfamilia TGF-º incluye un número de ligandos de significado biológico.
TGF-º y activina desempeñan papeles críticos patógenos en muchas enfermedades que incluyen la progresión del cáncer y la fibrosis no controlada y la cicatrización de los tejidos, por ejemplo, enfermedades renales, pulmonares y fibrosis hepática. Además, la miostatina/GDF8 es otro ligando que se relaciona con la activina y que comparte la unión al mismo receptor Tipo II (ActivinRIIb) . La miostatina es un potente inhibidor del crecimiento del músculo esquelético y es un objetivo terapéutico validado para las enfermedades de pérdida de músculo tal como la distrofia muscular. Las proteínas morfogenéticas óseas (BMP) , que son otros ligandos en la familia TGF-º, se han implicado en las enfermedades cardiovasculares. Por ejemplo, altos niveles de BMP2 y BMP4 se encontraron en placas ateroscleróticas calcificadas y válvulas aórticas enfermas.
Agentes principales que se dirigen a estos ligandos son trampas/antagonistas del ligando que se unen y secuestran el ligando. Dos ejemplos son: 1) anticuerpos anti-ligandos y 2) ectodominios del receptor solubles.
Se han hecho esfuerzos para identificar métodos para reducir la unión del ligando al atrapar el ligando y prevenir su interacción con los receptores de la superficie celular. La inhibición de ciertos ligandos se informó por medio del uso de anticuerpos anti-ligando que atrapan y neutralizan el ligando directamente. Para las aplicaciones terapéuticas y de diagnóstico, sin embargo, los anticuerpos son problemáticos, debido particularmente a los problemas derivados de su inmunogenicidad (y el peligro de la respuesta inmune adversa en los pacientes) y su gran tamaño (la restricción de su capacidad de alcanzar objetivos fuera de la corriente sanguínea) .
Versiones solubles de ectodominios del receptor antagonizan los ligandos directamente al unirse a ellos y evitar que interactúen con receptores de la superficie celular. En el caso de TGP-º, en modelos animales, la expresión de un ectodominio (ED) del receptor TGF-º tipo de II (TºRII) restauró parcialmente la inmunidad del huésped y promovió el aclaramiento del tumor, lo que indica que la neutralización de TGF-º mediada por el ectodominio del receptor inhibe la progresión tumoral. Se ha demostrado, sin embargo, que la eficacia de TºRII monovalente para antagonizar TGF-º es menor de lo que pudiera desearse. Los intentos para superar esto condujo a la producción de una forma dimerizada artificialmente de versiones de TºRII-ED, dimerizadas, a través de la fusión de cualquiera de los dominios superenrollados o el dominio Fc de IgG. Esta dimerización mejoró el efecto antagonista.
Las trampas/neutralizadores basadas en receptores bivalentes que antagonizan la actividad del ligando multimérico tienen el
potencial de actuar como agentes terapéuticos o de diagnóstico (de imágenes o no imágenes) para enfermedades/trastornos causados por la sobre-producción/actividad del ligando objetivo. Se demostró que la dimerización no covalente de TºRII-ED (por ejemplo, a través de la fusión para heterodimerizar filamentos helicoidales (TºRII-ED superenrollado) ) , mejora en gran medida la potencia antagonista de TºRII-ED (De Crescenzo y otros, 2004, J. Biol. Chem.
279: 26013) .
Una desventaja significativa del dímero fusionado superenrollado es que la naturaleza no covalente del dominio de dimerización limita su potencia, es decir, se disocia a bajas concentraciones de tal manera que una gran parte del ectodominio del receptor helicoidal-fusionado actuará como un monómero en lugar de un dímero. El uso del dominio Fc de IgG proporciona una interacción covalente, pero a costa de gran tamaño y aumento de la probabilidad de inmunogenicidad.
Breve descripción de las figuras
Figura 1A. Modalidades representativas de secuencias de aminoácido correspondientes a regiones intrínsecamente no estructuradas en las porciones extracelulares de los receptores de la superfamilia TGP- seleccionados. Figura 1B. Modalidades representativas de secuencias de aminoácido correspondientes a regiones de dominio de unión de ligandos estructurados en las porciones extracelulares de los receptores de la superfamilia TGF- seleccionados. Figura 2A. Ejemplos representativos de modalidades de ectodominios de receptores fusionados en línea como trampas de una sola cadena homo bivalente de varios factores de crecimiento de la familia TGF-.El signo "/" indica el punto de fusión. Figura 2B. Ejemplos representativos de secuencias correspondientes a enlazadores naturales de modalidades de trampas de una sola cadena homo bivalente resultantes de la fusión de todas las porciones extracelulares de los receptores de la superfamilia TGF-- seleccionados. Figura 2C. Ejemplos representativos de secuencias correspondientes a modalidades de enlazadores artificiales para trampas de una sola cadena homo bivalente a diferentes identidades de secuencias con las secuencias enlazadoras naturales. Figura 2D. Ejemplos representativos de secuencias correspondientes a diferentes longitudes del enlazador para modalidades de las trampas de una sola cadena homo-bivalente mediante la supresión o la repetición de secuencias naturales, o mediante la inserción de secuencias artificiales, en la secuencia enlazadora natural. Figura 3. Representa una ilustración de una modalidad de la construcción de la trampa de una sola cadena (T R-II) 2 en un modelo de mecánica molecular tridimensional de la trampa de una sola cadena (T R-II) 2 unida al factor de crecimiento TGF
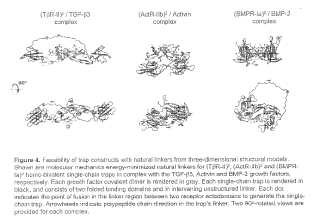
3. Se proporcionan dos vistas rotadas 90°. Figura 4. Representa diagramas relacionados con la factibilidad de modalidades específicas de construcciones de trampas con enlazadores naturales a partir de modelos estructurales tridimensionales. Se muestran enlazadores naturales con energía mecánica molecular minimizada para modalidades de trampa de una sola cadena homo-bivalente (TbR-II) 2, (ActRIIb) 2 y (BMPR-Ia) 2 en complejo con los factores de crecimiento TGF-3, Activina y BMP-2, respectivamente. Cada dímero covalente de factor de crecimiento se representa en gris. Cada trampa de una sola cadena se representa en negro, y consiste de dos dominios de unión plegados y del enlazador no estructurado de intervención. Cada punto indica el punto de fusión en la región enlazadora entre dos ectodominios del receptor para generar la trampa de una sola cadena. Las puntas de flecha indican la dirección de la cadena polipeptídica en el enlazador de la trampa. Se proporcionan dos vistas rotadas 90°para cada complejo. Figura 5A. Representa el modelo de dinámica molecular (MD) para una modalidad de la trampa de una sola cadena homobivalente (T R-II) 2 unida al factor de crecimiento TGF-3 (imágenes de la derecha) . Además se muestra para referencia un modelo inicial con enlazador de energía minimizada y con dominios de unión de ligando en posiciones cristalográficas unidas al factor de crecimiento (imágenes de la izquierda, ver además las Figuras 3 y 4) . La trampa de una sola cadena se representa en negro y el dímero covalente del factor de crecimiento se representa en gris. Se superponen diez estructuras promediadas en el tiempo (cada una durante 1 ns) que cubren el plazo de 10 ns de la simulación MD. Se proporcionan dos vistas rotadas 90° Figura 5B. es una representación gráfica de las fluctuaciones de la raíz cuadrada media por residuo (RMS) de una modalidad del complejo (T RII) 2 / TGF-3, promediado en el tiempo durante los últimos 10 ns de simulación MD. Figura 5C. es una representación gráfica de la energía de interacción solvatada (SIE) entre una modalidad de una trampa de una sola cadena (T RII) 2 y el ligando TGF-3 durante los últimos 10 ns de simulación MD de sus complejos, con un valor promedio de -25.4 kcal/mol. Figura 6. Representa un esquema de modalidades de prototipo de trampas (T RII) 2 y N-His (T RII) 2 modificada. Figura 7A. Representa los sensogramas del biosensor basado en la resonancia de plasmón superficial (SPR) (Biacore™) que muestra una modalidad de un prototipo (T RII) 2 (en medio condicionado diluido a partir de diferentes % de las transfecciones) unido al ligando TGF-3 inmovilizado en la superficie.... [Seguir leyendo]
Reivindicaciones:
1. Agente de unión bivalente de la estructura general II con afinidad por un miembro de la superfamilia TGF-:
bd1>-enlazador-<bd2> (II)
donde: bd1 y bd2 son los mismos y son dominios de unión al polipéptido con una afinidad por el mismo miembro de la superfamilia TGF-; y,
el enlazador comprende la sec. con núm. de ident.: 49 o sec. con núm. de ident.: 50.
2. El agente de la reivindicación 1, en donde el miembro de la superfamilia TGF-por el cual los dominios de unión tienen afinidad se selecciona del grupo que consiste de: TGF-1, TGF-2, TGF-3, activina A, activina B, activina C, activina E, proteína morfogénica ósea (BMP) 2, BMP 3, BMP 4, BMP 5, BMP 6, BMP 7, BMP 8, BMP 9, BMP
10, BMP 11, BMP 12, BMP 13, BMP 14, BMP 15, factor de diferenciación de crecimiento (GDF) 1, GDF 3, GDF 8, GDF 9, GDF 15, Nodal, Inhibina a, hormona antimülleriana, Lefty 1, Lefty 2, arteman, persefina y neurturina.
3. El agente de la reivindicación 1, en donde el miembro de la superfamilia TGF-por el cual los dominios de unión tienen afinidad se selecciona del grupo que consiste de: TGF-1, TGF-2, TGF-3, BMP 2, GDF 8, y activina.
4. El agente de la reivindicación 1, en donde bd1 y bd2 son la sec. con núm. de ident.: 43, sec. con núm. de ident.: 44, sec. con núm. de ident.: 45, sec. con núm. de ident.: 46, sec. con núm. de ident.: 47 o sec. con núm. de ident.: 48.
5. El agente de la reivindicación 1, en donde bd1 y bd2 son la sec. con núm. de ident.: 43 o sec. con núm. de ident.: 44.
6. El agente de la reivindicación 1 que es la sec. con núm. de ident.: 10 o sec. con núm. de ident.: 16.
7. El agente de cualquiera de las reivindicaciones 1 a 6, que no está fusionado a una porción de dimerización o multimerización.
8. El agente de cualquiera de las reivindicaciones 1 a 7 que tiene una masa después de la glicosilación de entre 40 kDa y 60 kDa.
9. El agente de cualquiera de las reivindicaciones 1 a 8 que tiene la estructura general V:
en donde R1, R2 y R3 pueden ser iguales o diferentes, pueden no estar presentes y, cuando están presentes, pueden ser independientemente uno o más de una proteína de fusión para dirigir, un anticuerpo de dominio sencillo,
un agente de radioterapia, un agente de imagen, un colorante fluorescente, una etiqueta de la proteína fluorescente, un agente citotóxico para la quimioterapia, un polímero conjugado a fármacos, un agente estabilizante, un fármaco, un nanoportador, un soporte o un dendrímero.
10. El agente como se define en cualquiera de las reivindicaciones 1 a 9 para usar en la modulación de la respuesta de 45 una célula a un miembro de la superfamilia TGF-en su medio ambiente, dicho método comprende exponer la célula a dicho agente.
11. Uso de un agente como se define en cualquiera de las reivindicaciones 1 a 9 para concentrar el ligando en una muestra.
12. Uso de un agente como se define en cualquiera de las reivindicaciones 1 a 9 para la purificación del ligando in vitro.
13. El agente como se define en la reivindicación 9 para usar en el diagnóstico de una afección caracterizado en todo o parte por una anormalidad a niveles de uno o más miembros de la superfamilia TGF-en el cuerpo o una porción de este.
14. El agente como se define en la reivindicación 9 para usar en la entrega dirigida de un compuesto a un sitio de interés dentro de un cuerpo.
Patentes similares o relacionadas:
 CD52 soluble para su uso en el tratamiento o la prevención de la esclerosis múltiple o de la artritis reumatoide, del 29 de Julio de 2020, de THE WALTER AND ELIZA HALL INSTITUTE OF MEDICAL RESEARCH: Uno cualquiera o más de:
i) glucoproteína CD52 soluble, ii) una proteína de fusión que comprende la glucoproteína CD52 soluble como una primera proteína, y una segunda proteína;
[…]
CD52 soluble para su uso en el tratamiento o la prevención de la esclerosis múltiple o de la artritis reumatoide, del 29 de Julio de 2020, de THE WALTER AND ELIZA HALL INSTITUTE OF MEDICAL RESEARCH: Uno cualquiera o más de:
i) glucoproteína CD52 soluble, ii) una proteína de fusión que comprende la glucoproteína CD52 soluble como una primera proteína, y una segunda proteína;
[…]
Anticuerpo biespecífico o mezcla de anticuerpos con cadenas ligeras comunes, del 15 de Julio de 2020, de Jiangsu Alphamab Biopharmaceuticals Co., Ltd: Anticuerpo biespecífico o parte de unión a antígeno del mismo, en el que el anticuerpo biespecífico o la parte de unión a antígeno del mismo tiene una cadena […]
 Proteínas de dominio de fibronectina tipo III con solubilidad mejorada, del 24 de Junio de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un polipéptido que comprende restos de armazones a base de fibronectina que comprenden un 10º dominio de fibronectina tipo III (10Fn3) modificado, […]
Proteínas de dominio de fibronectina tipo III con solubilidad mejorada, del 24 de Junio de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un polipéptido que comprende restos de armazones a base de fibronectina que comprenden un 10º dominio de fibronectina tipo III (10Fn3) modificado, […]
PÉPTIDO DE MITICINA Y SU USO EN REGENERACIÓN CELULAR, del 4 de Junio de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS: La presente invención se refiere a unos péptidos derivados de la micitina C y sus usos terapéuticos, más concretamente en la regeneración celular y/o […]
Péptido de miticina y su uso en regeneración celular, del 28 de Mayo de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS: Péptido de miticina y su uso en regeneración celular. La presente invención se refiere a unos péptidos derivados de la micitina C y sus usos terapéuticos, más concretamente […]
Moléculas de unión de alta avidez que reconocen MAGE-A1, del 8 de Abril de 2020, de Max Delbrück Centrum für Molekulare Medizin (MDC) Berlin-Buch: Una construcción de reconocimiento de antígenos que es un receptor de células T (TCR), que comprende (i) una región variable de la cadena alfa […]
Moléculas de unión a ligando y usos de las mismas, del 25 de Diciembre de 2019, de Vegenics Pty Limited: Una molécula de unión a ligando que comprende un polipéptido de unión a ligando fusionado a un fragmento de dominio constante de inmunoglobulina, comprendiendo […]
Tratamiento de las enfermedades relacionadas con la apolipoproteína a1 por inhibición del transcrito antisentido natural a la apolipoproteína a1, del 17 de Octubre de 2019, de CuRNA, Inc: Un oligonucleótido que se dirige a un transcrito antisentido natural de apolipoproteína A1 para su uso como un compuesto terapéutico, donde el oligonucleótido […]