Procedimiento para la preparación de drospirenona.
Procedimiento para la preparación de drospirenona (6beta,7beta;
15beta,16beta-dimetilen-3-oxo-17alfa-pregn-4-eno-21,17carbolactona, DRSP) mediante separación del agua a partir de la 6beta,7beta;15beta,16beta-dimetilen-5beta-hidroxi-3-oxo-17alfa androstano-21,17-carbolactona por adición de un ácido o un ácido de Lewis.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E01250277.
Solicitante: Bayer Pharma Aktiengesellschaft.
Nacionalidad solicitante: Alemania.
Dirección: MULLERSTRASSE 178 13353 BERLIN ALEMANIA.
Inventor/es: NICKISCH, KLAUS, MOHR, JORG-THORSTEN.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07J53/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07J ESTEROIDES (seco-steroides C07C). › Esteroides teniendo la estructura del ciclopenta [a] hidrofenantreno modificada por condensación con ciclos carbocíclicos o por formación de un ciclo adicional por un enlace directo entre dos átomos de carbono cíclicos.
PDF original: ES-2320626_T3.pdf
Fragmento de la descripción:
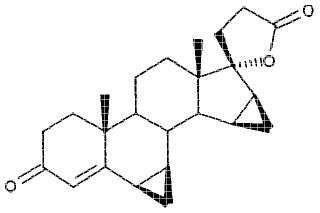
Drospirenona (6β,7β;15β,16β-dimetilen-3-oxo-17α-pregn-4-eno-21,17-carbolactona, DRSP) con menos de 0,2% de impurezas.
El invento se refiere a una drospirenona (6β,7β;15β,16β-dimetilen-3-oxo-17α-pregn-4-eno-21,17-carbolactona, DRSP) con menos de 0,2% de impurezas.
La drospirenona, (6β,7β;15β,16β-dimetilen-3-oxo-17α-pregn-4-eno-21,17-carbolactona, DRSP, INN = nombre internacional sin propietario) es conocida desde hace mucho tiempo como sustancia activa esteroidea (documentos de patente alemana DE 26 52 761 C2 y de solicitud de patente alemana DE 30 22 337 A1), y la preparación de las últimas 4 etapas se efectúa en un procedimiento conocido como "de un solo recipiente", en el que después de la hidrogenación de dimetilen-propinol no se aísla ninguno de los compuestos intermedios dimetilen-propanol y 5β-OH-DRSP por los que se pasa (véase el esquema siguiente).
Una síntesis análoga, pero mediando utilización de una oxidación con dicromato de piridinio, es conocida por el estado de la técnica [Angew. Chemie, 21, 9, (1982), páginas 696-697]. Síntesis similares para la preparación de 17,21-carbolactonas esteroideas se describen también en el contexto de los documentos de solicitudes de patentes europeas EP-A-0 075 189 y EP-A-0 051 143, pero con participación de reacciones microbiológicas. Sin embargo, no se divulgan en ellos oxidaciones con participación de compuestos de rutenio.
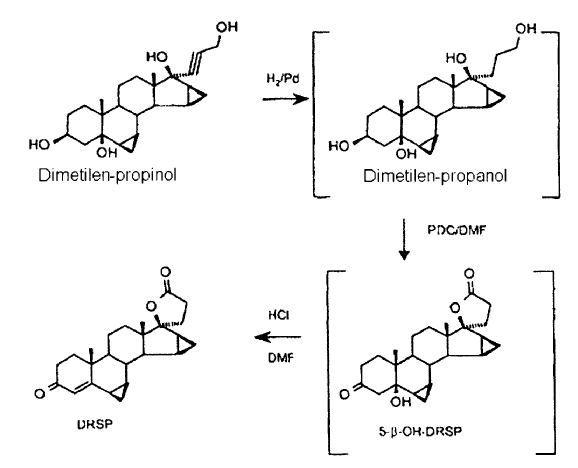
El dimetilen-propinol se hidrogena en el seno de THF con hidrógeno en presencia de paladio sobre carbón para formar el dimetilen-propanol. La solución de hidrogenación así obtenida, que contiene el propanol como producto principal y proporciones variables de un lactol, se hace reaccionar sin aislamiento ni tratamiento intermedio para formar la drospirenona (DRSP).
Para ello, en primer lugar se efectúa un cambio de disolventes, de THF por DMF, y a continuación el propanol se oxida a 40ºC con un exceso de 3,7 equivalentes de dicromato de piridinio (PDC) para formar una mezcla de DRSP y 5-β-OH-DRSP. La función 5-β-OH en el producto de oxidación es inestable frente a ácidos, ácidos de Lewis y condiciones básicas a temperaturas elevadas, puesto que en todos los casos con la formación de la cetona insaturada en Δ-4,5 en la drospirenona se obtiene un producto termodinámicamente más estable. La eliminación de la función β-OH en la 5-β-OH-DRSP transcurre hasta formar la drospirenona, más estable termodinámicamente, y no se podía reprimir.
La mezcla contiene por regla general proporciones variables de ambos componentes, presentándose la 5β-OH-DRSP por lo general como componente principal en la relación de 2-3:1. En la última etapa de la secuencia en un solo recipiente, la mezcla de dos componentes se transforma en la DRSP, bruta, mediante la adición de ácido clorhídrico semiconcentrado.
En la siguiente tabla se recopilan las últimas cuatro tandas de funcionamiento

En la media de todas las tandas de funcionamiento, partiendo del dimetilen-propinol, se consigue un rendimiento teórico de 56% de la DRSP, en bruto, con una pureza según la HPLC (cromatografía de líquido de alto rendimiento) de 98,9%.
Es misión del invento poner a disposición un nuevo procedimiento de preparación de la drospirenona, que sea más selectivo y sencillo en su realización que el del estado de la técnica y además de ello sea más ecológico; (con ahorro de una oxidación con trióxido de cromo).
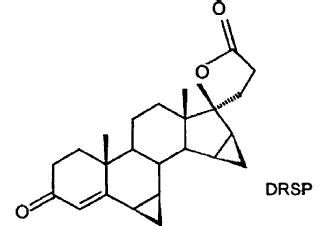
El problema planteado por esta misión se resuelve de acuerdo con la enseñanza de las reivindicaciones. El invento descrito en la solicitud principal comprende un procedimiento para la preparación de drospirenona (6β,7β;15β,16β-dimetilen-3-oxo-17alfa-pregn-4-eno-21,17-carbolactona, DRSP)
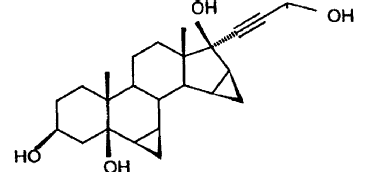
por hidrogenación catalítica de 17α-(3-hidroxi-1-propinil)-6β,7β;15β,16β-dimetilen-5β-androstano-3β,5,17β-triol
para formar la 7α-(3-hidroxi-1-propil-6β,7β;15β,16β-dimetilen-5β-androstano-3β,5,17β-triol,

por oxidación en presencia de una sal de rutenio para formar la 6β,7β;15β,16β-dimetilen-5β-hidroxi-3-oxo-17α-androstano-21,17-carbolactona,
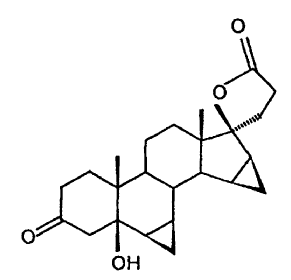
y por subsiguiente separación del agua.
El invento comprende la subsiguiente eliminación del agua desde la 5β-OH-DRSP para dar la drospirenona, por adición de un ácido o de un ácido de Lewis.
De manera análoga al procedimiento conocido a partir del estado de la técnica, en el procedimiento se hidrogena el dimetil-dipropinol en el seno de THF con hidrógeno en presencia de paladio sobre carbón. La solución de hidrogenación se somete a continuación a un cambio de disolventes, de THF por acetonitrilo. La solución en acetonitrilo se oxida con una cantidad catalítica de tricloruro de rutenio (1% en moles) y 3 equivalentes de bromato de sodio a 40-60ºC deliberadamente para formar la 5β-OH-DRSP.
A pesar de la gran inestabilidad de la 5β-OH-DRSP frente a ácidos, ácidos de Lewis tales como por ejemplo los compuestos de cromo en el antiguo procedimiento de realización, bases fuertes o altas temperaturas, que en todos los casos se ha atribuir al elevado poder impulsor para la formación de la cetona insaturada en Δ-4,5 que es más estable termodinámicamente, en las condiciones seleccionadas de reacción se consigue la síntesis selectiva de la 5β-OH-DRSP, sin que se pueda observar ninguna formación de drospirenona. La 5β-OH-DRSP se puede aislar a partir de la solución de reacción mediante una precipitación con agua que se puede llevar a cabo de una manera sencilla (desde el aspecto técnico).
Los rendimientos se sitúan en el intervalo de 68% a 75% a lo largo de las dos etapas, de hidrogenación y subsiguiente oxidación.
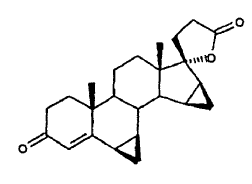
A partir de experimentos propios de la solicitante es conocido que la drospirenona, al ser sometida a la acción de un ácido, se puede descomponer según dos vías de reacción. En uno de los casos, la drospierenona se transforma en condiciones ácidas con facilidad en la isolactona epímera.
El segundo producto secundario se forma mediante un ataque por HCl sobre el grupo 6,7-metileno, que conduce al producto de apertura del anillo.
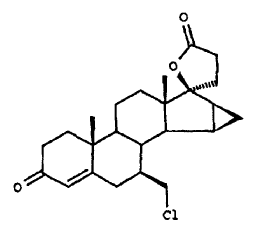
Ambos productos secundarios, la isolactona y el producto de apertura del anillo que se ha formado mediante la acción de un ácido, se reprimen en las condiciones de reacción de nuevo procedimiento en tal grado, que solamente ellos se pueden observar en un orden de magnitud de < 0,2%.
Al realizar la eliminación se consigue un rendimiento de 96% del teórico. El rendimiento total de nuevo procedimiento está situado por lo tanto en el intervalo de 65% a 72% del teórico.
Una ventaja adicional muy esencial del procedimiento conforme al invento con respecto al estado de la técnica se encuentra en el sector de la ecología. Se ha conseguido reemplazar los tóxicos compuestos de cromo hasta ahora utilizados, que se utilizaban hasta ahora para la oxidación en forma de las sales de PDC y que posteriormente se tienen que evacuar en forma de sus soluciones, por cantidades catalíticas de un metal. Además de ello es posible reciclar la mezcla empleada de acetonitrilo y agua por una destilación azeótropa, por lo que tampoco es de esperar ningún peligro para el medio ambiente.
Ejemplos... [Seguir leyendo]
Reivindicaciones:
1. Procedimiento para la preparación de drospirenona (6β,7β;15β,16β-dimetilen-3-oxo-17α-pregn-4-eno-21,17-carbolactona, DRSP) mediante separación del agua a partir de la 6β,7β;15β,16β-dimetilen-5β-hidroxi-3-oxo-17α-androstano-21,17-carbolactona por adición de un ácido o un ácido de Lewis.
2. Procedimiento de acuerdo con la reivindicación 1, caracterizado porque
la subsiguiente separación del agua tiene lugar por adición de ácido p-toluenosulfónico.
3. Procedimiento de acuerdo con la reivindicación 1, caracterizado porque
la subsiguiente separación del agua tiene lugar por adición de ácido clorhídrido semiconcentrado.
Patentes similares o relacionadas:
Método para la separación de los constituyentes isoprénicos de guayule, del 6 de Noviembre de 2019, de versalis S.p.A: Método para la separación de al menos un constituyente isoprénico de la resina de una planta de guayule y/o de tipo guayule que comprende las etapas de: […]
 Composición farmacéutica que comprende una suspensión acuosa de un derivado de androstano para el tratamiento de afecciones inflamatorias y alérgicas, del 11 de Febrero de 2019, de GLAXO GROUP LIMITED: Una formulación farmacéutica que comprende:
(i) una suspensión acuosa de un compuesto en partículas de fórmula (I)**Fórmula**
o un solvato de […]
Composición farmacéutica que comprende una suspensión acuosa de un derivado de androstano para el tratamiento de afecciones inflamatorias y alérgicas, del 11 de Febrero de 2019, de GLAXO GROUP LIMITED: Una formulación farmacéutica que comprende:
(i) una suspensión acuosa de un compuesto en partículas de fórmula (I)**Fórmula**
o un solvato de […]
Composiciones que comprenden un lofenol, del 23 de Enero de 2019, de MORINAGA MILK INDUSTRY CO., LTD.: Utilización no terapéutica de un compuesto de lofenol para mejorar o prevenir un síntoma de la piel seleccionado entre el grupo que comprende […]
Procedimiento de producción de 3-oxo-pregn-4-en-21,17-carbolactonas por la oxidación libre de metal de 17-(3-hidroxipropil)-3,17-dihidroxiandrostanos, del 3 de Enero de 2018, de Bayer Intellectual Property GmbH: Un procedimiento de producción de 3-oxo-17α-pregn-4-en-21,17-carbolactonas de fórmula IIIa **(Ver fórmula)** en la que R6a es hidrógeno o, junto con R7a, […]
Formulación farmacéutica que comprende un derivado de androstano y un agente de solubilización en un vehículo líquido acuoso, del 18 de Octubre de 2017, de GLAXO GROUP LIMITED: Una formulación farmacéutica que comprende un vehículo acuoso líquido que se ha disuelto en el mismo (a) un glucocorticoide de fórmula (I) **(Ver fórmula)** […]
Proceso para la preparación de drospirenona, del 13 de Septiembre de 2017, de INDUSTRIALE CHIMICA S.R.L.: Procedimiento para la preparación de drospirenona (I), que comprende la reacción de transformación de 17α-(3- hidroxipropil)-6ß,7ß;15ß,16ß-dimetilen-5ß-androstan-3ß,5,17ß-triol […]
Agente para mejorar la resistencia a la insulina, del 1 de Marzo de 2017, de MORINAGA MILK INDUSTRY CO., LTD.: Un agente para uso en el tratamiento de una enfermedad seleccionada de tolerancia anormal a la glucosa e hiperinsulinemia, que comprende un compuesto seleccionado de 9,19-ciclolanostan-3-ol […]
Proceso para la preparación de drospirenona, del 17 de Agosto de 2016, de INDUSTRIALE CHIMICA S.R.L.: 6ß,7ß;15ß,16ß-dimetilen-3ß,5ß-dihidroxi-17α-pregn-21,17-211α-carbolactol.