PROCEDIMIENTO PARA OBTENER LÍNEAS CELULARES REOMBINANTES DE MIELOMA DE MAMIÍFERO ADAPTADAS AL CRECIMIENTO EN MEDIOS SIN SUERO NI PROTEÍNAS.
La presente invención se relaciona con un método de obtención de células de mamífero adaptadas a crecer en medio libre de suero y proteínas,
el cual incluye un proceso en dos etapas de adaptación donde existe un intervalo crítico de concentración de proteína en el cual las células deben ganar la capacidad de sobrevivir en medio libre de proteínas. El intervalo crítico de la concentración de la proteína es específico para cada línea celular.La presente invención también revela líneas celulares de mamíferos que crecen establemente en condiciones de medio libre de suero y proteínas por al menos 40 generaciones. Adicionalmente, los clones revelados en la presente invención expresan los anticuerpos humanizados anti receptor de EGF hR3 y anti CD6 T1hT y el anticuerpo quimérico anti CD3 T3Q, además de los fragmentos de dichos anticuerpos
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/CU2003/000012.
Solicitante: CENTRO DE INMUNOLOGIA MOLECULAR.
Nacionalidad solicitante: Cuba.
Dirección: CALLE 216 ESQ. 15, ATABEY, PLAYA 12100 CIUDAD HABANA CUBA.
Inventor/es: PEREZ RODRIGUEZ, ROLANDO, CASTILLO VITLLOCH,Adolfo, VITORES SARAZOLA,Svieta, BOGGIANO AYO,Tammy, ROJAS DEL CALVO,Luis.
Fecha de Publicación: .
Fecha Solicitud PCT: 22 de Octubre de 2003.
Clasificación Internacional de Patentes:
- C07K16/28A12
- C07K16/28G
- C07K16/28Z
- C12N5/06B30
- C12N5/06B30A
Clasificación PCT:
- C12N5/00 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00).
- C12P21/08 C12 […] › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › C12P 21/00 Preparación de péptidos o de proteínas (proteína monocelular C12N 1/00). › Anticuerpos monoclonales.
Clasificación antigua:
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2360049_T3.pdf
Fragmento de la descripción:
Campo de la invención.
La presente invención se refiere a la biotecnología, específicamente a un procedimiento de obtención de clones celulares estables adaptados a un medio sin suero ni proteínas en un proceso de adaptación en dos etapas.
Antecedentes de la invención.
Desde el desarrollo del cultivo in vitro de células de mamíferos, la demanda de la producción de estas células a gran escala ha aumentado debido al potencial de diagnóstico y terapéutico de muchos de los productos obtenidos. Estos agentes útiles incluyen anticuerpos monoclonales, la hormona del crecimiento humana, linfocinas, eritropoyetina, factores de coagulación sanguínea y activadores del plasminógeno tisular.
En muchos casos, el uso de anticuerpos monoclonales recombinantes (rMab) para el tratamiento y el diagnóstico in vivo de distintas enfermedades implica el uso de altas dosis. Este hecho hace necesaria la producción de una gran cantidad del rMab de interés con una gran pureza.
Varios anticuerpos monoclonales de uso potencial en el tratamiento y diagnóstico del cáncer y de enfermedades autoinmunitarias se han expresado en células de mieloma NSO en el Centro de Inmunología Molecular. El documento US 5.891.996 describe la obtención de los anticuerpos quiméricos y humanizados dirigidos contra el receptor del factor de crecimiento epidérmico (EGF-R) útiles para el diagnóstico y el tratamiento de tumores que expresan dicho receptor. El documento WO 97/19111 describe anticuerpos monoclonales dirigidos contra CD6 útiles para el diagnóstico y el tratamiento de pacientes con psoriasis. Gavilondo y col., describieron en Hybridoma 9, n° 5, 1999, un anticuerpo monoclonal dirigido contra CD3, denominado IOR-T3a.
Se han desarrollado diversas técnicas para condiciones de cultivo en ausencia de proteínas. De este modo, definido específicamente, se han desarrollado medios completos sin proteínas que permiten el crecimiento celular en condiciones de ausencia de proteínas. El documento WO 97/05240 describe la expresión de proteínas recombinantes en condiciones de ausencia de proteínas.
El documento JP 2696001 describe el uso de un medio sin proteínas para la producción del factor VIII en células CHO mediante la adición de un agente tensioactivo no iónico o ciclodextrina para aumentar la productividad de las células huésped. Para aumentar la efectividad de estos aditivos se recomienda la adición de butirato y litio, por ejemplo.
El documento WO 96/26266 describe el cultivo de células en un medio que contiene un hidrolizado de proteínas con glutamina, cuyo contenido de aminoácidos libres es inferior al 15% del peso total de la proteína y cuyos péptidos tienen un peso molecular inferior a 44 kDa. Como medio de cultivo para los cultivos celulares se usa un medio mínimo sintético como medio base al que se añaden, entre otros, suero bovino fetal, gentamicina y mercaptoetanol, además del hidrolizado de proteínas. No se ha mencionado el uso de este medio que contiene suero para la producción recombinante de factores sanguíneos.
La patente de los EE. UU. n° 5.393.668 A describe superficies sintéticas especiales que permiten el crecimiento de células adherentes en condiciones de ausencia de proteínas.
Para estimular la proliferación celular se han multiplicado células CHO que sobreexpresan la insulina humana en un sustrato artificial al que la insulina se une covalentemente (Ito y col. 1996, PNAS U.S.A. 93: 35983601).
Reiter y col. (1992, Cytotechnology 9: 247-253) describen la inmovilización de células r-CHO crecidas primeramente a alta densidad sobre vehículos en un medio con suero y la subsiguiente perfusión de las células inmovilizadas en un medio sin proteínas durante la fase de producción, en lo que se encontró una liberación continua de proteína en el sobrenadante del cultivo celular. En ese caso las células se mantuvieron durante menos de 10 generaciones en el medio sin proteínas.
Los procedimientos anteriores para la preparación satisfactoria de un cultivo celular a gran escala en condiciones de ausencia de proteínas han sido descritos para líneas celulares continuas; en particular, las células VERO (documento WO 96/15231). En este caso, las células se cultivan en condiciones de ausencia de suero y proteínas a partir de la ampolla original hasta una gran escala técnica de 1.200 litros.
La adaptación de las células crecidas inicialmente en condiciones de presencia de suero a un medio sin proteínas es un proceso bastante problemático que normalmente requiere largo tiempo; además, se ha encontrado repetidamente que el rendimiento de la proteína expresada y la productividad de las células CHO recombinantes disminuye en gran medida después de la adaptación en un medio sin proteínas, en comparación con las condiciones de presencia de suero (Paterson y col., 1994, Appl. Microbiol. Biotechnol. 40: 691-658). Esto es consecuencia de una inestabilidad o de un crecimiento reducido de los clones recombinantes debido al cambio en las condiciones de cultivo. A pesar del uso de un clon original estable, a causa de la alteración de las condiciones de fermentación, repetidamente una gran parte de las células pasan a ser células con expresión reducida o también no productoras, que superan en crecimiento a las productoras de producto durante el proceso de producción, con lo que finalmente el cultivo del fermentador consta fundamentalmente de células no productoras o de células con una expresión baja.
En la presente invención hemos establecido una estrategia para desarrollar líneas celulares estables adaptadas a medios sin suero ni proteínas. Siguiendo esta estrategia se han aislado varios clones en un medio sin proteínas.
Descripción detallada de la invención:
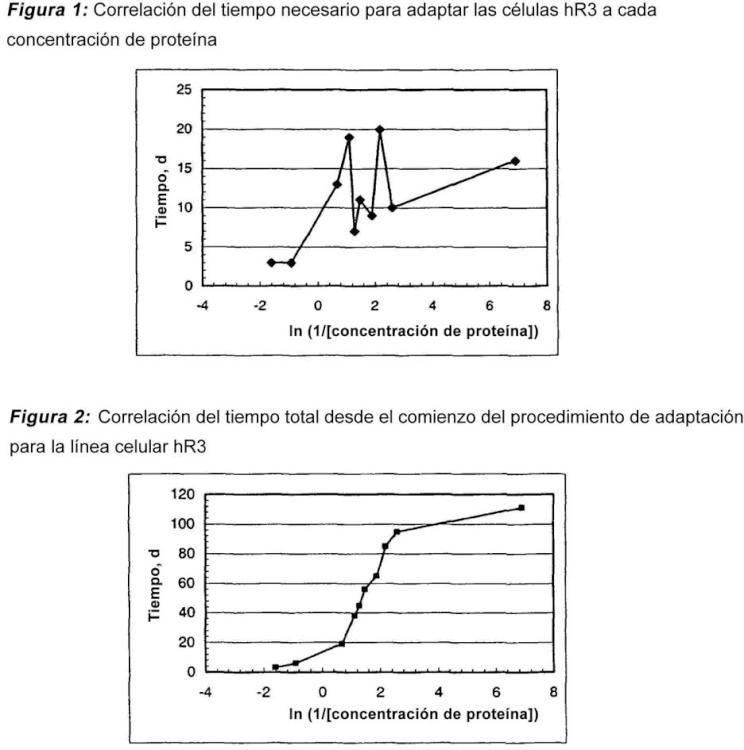
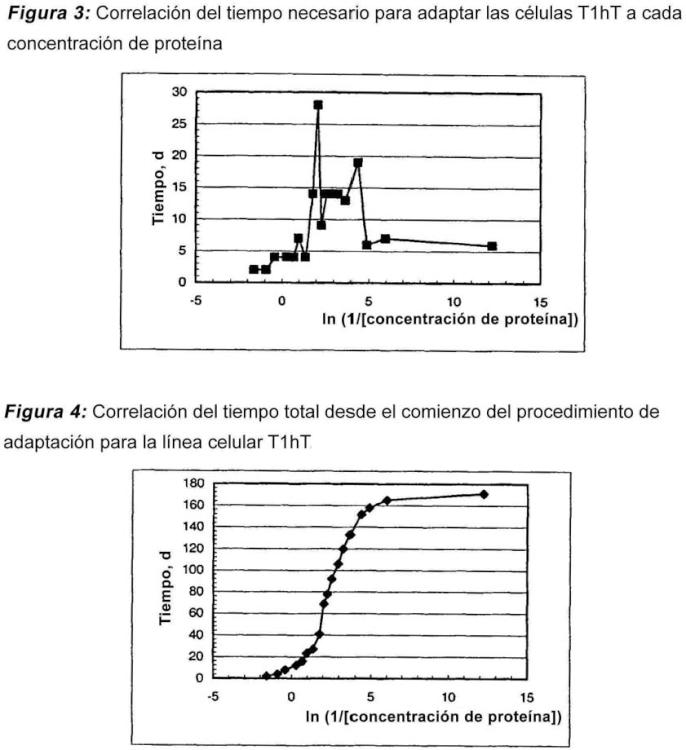
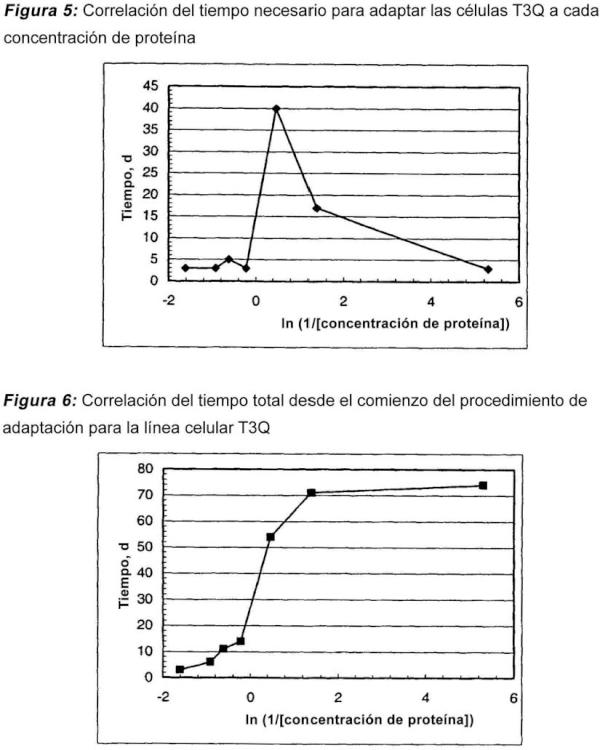
Adaptación de las líneas celulares a un medio sin proteínas en dos etapas.
Este procedimiento comprende líneas celulares recombinantes de mieloma de mamífero, para las que no es posible llevar a cabo un procedimiento de adaptación directo desde un medio suplementado con suero o sin suero a un medio sin proteínas.
El procedimiento de la presente invención consta de un proceso en dos etapas durante la adaptación de líneas celulares a un medio sin proteínas (PFM).
La primera etapa, que se considera una etapa no crítica: la reducción del contenido de proteína tiene lugar sin pérdidas de la viabilidad celular y no se produce una disminución importante del tiempo de duplicación de la población en cada paso de concentración de proteína. La etapa no crítica se observa habitualmente para una concentración de proteína total en el medio de cultivo entre 5 y 0,5 mg/ml y el cultivo muestra prácticamente la misma velocidad de crecimiento que en el medio de cultivo inicial.
Esta primera etapa comienza con una viabilidad de la línea celular entre el 80 y el 100% y las células se crecen en medios de cultivo con una reducción consecutiva de la concentración de proteína hasta una concentración de proteína crítica a la que la viabilidad celular decae hasta el 0%. Esta concentración de proteína es el punto inicial de la etapa siguiente.
La segunda etapa, que se considera la etapa crítica: en esta etapa se produce una disminución de la viabilidad celular y del tiempo de duplicación de la población de las células y se necesitará más tiempo para la adaptación desde un paso de concentración de proteína a otro. Existen concentraciones de proteína críticas en el medio de cultivo que no es posible evitar durante el proceso de adaptación. Estas concentraciones de proteína críticas son específicas para cada línea celular recombinante, pero habitualmente están por debajo de 0,6 mg/ml. Una vez que las células han recuperado la viabilidad y la velocidad de crecimiento iniciales a estas concentraciones de proteína críticas es posible llevar a cabo el subcultivo a la condición siguiente con menor concentración de proteína.
Después que se ha fijado la concentración de proteína crítica, la concentración superior más próxima que permite el crecimiento celular se considera como la concentración de proteína precrítica. A partir de la concentración precrítica, la concentración de proteína se reduce lentamente hasta que las células recuperan la viabilidad y la velocidad de crecimiento iniciales.
La combinación seleccionada de pasos para reducir la concentración de proteína en la etapa crítica determinará el... [Seguir leyendo]
Reivindicaciones:
ººººººººººººººººººººººººººººººººººººººººººººººººººººººººººººººººººººººººººººººº
1. Un procedimiento para obtener una línea celular recombinante de mieloma de mamífero adaptada al crecimiento en medios sin suero ni proteínas que comprende dos etapas:
I. Una primera etapa en la que la viabilidad de la línea celular está entre el 80 y el 100% y las células se crecen en medios de cultivo con una reducción consecutiva de la concentración de proteína hasta alcanzar una concentración de proteína crítica a la que la viabilidad celular decae hasta el 0%; y
II. Una segunda etapa en la que, una vez que se ha predeterminado la concentración crítica, la concentración precrítica se fija como una concentración de proteína tal a la que es posible el crecimiento celular y es el punto de partida para reducir lentamente la concentración de proteína hasta que el cultivo celular alcanza la viabilidad celular y el tiempo de duplicación de la población iniciales.
2. El procedimiento según la reivindicación 1, en el que la primera etapa consta de los pasos siguientes:
i. La siembra de tres pocillos en la placa de cultivo de seis pocillos con la línea celular recombinante de mieloma de mamífero en el medio de cultivo celular estándar con la concentración de proteína inicial, en que la densidad celular está en el intervalo de 1 a 5 x 105 células/ml y la sustitución, después de 48 horas, de la mitad del sobrenadante por medio fresco sin proteínas, lo que resulta en una concentración final de proteína que es el 50% de la condición de partida.
ii. La sustitución completa del sobrenadante cada 48 horas por medio de cultivo fresco con una concentración de proteína que es el 50% de la condición de partida.
iii. El crecimiento de las células hasta confluencia en el medio con el 50% de la concentración inicial de proteína.
iv. La siembra de las células del paso iii en al menos tres pocillos a una densidad en el intervalo de 1 a 5 x 105 células/ml en un medio de cultivo con una concentración de proteína que es el 50% de la condición de partida, en que después de 48 horas se sustituye la mitad del sobrenadante por medio fresco sin proteínas, lo que resulta en una concentración final de proteína que es el 50% de la condición anterior.
v. La sustitución completa del sobrenadante cada 48 horas por medio de cultivo fresco con una concentración de proteína que es el 50% de la condición anterior.
vi. El crecimiento de las células hasta confluencia en el medio con el 50% de la concentración de proteína anterior.
vii. La repetición de los pasos (iv) a (vi), en que durante cada ciclo la concentración de proteína se reduce al 50% de la concentración del ciclo anterior, hasta que se alcanza una concentración de proteína que causa la muerte celular.
3. El procedimiento según la reivindicación 1 en el que la segunda etapa consta de los pasos siguientes:
viii. La siembra de células de mieloma de mamífero de un cultivo celular con una viabilidad del 80% o superior que crece en la concentración de proteína precrítica en al menos tres pocillos a una densidad en el intervalo de 2 a 6 x 105 células/ml, el crecimiento de las células en la concentración de proteína precrítica y, después de 48 horas, la sustitución del 25% del sobrenadante por medio fresco sin proteínas, lo que resulta en una concentración final de proteína que es el 75% de la concentración de proteína precrítica.
ix. La sustitución completa del sobrenadante cada 48 horas por medio de cultivo fresco con una concentración de proteína que es el 75% de la concentración de proteína precrítica.
x. El crecimiento de las células hasta confluencia en el medio con el 75% de la concentración de proteína precrítica.
xi. La siembra de una línea celular derivada del paso anterior en al menos tres pocillos a una densidad en el intervalo de 2 a 6 x 105 en un medio que contiene el 75% de la concentración de proteína precrítica y después de 48 horas la sustitución del 25% del sobrenadante por medio fresco sin proteínas, lo que resulta en una concentración final de proteína que es el 75% de la concentración anterior.
xii. La sustitución completa del sobrenadante cada 48 horas por medio de cultivo fresco con una concentración de proteína que es el 75% de la concentración anterior.
xiii. El crecimiento de las células hasta confluencia en el medio con el 75% de la concentración de proteína anterior.
xiv. La repetición de los pasos (xi) a (xiii), reduciendo la concentración de proteína en cada ciclo al 75% de la concentración usada en el ciclo anterior, hasta alcanzar una concentración de proteína tal que cuando las células se transfieren a una concentración inferior, crecen con una viabilidad y tiempo de duplicación similares a los originales, de modo que una disminución posterior de la concentración de proteína no afecta a la viabilidad ni al tiempo de duplicación.
4. El procedimiento según las reivindicaciones 1 a 3, en que el medio que contiene suero y proteínas en
el que las células se siembran inicialmente comprende entre el 5 y el 10% de suero bovino fetal.
5. El procedimiento según la reivindicación 4, en que la línea celular recombinante de mieloma de mamífero es la línea celular NSO.
6. El procedimiento según la reivindicación 5, en que dicha línea celular NSO contiene una secuencia que codifica un polipéptido recombinante o una proteína recombinante que codifica un anticuerpo recombinante o un fragmento de este.
5
7. El procedimiento según la reivindicación 6, en que dicha línea celular NSO contiene una secuencia que codifica el anticuerpo hR3 dirigido contra el receptor de EGF.
8. Uso del procedimiento según las reivindicaciones 1 a 6 para obtener una línea celular de mieloma de mamífero adaptada al crecimiento en medios sin suero ni proteínas.
Patentes similares o relacionadas:
AGENTE INMUNOTERAPÉUTICO PARA CD37 Y COMBINACIÓN CON UN AGENTE QUIMIOTERAPÉUTICO BIFUNCIONAL DEL MISMO, del 21 de Noviembre de 2011, de Emergent Product Development Seattle, LLC: Una molécula de unión específica a CD37, que comprende una secuencia de aminoácidos como se muestra en el SEQ ID NO. 253
BLOQUEO DE LA MIGRACIÓN DE LEUCOCITOS Y DE LA INFLAMACIÓN POR INTERFERENCIA CON CD99/HEC2, del 17 de Noviembre de 2011, de CORNELL RESEARCH FOUNDATION, INC.: Un anticuerpo anti-CD99 que inhibe la migración transendotelial (MTE) de leucocitos mediada por CD99, para uso en un procedimiento para el tratamiento de una estado […]
ENSAYOS Y MÉTODOS USANDO BIOMARCADORES, del 21 de Septiembre de 2011, de GENENTECH, INC.: Un procedimiento para predecir la sensibilidad de una muestra de tejido o de células de mamífero a un anticuerpo agonista de DR4 o anticuerpo agonista de DR5, […]
FRAGMENTO DE ANTICUERPO CAPAZ DE MODULAR LA MULTIRRESISTENCIA Y COMPOSICIONES Y KITS Y MÉTODOS QUE UTILIZAN EL MISMO, del 2 de Septiembre de 2011, de TECHNION RESEARCH AND DEVELOPMENT FOUNDATION, LTD.: Un anticuerpo Fv monocatenario que comprende una región de fijación de antígeno capaz de fijar una porción extracelular de una glicoproteína P, en donde el anticuerpo […]
PREVENTIVO O REMEDIO PARA ENFERMEDADES INFLAMATORIAS DEL INTESTINO QUE CONTIENE ANTICUERPO ANTI-CD81 COMO PRINCIPIO ACTIVO, del 16 de Agosto de 2011, de DAINIPPON SUMITOMO PHARMA CO., LTD.: Uso de anticuerpo anti-CD81 para la preparación de una composición farmacéutica para prevenir, mejorar o tratar enfermedad inflamatoria del intestino (EII)
 UTILIZACIÓN DE UN ANTICUERPO ANTI-CD151 PARA EL TRATAMIENTO DEL CÁNCER, del 21 de Junio de 2011, de PIERRE FABRE MEDICAMENT: Uso de al menos un anticuerpo o uno de sus fragmentos funcionales, capaz de unirse a la proteína CD151 y de inhibir así el crecimiento tumoral para la preparación […]
UTILIZACIÓN DE UN ANTICUERPO ANTI-CD151 PARA EL TRATAMIENTO DEL CÁNCER, del 21 de Junio de 2011, de PIERRE FABRE MEDICAMENT: Uso de al menos un anticuerpo o uno de sus fragmentos funcionales, capaz de unirse a la proteína CD151 y de inhibir así el crecimiento tumoral para la preparación […]
 ANTICUERPOS CONTRA EL RECEPTOR DEL FACTOR I DE CRECIMIENTO SIMILAR A INSULINA Y USOS DE LOS MISMOS, del 6 de Junio de 2011, de F. HOFFMANN-LA ROCHE AG: Anticuerpo ligante de IGF-1R humano, caracterizado porque comprende: a) una cadena pesada de anticuerpo que comprende como CDRs, la CDR1 de aminoácidos 31 a 35, la CDR2 de […]
ANTICUERPOS CONTRA EL RECEPTOR DEL FACTOR I DE CRECIMIENTO SIMILAR A INSULINA Y USOS DE LOS MISMOS, del 6 de Junio de 2011, de F. HOFFMANN-LA ROCHE AG: Anticuerpo ligante de IGF-1R humano, caracterizado porque comprende: a) una cadena pesada de anticuerpo que comprende como CDRs, la CDR1 de aminoácidos 31 a 35, la CDR2 de […]
COMPOSICIONES FARMACÉUTICAS DE ANTICUERPOS PARA ENFERMEDADES CAUSADAS POR VIRUS, del 3 de Junio de 2011, de THERANOR SPRL: Una composición farmacéutica para usar en el tratamiento de una enfermedad causada por virus de la gripe en seres humanos, conteniendo dicha composición una […]