ENDOPRÓTESIS BIOEROSIONABLES CON CAPAS INORGÁNICAS BIOESTABLES.
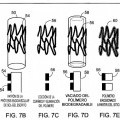
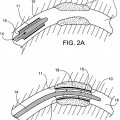
Un stent que tiene un grosor de pared, comprendiendo el stent una capa bioestable (11;
31; 45; 56) sobre una estructura subyacente bioerosionable (25; 35; 46; 58), en la que la capa bioestable es aproximadamente el 5% o menos del grosor de la pared
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2007/078476.
Solicitante: BOSTON SCIENTIFIC SCIMED, INC..
Nacionalidad solicitante: Barbados.
Dirección: P.O. BOX 1317 SEASTON HOUSE, HASTINGS CHRIST CHURCH, BARBADOS, WEST BARBADOS.
Inventor/es: WEBER,JAN, SCHEWE,SCOTT,R, ATANASOSKA,Liliana.
Fecha de Publicación: .
Fecha Solicitud PCT: 14 de Septiembre de 2007.
Clasificación Internacional de Patentes:
- A61L31/02B
- A61L31/08B
- A61L31/16 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61L PROCEDIMIENTOS O APARATOS PARA ESTERILIZAR MATERIALES U OBJECTOS EN GENERAL; DESINFECCION, ESTERILIZACION O DESODORIZACION DEL AIRE; ASPECTOS QUIMICOS DE VENDAS, APOSITOS, COMPRESAS ABSORBENTES O ARTICULOS QUIRURGICOS; MATERIALES PARA VENDAS, APOSITOS, COMPRESAS ABSORBENTES O ARTICULOS QUIRURGICOS (conservación de cuerpos o desinfección caracterizada por los agentes empleados A01N; conservación, p. ej. esterilización de alimentos o productos alimenticios A23; preparaciones de uso medico, dental o para el aseo A61K). › A61L 31/00 Materiales para otros artículos quirúrgicos. › Materiales biológicamente activos, p. ej. sustancias terapéuticas.
Clasificación PCT:
- A61L31/08 A61L 31/00 […] › Materiales para revestimientos.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia.
PDF original: ES-2357661_T3.pdf
Fragmento de la descripción:
Campo técnico
Esta invención se refiere a dispositivos médicos, como endoprótesis, y a los procedimientos para su fabricación y uso.
ANTECEDENTES
El organismo incluye diversas vías de paso entre las que se incluyen vasos sanguíneos, como las arterias, y otras luces del organismo. A veces estas vías de paso se ocluyen o debilitan. Por ejemplo, pueden estar ocluidas por un tumor, restringidas por una placa o debilitadas por un aneurisma. Cuando esto sucede, la vía de paso puede abrirse de nuevo y reforzarse, o incluso recolocarse con una endoprótesis médica. Una endoprótesis es un implante artificial que se coloca típicamente en una vía de paso o luz en el organismo. Muchas endoprótesis son componentes tubulares, entre cuyos ejemplos se incluyen los stents, stents con injerto o stents recubiertos.
Muchas endoprótesis pueden implantarse dentro del organismo mediante un catéter. Típicamente, el catéter admite un tamaño reducido o una forma compacta de la endoprótesis durante su transporte hasta un sitio deseado del organismo, por ejemplo, el sitio de debilitamiento u oclusión en una luz del organismo. Tras alcanzar el sitio deseado, la endoprótesis se instala, de modo que pueda entrar en contacto con las paredes de la luz.
Un procedimiento de implante supone expandir la endoprótesis. La mecánica de expansión utilizada para colocar la endoprótesis puede incluir forzarla a expandirse radialmente. Por ejemplo, la expansión puede lograrse mediante un catéter que lleva un globo junto con una endoprótesis expandible con globo de tamaño reducido con respecto a su forma final en el organismo. El globo se infla para deformar y/o expandir la endoprótesis con intención de fijarla en una posición determinada en contacto con la pared de la luz. A continuación, el globo puede desinflarse y el catéter retirarse.
Cuando la endoprótesis avanza a lo largo del organismo, puede controlarse su progreso, es decir, hacer un seguimiento, de modo que la endoprótesis puede colocarse de forma adecuada en el lugar objetivo. Una vez que la endoprótesis se ha implantado en el sitio objetivo, puede controlarse la endoprótesis para determinar si se ha colocado de forma adecuada y/o está funcionando correctamente. Entre los procedimientos de seguimiento y control de un dispositivo médico se incluyen la fluoroscopia de rayos X y la adquisición de imágenes por resonancia magnética nuclear (RMN).
El documento US2004/039438 muestra una endoprótesis que comprende una capa base de acero inoxidable o nitinol, partículas metálicas en la capa base que forman una estructura porosa y óxido de iridio o nitrato de titanio aplicado a la superficie expuesta de la estructura porosa. El documento US2005/159805 muestra un implante que tiene una capa catalítica en la parte superior de la estrucura de la pared del implante. El documento US6245104 muestra una endoprótesis que tiene una pared de la endoproteisis formada por una capa metálica, una capa de oro sobre la capa metálica, una capa de óxido de iridio sobre la capa de oro y un vehículo biodegradable fuera de la capa de óxido de iridio.
RESUMEN
En un aspecto, la invención presenta una endoprótesis, p. ej., una endoprótesis, que tiene una capa bioestable sobre una estructura subyacente bioerosionable, donde la capa bioestables es de aproximadamente el 5% o menos del espesor de la pared.
En otro aspecto, la invención presenta un procedimiento para fabricar una endoprótesis, p. ej., un stent, que tiene una capa bioestable y un estructura subyacente.
En otro aspecto más, la invención presenta un procedimiento que incluye implantar una endoprótesis, por ejemplo un stent, que tiene una capa bioestable y una estructura subyacente en una vía de paso del organismo para estimular la unión de las células endoteliales al stent o controlar la velocidad de erosión de la estructura subyacente.
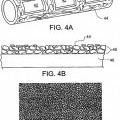
Las realizaciones pueden incluir una o más de las siguientes características. La capa bioestable de la endoprótesis, p. ej., stent, tiene una o más de las siguientes características: un espesor medio de aproximadamente 10 a 20 nm, un volumen medio dentro del intervalo de aproximadamente 5.000 a 20.000 micrómetros cúbicos por milímetro cuadrado de área superficial del stent; incluye material cerámico, incluye uno o más óxidos metálicos, incluye un o más de entre óxido de titanio, óxido de rutenio u óxido de iridio, incluye una forma cristalina de óxido de titanio; incluye diversos nódulos de aproximadamente 15-20 nm de tamaño, está en una superficie del stent, p. ej., una superficie interna, una superficie externa o una pared lateral, del stent; está recubierta, totalmente o en parte, por una capa bioerosionable y/o es una monocapa. En realizaciones, la estructura subyacente bioerosionable incluye uno o más materiales bioerosionables elegidos entre uno o más metales bioerosionables, una aleación metálica bioerosionable o un no metal bioerosionable.
En realizaciones, las endoprótesis, p. ej., stents, incluyen: una o más monocapas de un óxido metálico, un material orgánico, un material polimérico o un material biológico, y/o además incluyen al menos un agente terapéutico,
p. ej., paclitaxel.
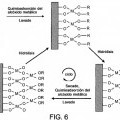
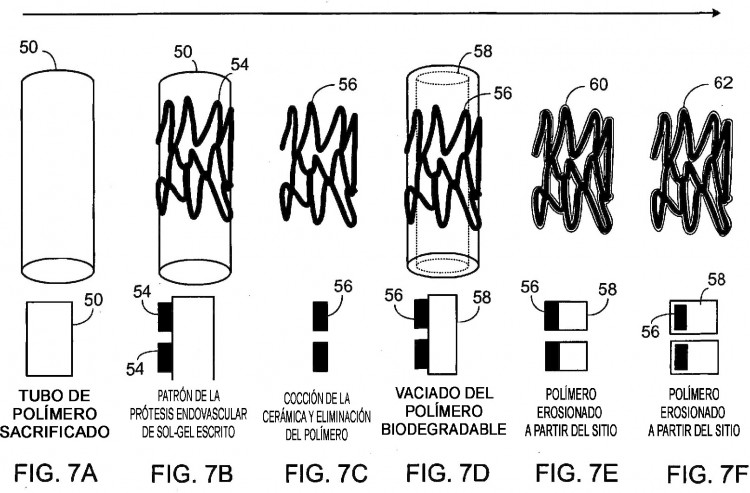
Otras realizaciones pueden incluir una o más de las siguientes características. La capa bioestable está formada mediante un proceso sol-gel. En realizaciones, el proceso de fabricación de la capa bioestable incluye: modificar una porción seleccionada de la superficie de una estructura subyacente con grupos hidroxilo, permitir que los grupos hidroxilo reaccionen con uno o más alcóxidos metálicos para formar una capa bioestable unida covalentemente de los uno o más alcóxidos metálicos; (opcionalmente) eliminar el exceso adsorbido de alcóxido metálico e hidrolizar la superficie unida covalentemente de la capa bioestable. En realizaciones, el proceso de fabricación de la endoprótesis, p. ej. el stent, que tiene una capa bioestable y una estructura bioerosionable incluye aplicar la capa bioestable sobre una superficie de un polímero sustancialmente tubular, exponer la capa bioestable a una temperatura suficientemente elevada como para eliminar el polímero tubular sin que esto afecte sustancialmente a la capa bioestable y aplicar un polímero biodegradable a la capa bioestable. En realizaciones, el proceso además incluye aplicar una capa de polímero bioestable al menos a una porción de la capa bioestable.
Otras realizaciones pueden incluir una o más de las siguientes características, al menos una porción del stent se degrada a lo largo del tiempo dentro del organismo y libera el agente terapéutico; y/o el stent se implanta en una vía de paso cardiovascular.
Un dispositivo médico erosionable o bioerosionable, p. ej., un stent, se refiere a un dispositivo, o a una porción del mismo, que muestra una reducción de la masa o de la densidad o una transformación química sustanciales, tras su introducción en un paciente, p. ej., un paciente humano. La reducción de masa puede producirse, p. ej., mediante disolución del material que forma el dispositivo y/o fragmentación del dispositivo. La transformación química puede incluyen oxidación/reducción, hidrólisis, sustitución, reacciones electroquímicas, reacciones de adición u otras reacciones químicas del material a partir del cual se fabrica el dispositivo, o una porción del mismo. La erosión puede ser el resultado de una interacción química y/o biológica del dispositivo con el entorno del organismo, p. ej., el organismo en sí y los fluidos corporales, dentro del cual se implanta y/o la erosión puede estar desencadenada por la aplicación de una influencia desencadenante, como un reactivo químico o energía, al dispositivo, por ejemplo, aumentar una velocidad de reacción. Por ejemplo, un dispositivo, o parte del mismo, puede estar formado por un material activo,
p. ej., Mg o Ca o una aleación de los mismos, y que puede erosionarse mediante la reacción con el agua, produciendo el correspondiente óxido de metal y gas hidrógeno (reacción redox). Por ejemplo, un dispositivo o una porción del mismo pueden estar formados por un polímero erosionable o bioerosionable, una aleación o mezcla de polímeros erosionables o bioerosionables que pueden erosionarse mediante la hidrólisis con agua. La erosión tiene lugar hasta un nivel deseable en un periodo de tiempo que puede proporcionar beneficio terapéutico. Por ejemplo, en realizaciones, el dispositivo muestra una reducción de masa sustancial tras un periodo de tiempo que es una función... [Seguir leyendo]
Reivindicaciones:
1. Un stent que tiene un grosor de pared, comprendiendo el stent una capa bioestable (11; 31; 45; 56) sobre una estructura subyacente bioerosionable (25; 35; 46; 58), en la que la capa bioestable es aproximadamente el 5% o menos del grosor de la pared.
2. El stent de la reivindicación 1, en el que la capa bioestable (11; 31; 45; 56) tiene un espesor medio de aproximadamente 10 a 20 mm y un volumen medio dentro del intervalo de aproximadamente 5.000 a 20.000 micrómetros cúbicos por milímetro cuadrado de área superficial del stent.
3. El stent de cualquiera de las reivindicaciones 1-2, en el que la capa bioestable (11; 31; 45; 56) comprende material cerámico, uno o más óxidos de metal, o una combinación de ambos.
4. El stent de la reivindicación 1, en el que la capa bioestable (11; 31; 45; 56) comprende óxido de titanio, óxido de rutenio, óxido de iridio o una combinación de los mismos.
5. El stent de cualquiera de las reivindicaciones 1-2, en el que la capa bioestable (11; 31; 45; 56) comprende una forma cristalina de óxido de titanio.
6. El stent de la reivindicación 1, en el que la capa bioestable (11; 31; 45; 56) comprende diversos nódulos de un tamaño aproximado de 15-20 nm.
7. El stent de la reivindicación 1, en el que la estructura subyacente bioerosionable (25; 35, 46; 58) comprende uno o más materiales bioerosionables seleccionados entre el grupo compuesto por un metal bioerosionable, una aleación de un metal bioerosionable y un no metal bioerosionable.
8. El stent de la reivindicación 1, en el que la capa bioestable (11; 31; 45; 56) está en una superficie del stent, en el que la capa bioestable está en una superficie interna, una superficie externa, una pared lateral o una combinación de los mismos.
9. El stent endovascular de la reivindicación 1, en el que al menos una porción de la capa bioestable (11; 31; 45; 56) está cubierta por una capa bioerosionable.
10. El stent de la reivindicación 1, en el que la capa bioestable (11; 31; 45; 56) se forma mediante un proceso sol-gel.
11. El stent de la reivindicación 1, en el que la capa bioestable (11; 31; 45; 56) es una monocapa.
12. El stent de la reivindicación 1, que comprende una o más monocapas de un óxido metálico, un material orgánico, un material polimérico, un material biológico o una combinación de los mismos.
13. El stent de la reivindicación 1, que además comprende al menos un agente terapéutico.
14. El stent de la reivindicación 13, en el que el agente terapéutico es paclitaxel.
15. Un procedimiento de fabricación del stent de la reivindicación 1, que comprende: modificar una porción seleccionada de la superficie de la estructura subyacente con grupos hidroxilo; permitir que los grupos hidroxilo reaccionen con uno o más alcóxidos metálicos para formar una monocapa superficial unida covalentemente de uno o más de los alcóxidos metálicos; e hidrolizar la monocapa superficial unida covalentemente.
16. El procedimiento de la reivindicación 15, que además comprende aplicar una capa de un polímero bioerosionable sobre al menos una porción de la capa bioestable.
17. El procedimiento de la reivindicación 15, que además comprende eliminar el exceso de alcóxido metálico absorbido.
18. Un procedimiento de fabricación del stent de la reivindicación 1, que comprende: formar la capa bioestable sobre una superficie de un polímero sustancialmente tubular; exponer la capa bioestable a una temperatura suficientemente elevada para eliminar el polímero tubular, mientras que la capa bioestable permanece sustancialmente intacta; y aplicar un polímero bioerosionable a la capa bioestable.
19. El procedimiento de la reivindicación 18, que además comprende aplicar una capa de polímero bioerosionable sobre al menos una porción de la capa bioestable.
Patentes similares o relacionadas:
Endoprótesis híbrida helicoidal, del 22 de Julio de 2020, de MEDINOL LTD.: Componente de endoprótesis principal para formar una endoprótesis, que comprende: una sola tira que tiene una pluralidad de arrollamientos […]
Dispositivo médico que tiene un revestimiento que comprende ACCS, del 15 de Julio de 2020, de Noveome Biotherapeutics, Inc: Un dispositivo médico implantable que tiene un revestimiento en su superficie, útil para la implantación quirúrgica en el cuerpo de un sujeto, […]
Composición de fármaco y revestimiento asociado, del 1 de Julio de 2020, de W.L. GORE & ASSOCIATES, INC.: Un producto sanitario para administrar un agente terapéutico a un tejido, y el producto tiene una capa de revestimiento aplicada en una superficie del producto, y la capa […]
Método de preparación de un artículo elastomérico antimicrobiano, del 20 de Mayo de 2020, de ALLEGIANCE CORPORATION: Un método de preparación de un artículo elastomérico antimicrobiano, que comprende: recubrir un artículo elastomérico con una composición de recubrimiento antimicrobiano […]
Formulación de Mesna y su uso, del 29 de Abril de 2020, de AuXin Surgery SA: Un dispositivo para administrar una formulación de Mesna a tejidos y/u órganos, que comprende una primera cámara que comprende el Mesna en forma sólida, una segunda cámara […]
Nuevos dispositivo médico y composición para ingeniería tisular basados en A-PRP, máquinas y procesos de fabricación, del 18 de Marzo de 2020, de Regen Lab SA: Una composición que comprende al menos un ácido hialurónico de bajo peso molecular y al menos un ácido hialurónico de alto peso molecular caracterizada por que: […]
Método de fabricación de dispositivos médicos antitrombogénicos, del 12 de Febrero de 2020, de Covidien LP (100.0%): Un metodo para proporcionar un dispositivo medico, en donde el dispositivo medico comprende: un cuerpo tubular expandible que comprende una pluralidad de […]
Emulsiones de copolímero de politetrafluoroetileno, del 12 de Febrero de 2020, de W.L. GORE & ASSOCIATES, INC.: Un método de preparación de una emulsión de agua en disolvente que comprende un copolímero de tetrafluoroetileno disuelto en un disolvente orgánico miscible […]