SUSTANCIA AMORFA DE UN DERIVADO TRICICLICO DE TRIAZOLOBENZAZEPINA.
Un compuesto amorfo de 2-(1-isopropoxi-carboniloxi-2-metilpropil)-7,
8-dimetoxi-4(5H),10-dioxo-2H-1,2,3-triazolo[4,5-c][1]benzazepina que no tiene picos de difracción en un patrón de difracción de rayos X en polvo y una solubilidad de 15 a 20 µg/mL en una solución de metilcelulosa al 1% en peso a 37ºC
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/JP02/13558.
Solicitante: MEIJI SEIKA KAISHA, LTD..
Nacionalidad solicitante: Japón.
Dirección: 4-16, KYOBASHI 2-CHOME, CHUO-KU,TOKYO 104-8002.
Inventor/es: ISHIKURA,TOYOAKI,PHARMACEUTICAL RESEARCH CENTER, ISHIZAWA,TAKAYUKI,PHARMACEUTICAL RESEARCH CENTER, SUEMUNE,KENJI,PHARMACEUTICAL RESEARCH CENTER, ISHIWATA,MAYUMI,PHARMACEUTICAL RESEARCH CENTER, UDAGAWA,CHIKAKO,PHARMACEUTICAL RESEARCH CENTER.
Fecha de Publicación: .
Fecha Concesión Europea: 2 de Junio de 2010.
Clasificación Internacional de Patentes:
- C07D487/04 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 487/00 Compuestos heterocíclicos que contienen átomos de nitrógeno como únicos heteroátomos del ciclo en el sistema condensado, no previstos por los grupos C07D 451/00 - C07D 477/00. › Sistemas condensados en orto.
Clasificación PCT:
- A61K31/55 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › que tienen ciclos con siete eslabones, p. ej. azelastina, pentilentetrazol.
- A61K47/38 A61K […] › A61K 47/00 Preparaciones medicinales caracterizadas por los ingredientes no activos utilizados, p. ej. portadores o aditivos inertes; Agentes de direccionamiento o agentes modificadores enlazados químicamente al ingrediente activo. › Celulosa; Sus derivados.
- A61K9/14 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › en estado especial, p. ej. polvos (microcápsulas A61K 9/50).
- A61P29/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes analgésicos, antipiréticos o antiinflamatorios que no actúan sobre el sistema nervioso central, p. ej. agentes antirreumáticos; Antiinflamatorios no esteroideos (AINEs).
- A61P37/08 A61P […] › A61P 37/00 Medicamentos para el tratamiento de problemas inmunológicos o alérgicos. › Agentes antialérgicos (agentes antiasmáticos A61P 11/06; antialérgicos oftálmicos A61P 27/14).
- C07D487/04 C07D 487/00 […] › Sistemas condensados en orto.
Clasificación antigua:
- A61K31/55 A61K 31/00 […] › que tienen ciclos con siete eslabones, p. ej. azelastina, pentilentetrazol.
- A61K47/38 A61K 47/00 […] › Celulosa; Sus derivados.
- A61K9/14 A61K 9/00 […] › en estado especial, p. ej. polvos (microcápsulas A61K 9/50).
- A61P29/00 A61P […] › Agentes analgésicos, antipiréticos o antiinflamatorios que no actúan sobre el sistema nervioso central, p. ej. agentes antirreumáticos; Antiinflamatorios no esteroideos (AINEs).
- A61P37/08 A61P 37/00 […] › Agentes antialérgicos (agentes antiasmáticos A61P 11/06; antialérgicos oftálmicos A61P 27/14).
- C07D487/04 C07D 487/00 […] › Sistemas condensados en orto.
Fragmento de la descripción:
Sustancia amorfa de un derivado tricíclico de triazolobenzazepina.
Antecedentes de la invención
La presente invención se refiere a 2-(1-isopropoxicarboniloxi-2-metilpropil)-7,8-dimetoxi-4(5H),10-dioxo-2H-1,2,3-triazolo[4,5-c][1]benzazepina, que está en forma amorfa y posee disolución y absorción mejoradas, y a una composición farmacéutica que comprende la misma.
2-(1-isopropoxicarboniloxi-2-metilpropil)-7,8-dimetoxi-4(5H),10-dioxo-2H-1,2,3-triazolo[4,5-c][1]benzazepina (de aquí en adelante denominado como "compuesto A") es un compuesto, representado por la siguiente fórmula estructural química, como se divulga en WO 99/16770 (Patente japonesa No. 3188482 y patente de EE. UU. No. 6372735)

Tras la administración oral, este compuesto muestra una acción estabilizadora de la membrana de células cebadas y una actividad inhibidora contra inflamación alérgica y por tanto se espera que se use clínicamente como agentes antialérgicos orales. Sin embargo, puesto que el compuesto A, cuando se usa en forma cristalina (de aquí en adelante denominado como "compuesto A cristalino"), es poco soluble, el compuesto contenido en una formulación apenas se absorbe en el aparato digestivo y es menos probable que se absorba en el cuerpo. Por tanto, se requiere mejorar la solubilidad y biodisponibilidad del compuesto A cristalino para el diseño y producción de preparaciones orales.
Los presentes inventores han intentado varios métodos en vista a mejorar la solubilidad de compuesto A cristalino. Como resultado, se encontró que la disolución del compuesto A cristalino con ayuda de un aditivo ácido o básico es difícil debido a la ausencia de un grupo funcional, que se disocie o protone en un intervalo de pH farmacéuticamente aceptable, en la estructura del compuesto A. Además, incluso después añadir compuestos de inclusión tales como ciclodextrinas o varios agentes tensioactivos, compuestos poliméricos o similares, el compuesto A cristalino no se pudo solubilizar sustancialmente sin dificultades. Además, la solubilidad del compuesto A cristalino en glicerina, propilenglicol, Macrogol 400 y similares no estaba a tal nivel que hiciera el compuesto A cristalino farmacéuticamente utilizable. Además, se llevó a cabo un experimento en el que se prepara un cristal pulverizado de compuesto A cristalino según la descripción de la patente japonesa accesible al público No. 185013/1987 que divulga un fármaco, que se ha hecho fácilmente absorbible mediante pulverización. El fármaco tratado se administra por vía oral a animales de experimentación tales como perros. Como resultado, se encontró que una mejora en absorción de preparaciones usando compuesto A cristalino no es más de la esperada.
Una técnica conocida para mejorar la disolución del compuesto cristalino apenas soluble es convertir el compuesto cristalino en un compuesto amorfo (por ejemplo, Yu L., Advanced Drug Delivery Reviews, Vol. 48, p. 29, 2001). Los ejemplos específicos de la misma incluyen fusión por calor, cristalización rápida mediante la adición de un solvente apenas soluble, liofilización, secado por atomización, preparación de una dispersión sólida, conversión mecanoquímica (tal como conminución) y deshidratación de un hidrato cristalino. Sin embargo, la mayoría de las técnicas comunes para hacer los fármacos amorfos no se pudieron aplicar al compuesto A cristalino debido a la aparición de fenómenos desfavorables incluyendo que el compuesto A cristalino se descompone tras fusión por calor debido a la cercanía del punto de fusión al punto de descomposición; se observa la precipitación como un cristal incluso mediante el método de cristalización rápida; no hay un solvente adecuado para liofilización; el compuesto A cristalino no se funde por calor incluso en una sustancia plástica térmica e, incluso cuando se disuelve en un solvente junto con varios aditivos, produce cristalización durante la eliminación del solvente por destilación a presión reducida (es decir, no se puede preparar una dispersión sólida por el método de fusión y el método de destilar el solvente); la pulverización o tratamiento de extrusión no transforma el compuesto A cristalino en amorfo o produce la formación de un producto de descomposición; y no se forma cualquier hidrato.
Compendio de la invención
Los presentes inventores han encontrado ahora que, cuando el compuesto A se disuelve en un solvente para preparar una solución que después se seca por atomización, el producto atomizado seco tiene un grado de cristalización significativamente disminuido. Sin embargo, puesto que el compuesto A cristalino apenas es soluble en agua así como en varios solventes, este método plantea una cuestión sobre la selección del solvente adecuado para el secado por atomización. Los presentes inventores han encontrado que el compuesto A cristalino se puede hacer amorfo disolviendo el compuesto A en un cierto solvente y después secando por atomización la solución. Además han encontrado que la incorporación de metilcelulosa y/o hidroxipropilmetilcelulosa pueden suprimir la cristalización del compuesto A amorfizado. La presente invención se ha hecho basada en tal descubrimiento.
Según esto, es un objeto de la presente invención proporcionar compuesto A que se ha hecho amorfo y posee solubilidad y biodisponibilidad mejoradas, una composición que comprende el mismo y procesos de producción del compuesto A y la composición.
Según la presente invención, se proporciona compuesto A amorfo que no tiene ningún pico de difracción en un patrón de difracción de rayos X en polvo y que tiene una solubilidad de 15 a 20 µg/mL en una solución de metilcelulosa al 1% en peso a 37ºC.
Según la presente invención, también se proporciona una composición que puede suprimir la cristalización del compuesto A amorfo. La composición comprende el compuesto A amorfo según la presente invención y metilcelulosa y/o hidroxipropilmetilcelulosa.
Además, según la presente invención, se proporciona un proceso para producir compuesto A amorfo. El proceso comprende los pasos de: disolver 2-(1-isopropoxicarboniloxi-2-metilpropil)-7,8-dimetoxi-4(5H),10-dioxo-2H-1,2,3-triazolo[4,5-c][1]benzazepina en cloruro de metileno para preparar una solución y después secar por atomización la solución.
Breve descripción de las figuras
La figura 1 son patrones de difracción de rayos X en polvo de compuesto A amorfo y una composición amorfa producidos en el ejemplo 1 y el ejemplo 2, respectivamente, y compuesto A cristalino producido en el ejemplo comparativo 1;
La figura 2 es un diagrama que muestra la solubilidad en agua de compuesto A amorfo producido en el ejemplo 1, composiciones amorfas producidas en los ejemplos 2 y 3 y compuesto A cristalino producido en el ejemplo comparativo 1;
La figura 3 es un diagrama que muestra la solubilidad de compuesto A amorfo en una solución acuosa de metilcelulosa al 1% en peso producido en el ejemplo 1 y compuesto A cristalino producido en el ejemplo comparativo 1;
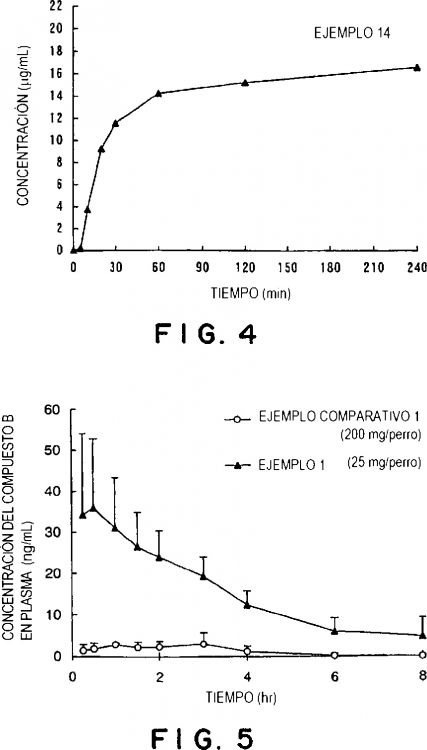
La figura 4 es un diagrama que muestra la solubilidad en agua de una preparación en cápsula que comprende compuesto A amorfo producida en el ejemplo 14; y
La figura 5 es un diagrama que muestra un cambio en el nivel de fármaco en plasma en un experimento en el que cada uno de compuesto A amorfo producido en el ejemplo 1 y compuesto A cristalino producido en el ejemplo comparativo 1 se resuspendieron en solución acuosa de metilcelulosa al 1% en peso para preparar suspensiones que después se administran por vía oral a perros beagle.
Descripción detallada de la invención
Compuesto A amorfo y proceso de producción del mismo
Compuesto A amorfo según la presente invención se refiere a un compuesto en un estado sólido que no tiene ningún pico de difracción característico en un patrón de difracción de rayos X en polvo. Además, el compuesto A amorfo según la presente invención tiene una solubilidad de 15 a 20 µg/mL en una solución de metilcelulosa al 1% en peso a 37ºC.
El compuesto A amorfo según la presente invención se puede producir disolviendo el compuesto A en cloruro de metileno y después secando por atomización la solución.
El compuesto A cristalino apenas es soluble en agua así como en varios solvente de uso general, y la solubilidad...
Reivindicaciones:
1. Un compuesto amorfo de 2-(1-isopropoxi-carboniloxi-2-metilpropil)-7,8-dimetoxi-4(5H),10-dioxo-2H-1,2,3-triazolo[4,5-c][1]benzazepina que no tiene picos de difracción en un patrón de difracción de rayos X en polvo y una solubilidad de 15 a 20 µg/mL en una solución de metilcelulosa al 1% en peso a 37ºC.
2. Una composición que comprende el compuesto amorfo según la reivindicación 1 y metilcelulosa y/o hidroxipropilmetilcelulosa.
3. La composición según la reivindicación 2, en donde la relación de mezcla del compuesto amorfo según la reivindicación 1 y la cantidad total de metilcelulosa y/o hidroxipropilmetilcelulosa está en el intervalo de 1:0,01 a 2.
4. Una composición que comprende el compuesto amorfo según la reivindicación 1 y un compuesto polimérico.
5. La composición según la reivindicación 4, en donde el compuesto polimérico es uno o al menos dos compuestos seleccionados del grupo que consiste en etilcelulosa, ftalato de hidroxipropilmetilcelulosa, hidroxipropilcelulosa, carboximetilcelulosa, polivinilpirrolidona, dietilaminoacetato de polivinilacetal, copolímero L de ácido metacrílico, copolímero E de metacrilacrilato de aminoalquilo y copolímero de acetato de vinilo-vinilpirrolidona.
6. Un proceso para producir el compuesto amorfo según la reivindicación 1, dicho proceso comprende los pasos de: disolver 2-(1-isopropoxicarboniloxi-2-metilpropil)-7,8-dimetoxi-4(5H),10-dioxo-2H-1,2,3-triazolo[4,5-c][1]benzazepina en cloruro de metileno para preparar una solución y después secar por atomización la solución.
7. Un proceso para producir la composición según la reivindicación 2 o 3, dicho proceso comprende los pasos de: disolver 2-(1-isopropoxicarboniloxi-2-metilpropil)-7,8-dimetoxi-4(5H),10-dioxo-2H-1,2,3-triazolo[4,5-c][1]benzazepina y de metilcelulosa y/o hidroxipropilmetilcelulosa en cloruro de metileno para preparar una solución y después secar por atomización la solución.
8. Un proceso para producir la composición según la reivindicación 4 o 5, dicho proceso comprende los pasos de: disolver 2-(1-isopropoxicarboniloxi-2-metilpropil)-7,8-dimetoxi-4(5H),10-dioxo-2H-1,2,3-triazolo[4,5-c][1]benzazepina y el compuesto polimérico en cloruro de metileno o un solvente mezcla cloruro de metileno/alcohol inferior para preparar una solución y después secar por atomización la solución.
9. El proceso según la reivindicación 8, en donde el alcohol inferior es un alcohol de alquilo que tiene de 1 a 3 átomos de carbono.
10. Una composición farmacéutica para administración oral, que comprende el compuesto amorfo según la reivindicación 1 o la composición según cualquiera de las reivindicaciones 2 a 5 y un soporte farmacéuticamente aceptable.
11. El compuesto amorfo según la reivindicación 1 o la composición según cualquiera de las reivindicaciones 2 a 5, para su uso como un fármaco a granel.
12. El uso del compuesto amorfo según la reivindicación 1 o la composición según cualquiera de las reivindicaciones 2 a 5, para la producción de un agente antialérgico.
Patentes similares o relacionadas:
Compuestos de heteroaril carboxamida como inhibidores de RIPK2, del 29 de Julio de 2020, de BOEHRINGER INGELHEIM INTERNATIONAL GMBH: Un compuesto de fórmula (I): **(Ver fórmula)** o sus sales farmacéuticamente aceptables, en la que: X es N y Y es CH; o X es CH y Y es N; […]
Compuestos de alquinilbenceno heterocíclicos, y composiciones médicas y usos de los mismos, del 29 de Julio de 2020, de Guangzhou Healthquest Pharma Co., Ltd: Un compuesto de alquinilbenceno heterocíclico que tiene la fórmula (I) y una sal farmacéuticamente aceptable, o estereoisómero del mismo, **(Ver […]
1,5-Dihidro-4H-pirazolo[3,4-d]pirimidin-4-onas y 1,5-dihidro-4H-pirazolo[4,3-c]piridin-4-onas como inhibidores de la PDE1, del 29 de Julio de 2020, de H. LUNDBECK A/S: Un compuesto de fórmula (I) **(Ver fórmula)** en donde Y es N o CH; R1 se selecciona del grupo que consiste en alquilo C2-C8 lineal o ramificado, cicloalquilo […]
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Ureas cíclicas como inhibidores de ROCK, del 22 de Julio de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de acuerdo con la Fórmula (I): **(Ver fórmula)** o un enantiómero, un diastereómero, un estereoisómero, un tautómero, una sal farmacéuticamente aceptable […]
Derivado heteroarilo o sal farmacéuticamente aceptable del mismo, método de preparación del mismo y composición farmacéutica para prevenir o tratar enfermedades asociadas con PI3 quinasas, que contiene el mismo como principio activo, del 22 de Julio de 2020, de KOREA RESEARCH INSTITUTE OF CHEMICAL TECHNOLOGY: Un compuesto representado por la fórmula 1, un isómero óptico del mismo o una sal farmacéuticamente aceptable del mismo: **(Ver fórmula)** en la fórmula […]
Derivados de 5-[2-(piridin-2-ilamino)-1,3-tiazol-5-il]-2,3-dihidro-1H-isoindol-1-ona y su uso como inhibidores dobles de fosfatidilinositol··3-cinasa delta y gamma, del 15 de Julio de 2020, de ASTRAZENECA AB: Compuesto de formula (I) **(Ver fórmula)** donde X es C(O) o SO2; Y es SO2NHR5 o SO2R6; R1 se selecciona de alquilo C1-4, […]
Antagonistas del receptor de dopamina D3 que tienen una unidad estructural biciclo, del 15 de Julio de 2020, de Indivior UK Limited: Un compuesto, o una sal farmacéuticamente aceptable del mismo, que tiene la fórmula: **(Ver fórmula)** en donde; A y B juntos tienen la fórmula: **(Ver […]