VECTORES RETROVIRALES TERAPEUTICOS PARA TERAPIA GENICA.
Un vector lentiviral (SIN) de auto-inactivación que comprende:
a) una LTR lentiviral izquierda (5'); b) un elemento de exportación retroviral, opcionalmente un elemento de respuesta inversa lentiviral (RRE); c) un promotor, o parte activa del mismo que tiene actividad promotora, y una región de control de locus (LCR), o parte activa del mismo que tiene actividad LCR, unido de forma operable a un gen de interés; y d) una LTR lentiviral derecha (3') que comprende las siguientes modificaciones 1) la región U3 de la LTR derecha (3') está modificada para incluir al menos un elemento aislante y 2) la región U5 de la LTR derecha (3') está modificada para sustituir toda o una parte de la región con una secuencia poli(A) ideal
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2003/039526.
Solicitante: GENETIX PHARMACEUTICALS INC.
MASSACHUSETTS INSTITUTE OF TECHNOLOGY.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 840 MEMORIAL DRIVE CAMBRIDGE, MA 02139 ESTADOS UNIDOS DE AMERICA.
Inventor/es: LEBOULCH, PHILIPPE, WESTERMAN,KAREN, PAWLIUK,ROBERT.
Fecha de Publicación: .
Fecha Solicitud PCT: 11 de Diciembre de 2003.
Fecha Concesión Europea: 21 de Julio de 2010.
Clasificación Internacional de Patentes:
- C12N15/867 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Vectores retrovirales.
Clasificación PCT:
- A01N63/00 NECESIDADES CORRIENTES DE LA VIDA. › A01 AGRICULTURA; SILVICULTURA; CRIA; CAZA; CAPTURA; PESCA. › A01N CONSERVACION DE CUERPOS HUMANOS O ANIMALES O DE VEGETALES O DE PARTES DE ELLOS (conservación de alimentos o productos alimenticios A23 ); BIOCIDAS, p. ej. EN TANTO QUE SEAN DESINFECTANTES, PESTICIDAS O HERBICIDAS (preparaciones de uso médico, dental o para el aseo que eliminan o previenen el crecimiento o la proliferación de organismos no deseados A61K ); PRODUCTOS QUE ATRAEN O REPELEN A LOS ANIMALES; REGULADORES DEL CRECIMIENTO DE LOS VEGETALES. › Biocidas, productos que repelen o atraen a los animales perjudiciales, o reguladores del crecimiento de los vegetales, que contienen microorganismos, virus, hongos microscópicos, animales, o sustancias producidas por, u obtenidas a partir de microorganismos, virus, hongos microscópicos o animales, p. ej. encimas o productos de fermentación (que contienen compuestos de constitución determinada A01N 27/00 - A01N 59/00; algas unicelulares A01N 65/03).
- C07H21/04 C […] › C07 QUIMICA ORGANICA. › C07H AZUCARES; SUS DERIVADOS; NUCLEOSIDOS; NUCLEOTIDOS; ACIDOS NUCLEICOS (derivados de ácidos aldónicos o sacáricos C07C, C07D; ácidos aldónicos, ácidos sacáricos C07C 59/105, C07C 59/285; cianohidrinas C07C 255/16; glicales C07D; compuestos de constitución indeterminada C07G; polisacáridos, sus derivados C08B; ADN o ARN concerniente a la ingeniería genética, vectores, p. ej. plásmidos o su aislamiento, preparación o purificación C12N 15/00; industria del azúcar C13). › C07H 21/00 Compuestos que contienen al menos dos unidades mononucleótido que tienen cada una grupos fosfato o polifosfato distintos unidos a los radicales sacárido de los grupos nucleósido, p. ej. ácidos nucleicos. › con desoxirribosilo como radical sacárido.
- C12N15/00 C12N […] › Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K).
- C12N15/867 C12N 15/00 […] › Vectores retrovirales.
Clasificación antigua:
- A01N63/00 A01N […] › Biocidas, productos que repelen o atraen a los animales perjudiciales, o reguladores del crecimiento de los vegetales, que contienen microorganismos, virus, hongos microscópicos, animales, o sustancias producidas por, u obtenidas a partir de microorganismos, virus, hongos microscópicos o animales, p. ej. encimas o productos de fermentación (que contienen compuestos de constitución determinada A01N 27/00 - A01N 59/00; algas unicelulares A01N 65/03).
- C07H21/04 C07H 21/00 […] › con desoxirribosilo como radical sacárido.
- C12N15/00 C12N […] › Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K).
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
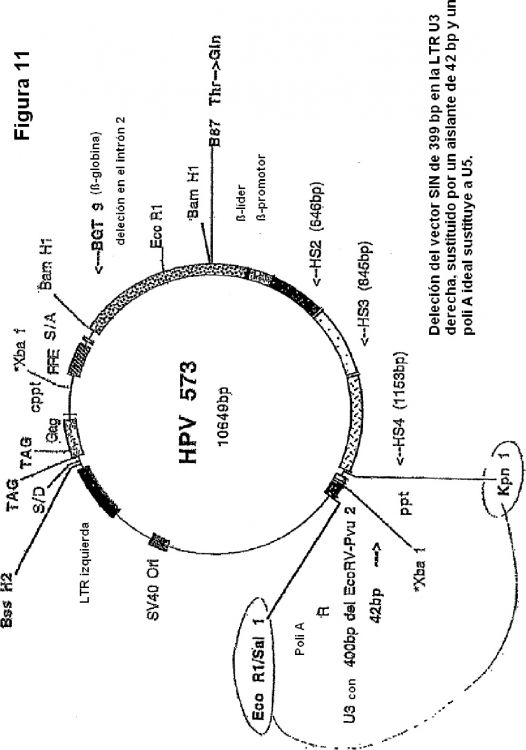
Fragmento de la descripción:
Fundamento de la invención
Las hemoglobinopatías abarcan un número de anemias de origen genético en que hay disminución de la producción y/o aumento de la destrucción (hemólisis) de glóbulos rojos (RBCs). La sangre de seres humanos adultos normales contiene hemoglobina (denominada como HbA) que contiene dos pares de cadenas de polipéptido denominadas alfa y beta. La hemoglobina fetal (HbF), que produce RBCs normales, está presente en el nacimiento, aunque la proporción de HbF disminuye durante los primeros meses de vida y la sangre de un adulto normal contiene solo aproximadamente 2% de HbF. Hay defectos genéticos que dan por resultado la producción por el cuerpo de hemoglobinas anormales con una capacidad afectada concomitante para mantener la concentración de oxígeno. Entre estas anemias derivadas genéticamente se incluyen talasemia, enfermedad de Cooley y anemia falciforme.
La anemia falciforme (SCD) es una de las enfermedades recesivas autosómicas más comunes en el mundo. La SCD llegó a ser el primer trastorno genético para el que se identificó la mutación causante a nivel molecular: la sustitución de valina por ácido glutámico en el codón 6 de la ºA-globina humana (Ingram (1957) Nature, 180:326). En homocigotos la hemoglobina anormal (Hb) [HbS(º2ºS2)] se polimeriza en largas fibras por desoxigenación dentro de los glóbulos rojos (RBCs) que se vuelven deformes o “falciformados”, rígidos y adhesivos, provocando así la oclusión de la microcirculación, anemia, infarto y daño del órgano (Stamatoyannopoulos, et al. (eds) (1994) The Molecular Basis of Blood Diseases, Saunders, Filadelfia, ed. 2; 207-256; Nagel, et al. (2001) Disorders of Hemoglobin, Cambridge Univ. Press, Cambridge; 711756).
La º-globina humana es un fuerte inhibidor de la polimerización de HbS, en contraste con la ºA-globina humana, que es eficaz solo a concentraciones muy altas (Bookchin et al. (1971) J. Mol. Biol. 60:263). Por lo tanto, se propuso la terapia génica de SCD por medio de la expresión forzada de º-globina o híbridos º/º en RBCs adultos después de la transferencia génica a células madre hematopoyéticas (HSCs) (McCune et al. (1994) PNAS USA 91:9852; Takekoshi et al. (1995) PNAS USA 92:3014; Miller et al. (1994) PNAS USA 91:10183; Emery et al. (1999) Hum. Gene Ther. 10:877; Rubin et al. (2000) Blood 95:3242; Sabatino et al. (2000) PNAS USA 97:13294; Blouin et al. (2000) Nat. Med. 6:177).
Aunque el descubrimiento de la región de control del locus (LCR) de la ºglobina humana constituyó una promesa de alcanzar altos niveles de expresión génica de globina (Tuan et al. (1985) PNAS USA 82:6384; Grosveld et al. (1987) Cell 51:975), la transferencia estable de los vectores onco-retrovirales murinos que abarcan mínimos elementos del núcleo de la LCR se probaron especialmente cambiantes (Gelinas et al. (1992) Bone Marrow Transplant 9:157; Chang et al. (1992) PNAS USA 89:3107; Plavec et al. (1993) Blood 81:1384; Leboulch et al. (1994) EMBO J 13:3065; Sadelain et al. (1995) PNAS USA 92:6728; Raftopoulos et al. (1997) Blood 90:3414; Kalberer et al. (2000) PNAS USA 97:5411). Para permitir la transferencia de LCR mayores y secuencias génicas de globina, una propuesta fue el uso de elementos de escisión de ARN y control de exportación que incluyen componentes del elemento que responde a Rev/R (RRE) del virus de inmunodeficiencia humana (VIH) (Alkan et al. (31 de mayo de 2000) presentado en papel en el 3º American Society of Gene Therapy, Denver, CO), y un vector lentiviral basado en VIH que porta RRE que había dado por resultado una mejora sustancial de la º-talasemia en ratones transplantados (May et al. (2000) Nature 406:82). Este acercamiento no fue suficiente para la completa corrección, sin embargo, ya que la expresión génica permaneció heterocelular, y la cantidad de ºAglobina humana encontrada incorporada en los tetrámeros de Hb en un origen no talasémico era improbable que fuera una terapia de éxito para la SCD (May et al., supra). Por consiguiente, permanece una necesidad de un acercamiento de terapia génica que pueda tratar con éxito la SCD y otras hemoglobinopatías.
Iwakuma et al., Virology, 261, 1999, 120-132, describe vectores del vector lentiviral de auto-inactivación (SIN) que tienen una deleción de la región LTR U3 3' (excepto para el sitio de unión de integración (attL), y sustitución de la región LTR U5 3' con una secuencia poliA de bGH.
El documento WO02087341 describe vectores lentivirales SIN con modificaciones en las LTR 5' y 3', en particular en donde las regiones R se sustituyen por las del retrovirus no lentiviral (región R “híbrida”). El TAR lentiviral se elimina. La región LTR U3 3' puede retener una secuencia att, y la región P puede comprender una secuencia poliA, junto con la región R “híbrida”. Resumen de la invención
La presente invención proporciona composiciones mejoradas para alcanzar la terapia génica en células hematopoyéticas y células precursoras hematopoyéticas, que incluyen eritrocitos, células troncales eritroides y células madre embrionarias no humanas. La invención proporciona además composiciones mejoradas para tratar trastornos relacionadas con las células hematopoyéticas.
La invención proporciona un vector de terapia génica mejorado optimizado para expresar altos niveles de una o más proteínas terapéuticas en las células eritroides o células precursoras eritroides. En una realización particular, el vector comprende un vector lentiviral optimizado que expresa una o más proteínas de anti-falciformación a niveles terapéuticos para tratar hemoglobinopatías. Los vectores lentivirales empleados en el sistema de reparto génico de la presente invención son altamente eficaces infectando e integrándose de una manera no tóxica en el genoma de las células eritroides, y manteniendo niveles terapéuticos de expresión génica específica de eritroides.
La invención proporciona un vector lentiviral de auto-inactivación (SIN) que comprende:
a) una LTR lentiviral izquierda (5');
b) un elemento de exportación retroviral, opcionalmente un elemento de res
puesta inversa lentiviral (RRE);
c) un promotor, o parte activa del mismo que tiene actividad promotora, y una
región de control de locus (LCR), o parte activa de la misma que tiene acti
vidad LCR, unido de forma operable a un gen de interés; y
d) una LTR lentiviral derecha (3') que comprende las siguientes modificacio
nes
1) la región U3 de la LTR derecha (3') se modifica para incluir al menos un
elemento aislante y
2) la región U5 de la LTR derecha (3') se modifica para sustituir toda o una
parte de la región con una secuencia poli(A) ideal.
El vector lentiviral de la invención puede comprender además un tracto de polipurina central/solapa de ADN (cPPT/FLAP), que incluye, por ejemplo, un cPPT/FLAP del VIH-1. En otra realización, el promotor de la LTR 5' se sustituye con un promotor heterólogo, que incluye, por ejemplo, promotor citomegalovirus (CMV). En aún otra realización, el vector comprende un elemento aislante que comprende un aislante de un locus de º-globina, que incluye, por ejemplo, HS4 de pollo.
En otra realización de la invención, el vector incluye un módulo de ácido nucleico que comprende un gen suicida unido de forma operable a un promotor. En una realización particular, el gen suicida es HSV timidina quinasa (HSV-Tk). El vector puede incluir además un módulo de ácido nucleico que comprende un gen para la selección in vivo de la célula, tal como un gen para la selección in vivo, por ejemplo, un gen de metilguanina metiltransferasa (MGMT).
Los vectores lentivirales de la invención comprenden además un gen de interés, que incluye, por ejemplo, un gen de globina o un gen que codifica una proteína de anti-falciformación. En una realización, el gen de globina expresado en el vector retroviral de la invención es º-globina, º-globina o º-globina. En otra realización, el gen de º-globina humana es el gen de º-globina humana natural o gen de ºA-globina humana. En otra realización, el gen de º-globina humana comprende una o más deleciones de secuencias del intrón o es un gen de º-globina humana mutado que codifica al menos un residuo de aminoácido anti-falciformación. Los aminoácidos anti-falciformación pueden derivarse a partir de la º-globina humana o la º-globina humana. En otra realización,...
Reivindicaciones:
1. Un vector lentiviral (SIN) de auto-inactivación que comprende: a) una LTR lentiviral izquierda (5'); b) un elemento de exportación retroviral, opcionalmente un elemento de res
puesta inversa lentiviral (RRE);
c) un promotor, o parte activa del mismo que tiene actividad promotora, y una región de control de locus (LCR), o parte activa del mismo que tiene actividad LCR, unido de forma operable a un gen de interés; y
d) una LTR lentiviral derecha (3') que comprende las siguientes modificaciones 1) la región U3 de la LTR derecha (3') está modificada para incluir al menos un elemento aislante y 2) la región U5 de la LTR derecha (3') está modificada para sustituir toda o una parte de la región con una secuencia poli(A) ideal.
2. El vector de auto-inactivación según la reivindicación 1, en donde el lentivirus es VIH.
3. El vector de auto-inactivación según la reivindicación 1, en donde el gen de interés es un gen que codifica una proteína de anti-falciformación o un gen de globina.
4. El vector de auto-inactivación según la reivindicación 3, en donde el gen de globina es º-globina o º-globina humana.
5. El vector de auto-inactivación según la reivindicación 4, en donde el gen de º-globina humana se selecciona de un gen de º-globina humana natural, un gen de ºglobina humana eliminado que comprende una o más deleciones de las secuencias del intrón, y un gen de º-globina humana mutado que codifica al menos un residuo aminoácido de anti-falciformación.
6. El vector de auto-inactivación según la reivindicación 5, en donde el gen de
º-globina humana mutado comprende un residuo aminoácido de anti-falciformación derivado de la º-globina humana o de la º-globina humana.
7. El vector de auto-inactivación según la reivindicación 5, en donde el gen de º-globina humana es el gen de ºA-globina humana que codifica una mutación treonina a glutamina en el codón 87 (ºA-T87Q) o un gen de ºA-globina humana.
8. El vector de auto-inactivación según la reivindicación 1, en donde el promotor comprende el promotor de º-globina humana, o una parte del mismo que tiene actividad promotora.
9. El vector de auto-inactivación según la reivindicación 1, en donde la LCR comprende la LCR de º-globina humana, o una parte de la misma que tiene actividad LCR.
10. El vector de auto-inactivación según la reivindicación 1, que comprende al menos uno de los siguientes elementos:
a) un tracto de polipurina central/solapa de ADN (cPPT/FLAP);
b) el promotor de la LTR 5' se sustituye con un promotor heterólogo; y
c) el elemento de exportación retroviral es un elemento de respuesta inversa
lentiviral (RRE).
11. El vector de auto-inactivación según la reivindicación 10, en donde el cPPT/FLAP es de VIH-1.
12. El vector de auto-inactivación según la reivindicación 10, en donde el promotor heterólogo es un promotor citomegalovirus (CMV).
13. El vector de auto-inactivación según la reivindicación 1, que comprende además un módulo de ácido nucleico que comprende un gen suicida unido de forma operable a un promotor o un gen para la selección in vivo de la célula.
14. El vector de auto-inactivación según la reivindicación 13, en donde el gen suicida es HSV timidina quinasa (HSV-Tk).
15. El vector de auto-inactivación según la reivindicación 13, en donde el gen para la selección in vivo es metilguanina metiltransferasa (MGMT).
16. El vector de auto-inactivación según la reivindicación 1, en donde el elemento aislante comprende un aislante a partir de un locus de º-globina.
17. El vector de auto-inactivación según la reivindicación 16, en donde el elemento aislante comprende HS4 de pollo.
18. El vector de auto-inactivación según la reivindicación 1, en donde el elemento aislante comprende el elemento aislante de 42 bp representado en la Figura 12 (SEQ ID NO:2).
19. El vector de auto-inactivación según la reivindicación 1, para el uso en terapia génica.
20. El vector de auto-inactivación según la reivindicación 19, en donde la terapia génica es para el tratamiento de una hemoglobinopatía.
21. El vector de auto-inactivación según la reivindicación 20, en donde la hemoglobinopatía es talasemia o anemia falciforme (SCD).
22. Una célula huésped que comprende el vector de auto-inactivación según la reivindicación 1, en donde si la célula huésped es una célula madre embrionaria, no es humana.
23. La célula huésped según la reivindicación 22, en donde la célula es una cé5 lula madre embrionaria, una célula madre somática o una célula troncal.
24. La célula huésped según la reivindicación 23, en donde la célula es un eritrocito.
25. Un método para alcanzar la expresión específica eritroide de un gen de interés, que comprende introducir in vitro un vector de auto-inactivación como se define
10 en cualquiera de las reivindicaciones 1 a 21 en una célula de eritrocito o un precursor de la misma, capaz de expresar el vector, y permitiendo la expresión del gen de interés.
26. Un vector lentiviral de auto-inactivación como se define en cualquiera de las reivindicaciones 1 a 21 para usar en el tratamiento de un proceso hemoglobinopático.
27. El uso de un vector lentiviral de auto-inactivación como se define en cualquiera de las reivindicaciones 1 a 21 en la fabricación de un medicamento para tratar un proceso hemoglobinopático.
Patentes similares o relacionadas:
Integración estable de los vectores de transferencia lentivirales SIN, del 20 de Mayo de 2020, de MOLMED SPA: Un sistema para la integracion estable de un vector de transferencia lentiviral autoinactivable (SIN) en una linea celular de empaquetamiento en donde […]
Polipéptidos para la ingeniería de proteínas integrasas quiméricas y su uso en terapia génica, del 12 de Febrero de 2020, de INSERM (INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE): Un polipéptido que consiste en la secuencia de aminoácidos seleccionada del grupo consistente en la SEQ ID NO:2 a la SEQ ID NO:12.
Aislador para mejorar vectores de transferencia génica, del 1 de Enero de 2020, de FUNDACIÓN PÚBLICA ANDALUZA PROGRESO Y SALUD: Molécula de ácido nucleico que comprende: a. la SEQ ID No 1 y la SEQ ID No 2, o una secuencia complementaria de las mismas; o b. una molécula […]
Vector retroviral que tiene actividad inmunoestimuladora, del 25 de Diciembre de 2019, de Tocagen Inc: Un vector retroviral gamma competente para la replicación recombinante que comprende: una proteína retroviral GAG; una proteína retroviral POL; una cubierta […]
Compuestos y métodos para incrementar la transferencia génica viral en células hematopoyéticas humanas, del 6 de Noviembre de 2019, de UNIVERSITE DE MONTREAL: Un método para transducir un vector viral en células, y dicho método comprende poner en contacto dichas células in vitro con un compuesto de […]
Vectores lentivirales pseudotipados, del 16 de Octubre de 2019, de Sirion Biotech GmbH: Partícula de vector lentiviral pseudotipada con (a) una proteína de fusión de glicoproteína de la envuelta del virus de la estomatitis vesicular (VSV-G) […]
Purificación de virus, del 16 de Octubre de 2019, de Oxford BioMedica (UK) Limited: Un proceso para producir una formulación de vector retroviral adecuada para la administración a un paciente, que comprende una etapa de esterilización por filtrado y una […]
Vector dual para la inhibición del virus de la inmunodeficiencia humana, del 16 de Octubre de 2019, de Calimmune Inc: Una célula hospedadora preparada transduciendo una célula hematopoyética con un vector de expresión lentiviral, comprendiendo el vector de expresión lentiviral una primera […]