Variantes de proteína C activada con actividad citoprotectora pero con actividad anticoagulante reducida.
Una variante de proteína C activada recombinante, que comprende la mutación RR229/230AA y KKK191- 193AAA.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2007/082980.
Solicitante: THE SCRIPS RESEARCH INSTITUTE.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 10550 NORTH TORREY PINES ROAD LA JOLLA, CA 92037 ESTADOS UNIDOS DE AMERICA.
Inventor/es: GRIFFIN, JOHN, H., GALE,ANDREW,J, MOSNIER,LAURENT O.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A01N1/02 NECESIDADES CORRIENTES DE LA VIDA. › A01 AGRICULTURA; SILVICULTURA; CRIA; CAZA; CAPTURA; PESCA. › A01N CONSERVACION DE CUERPOS HUMANOS O ANIMALES O DE VEGETALES O DE PARTES DE ELLOS (conservación de alimentos o productos alimenticios A23 ); BIOCIDAS, p. ej. EN TANTO QUE SEAN DESINFECTANTES, PESTICIDAS O HERBICIDAS (preparaciones de uso médico, dental o para el aseo que eliminan o previenen el crecimiento o la proliferación de organismos no deseados A61K ); PRODUCTOS QUE ATRAEN O REPELEN A LOS ANIMALES; REGULADORES DEL CRECIMIENTO DE LOS VEGETALES. › A01N 1/00 Conservación de cuerpos humanos o animales, o partes de ellos. › Conservación de partes vivas.
- A61K38/36 A […] › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Factores de coagulación sanguínea o de fibrinolisis.
- A61K38/54 A61K 38/00 […] › Mezclas de enzimas o proenzimas cubiertas por más de uno solo de los grupos A61K 38/44 - A61K 38/46 ó A61K 38/51 - A61K 38/53.
PDF original: ES-2481420_T3.pdf




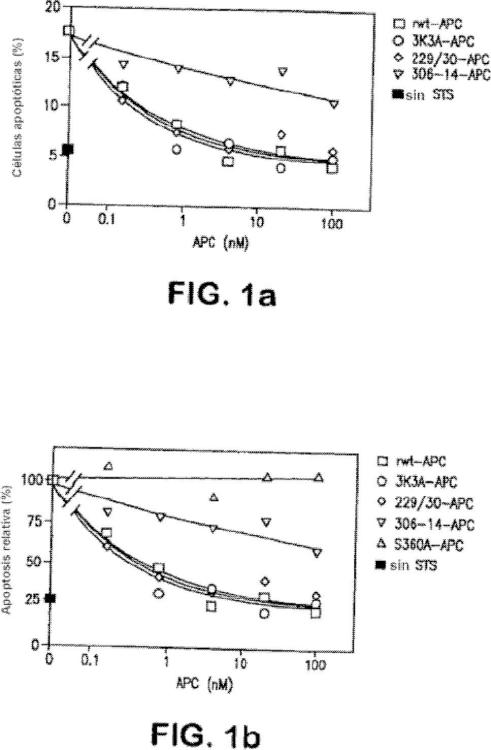
Fragmento de la descripción:
Variantes de proteína C activada con actividad citoprotectora pero con actividad anticoagulante reducida Esta invención se llevó a cabo con el soporte del gobierno de los Estados Unidos según el Contrato Nº HL52246 de los Institutos Nacionales de Salud. El gobierno de Estados Unidos tiene derechos sobre esta invención.
Campo de la invención La presente invención se refiere a variantes (mutantes) de proteína C y proteína C activada recombinante, una enzima que normalmente tiene actividades anti-trombótica, antiinflamatoria, y anti-apoptótica. Los mutantes de proteína C activada recombinante de la invención tienen una actividad anticoagulante marcadamente reducida, pero retienen una actividad anti-apoptótica (citoprotectora) casi normal, de forma que la relación de la actividad antiapoptótica a la actividad anticoagulante es mayor en las variantes que lo es en la proteína C activada de tipo natural o endógena. Esta invención se refiere también a métodos de uso de estas variantes. Las variantes de proteína C activada de la invención son útiles como inhibidores de la apoptosis o muerte celular y/o como factores de supervivencia celular, especialmente para las células o tejidos del sistema nervioso y de los vasos sanguíneos, que están estresados o lesionados. La invención se refiere además al uso terapéutico de las variantes de esta invención en sujetos con riesgo de daños celulares causados al menos en parte por la apoptosis, y a composiciones terapéuticas que comprenden dichas proteínas mutantes, cuyas composiciones proporcionarán los beneficios citoprotectores deseados a la vez que aportan un menor riesgo de hemorragia, un efecto secundario de la terapia con proteína C activada.
Antecedentes de la invención La proteína C es un miembro de la clase de los factores de coagulación serina-proteasas dependientes de la vitamina K. La proteína C fue originalmente identificada por sus actividades anticoagulante y profibrinolítica. La proteína C que circula en la sangre es un zimógeno inactivo que necesita la activación proteolítica para regular la coagulación sanguínea a través de un mecanismo complejo de retroalimentación natural. La proteína C humana se produce principalmente en el hígado como un único polipéptido de 461 aminoácidos. Esta molécula precursora se modifica después post-traducionalmente por (i) escisión de una secuencia señal de 42 aminoácidos, (ii) separación proteolítica desde el zimógeno de una cadena del residuo de lisina en la posición 155 y del residuo de arginina en la posición 156 para producir la forma de dos cadenas (esto es, cadena ligera de 155 residuos de aminoácidos unida por enlace disulfuro a la cadena pesada de 262 residuos de aminoácidos que contiene la serina proteasa) , (iii) carboxilación de los residuos de ácido glutámico agrupados en los 42 primeros aminoácidos de la cadena ligera dando como resultado nueve residuos de ácido gamma-carboxiglutámico (GIa) , y (iv) glucosilación en cuatro sitios (uno en la cadena ligera y tres en la cadena pesada) . La cadena pesada contiene la tríada de serina proteasas de Asp257, His211 y Ser360.
De modo similar a la mayor parte de otros zimógenos de proteasas extracelulares y a los factores de coagulación, la proteína C tiene una estructura central de la familia de quimiotripsinas, que tiene inserciones y una extensión de Nterminal que hacen posible la regulación del zimógeno y de la enzima. Son de interés dos dominios con secuencias de aminoácidos similares al factor de crecimiento epidérmico (EGF) . Se conoce al menos una porción de las secuencias de nucleótidos y aminoácidos de la proteína C del ser humano, mono, ratón, rata, hámster, conejo, perro, gato, cabra, cerdo, caballo, y vaca, así como las mutaciones y polimorfismos de la proteína C humana (véase GenBank acceso P04070) . Se conocen otras variantes de proteína C humana que afectan a diferentes actividades biológicas.
La activación de la proteína C está mediada por la trombina, que actúa en el sitio entre el residuo de arginina en la posición número 15 de la cadena pesada y el residuo de leucina en la posición 16 (numeración de quimiotripsina) (Véase Kisiel, J. Clin. Invest., 64:761-769, 1976; Marlar et al., Blood, 59:1067-1072, 1982; Fisher et al. Protein Science, 3:588-599, 1994) . Se ha demostrado también que otras proteínas incluyendo el Factor Xa (Haley et al., J. Biol. Chem., 264:16303-16310, 1989) , veneno de víbora de Russell, y tripsina (Esmon et al., J. Biol. Chem., 251:2770-2776, 1976) , escinden enzimáticamente y convierten la proteína C inactiva en su forma activada.
La trombina se une a la trombomodulina, un receptor de trombina unido a la membrana sobre la superficie luminal de las células endoteliales, bloqueando de este modo la actividad procoagulante de la trombina a través de su exositio I, y mejorando sus propiedades anticoagulantes, esto es, activando la proteína C. Como anticoagulante, la proteína C activada (APC, por sus siglas en inglés) , ayudada por su cofactor proteína S, escinde los cofactores activados factor Va y factor VIIIa, que son necesarios en la ruta de coagulación intrínseca para mantener la formación de trombina (Esmon et al., Biochim. Biophys. Acta., 1477:349-360, 2000a) , para obtener los cofactores inactivados factor Vi y factor VIIIi.
La activación de la proteína C mediada por el complejo trombina/trombomodulina se facilita cuando la proteína C se une al receptor de la proteína C endotelial (EPCR) , que localiza la proteína C en la superficie de la membrana de la célula endotelial. Cuando se forma complejo con el EPCR, se inhibe la actividad anticoagulante de la APC; la APC expresa su actividad anticoagulante cuando se disocia del EPCR, especialmente cuando se une a fosfolípidos cargados negativamente sobre las membranas activadas de plaquetas o de células endoteliales.
Los componentes de la ruta de la proteína C contribuyen no solamente a la actividad anticoagulante, sino también a las funciones anti-inflamatorias (Griffin et al., Sem. Hematology, 39:197-205, 2002) . Los efectos anti-inflamatorios de la trombomodulina, atribuidos recientemente a su dominio tipo lectina, pueden proteger a los ratones frente al daño de los tejidos mediado por los neutrófilos (Conway et al., J. Exp. Med. 196:565-577, 2002) . La proteína centrosomial murina CCD41 o centrociclina, implicada en la regulación del ciclo celular es idéntica al EPCR murino que carece de los primeros 31 aminoácidos del N-terminal (Rothbarth et al., FEBS Lett., 458:77-80, 1999; Fukodome and Esmon, J. Biol. Chem., 270:5571 -5577, 1995) . El EPCR es estructuralmente homólogo a la familia de proteínas CD1 de la clase 1 de MHC, la mayoría de las cuales están implicadas en los procesos inflamatorios. Esta homología sugiere que la función del EPCR puede no estar limitada a su capacidad para localizar la APC o la proteína C en la membrana endotelial (Oganesyan et al., J. Biol. Chem., 277:24851-24854, 2002) . La proteína C activada proporciona protección dependiente del EPCR frente a los efectos letales de la perfusión de E. coli en babuinos (Taylor et al., Blood, 95:1680-1686, 2000) y puede regular por reducción la producción de citocina proinflamatoria y alterar favorablemente la expresión del factor tisular o la presión sanguínea en diferentes modelos (Shu et al., FEBS Lett. 477:208-212, 2000; lsobe et al., Circulation, 104:1 171-1 175, 2001; Esmon, Ann. Med., 34:598-605, 2002) .
La inflamación es la reacción del cuerpo a la lesión y la infección. En la inflamación están implicados tres sucesos principales: (1) aumento del suministro de sangre al área dañada o infectada; (2) aumento de la permeabilidad capilar posibilitada por la retracción de las células endoteliales; y (3) migración de los leucocitos fuera de los capilares y hacia el tejido circundante (de aquí en adelante denominada infiltración celular) (Roitt et al., Immunology, Grower Medical Publishing, New York, 1989) .
Muchas enfermedades graves incluyen procesos inflamatorios subyacentes en los seres humanos. Por ejemplo, la esclerosis múltiple (MS) es una enfermedad inflamatoria del sistema nervioso central. En la esclerosis múltiple, los leucocitos circulantes infiltran el endotelio cerebral inflamado y dañan la mielina, dando como resultado trastornos en la conducción nerviosa y parálisis (Yednock et al., Nature 366:63-66 (1992) ) . El lupus eritematoso sistémico (SLE) es una enfermedad autoinmune caracterizada por la presencia de daño en los tejidos causado por anticuerpos propios dirigidos a los antígenos. Los auto-anticuerpos unidos a los antígenos en diversos órganos llevan al daño de los tejidos mediado por el complemento y por las células inflamatorias (Theofilopoulos, A. N., Encyclopedia... [Seguir leyendo]
Reivindicaciones:
1. Una variante de proteína C activada recombinante, que comprende la mutación RR229/230AA y KKK191193AAA.
2. Una variante de proteína C activada recombinante como se reivindica en la reivindicación 1, para uso en un método de tratamiento de un sujeto que sufre de una o más entre septicemia, lesión por isquemia/reperfusión, ictus, ictus isquémico, infarto de miocardio agudo, enfermedad neurodegenerativa aguda, enfermedad neurodegenerativa crónica, trasplante de órgano, quimioterapia, y lesión por radiación.
3. Una variante de proteína C activada recombinante para uso en un método de tratamiento de un sujeto como se reivindica en la reivindicación 2, en donde dicha enfermedad neurodegenerativa crónica es la enfermedad de Alzheimer, síndrome de Down, enfermedad de Huntington, esclerosis lateral amiotrófica, o enfermedad de Parkinson.
4. Una variante de proteína C activada recombinante para uso en un método de tratamiento de un sujeto como se reivindica en la reivindicación 2 o en la reivindicación 3, en donde dicho método comprende proteger a las células frente al daño causado al menos en parte por la apoptosis y las células están en uno o más tejidos entre cerebro, corazón, riñón, hígado, o tejidos epiteliales de un sujeto.
5. Una variante de proteína C activada recombinante como se reivindica en la reivindicación 1, para uso en un método terapéutico, en donde dicho método comprende administrar dicha variante a un sujeto en una dosis terapéutica entre 0, 01 mg/kg/h y 1, 1 mg/kg/h, mediante perfusión continua durante aproximadamente 4 horas a aproximadamente 96 horas.
6. Una composición terapéutica que comprende una cantidad eficaz de una variante de proteína C activada recombinante, en donde dicha variante incluye la mutación RR229/230AA y KKK191-193AAA.
7. Una composición como se reivindica en la reivindicación 6, en donde la composición está adaptada para administración al cerebro.
8. Una composición como se reivindica en la reivindicación 6 o en la reivindicación 7, en donde la composición comprende además un excipiente farmacéuticamente aceptable.
9. Una composición como se reivindica en la reivindicación 8, en donde la composición comprende además otros ingredientes conocidos para facilitar la administración y/o mejorar la absorción.
10. Una composición de al menos una variante de proteína C activada recombinante que comprende la mutación RR229/230AA y KKK191-193AAA, para uso en un método de tratamiento de un sujeto que sufre de hemoperfusión reducida, hipoxia, isquemia, ictus isquémico, radiación, oxidantes, lesión por reperfusión o traumatismo, comprendiendo dicho método el tratamiento del estrés o lesión celular en uno o más tipos de células del sujeto.
11. Un método in vitro para seleccionar las variantes citoprotectoras potencialmente terapéuticas de proteína C activada recombinante o proteína C recombinante, teniendo dicha proteína C activada o proteína C un dominio de proteasa, que comprende:
(a) mutar la proteína C activada recombinante en un bucle de superficie de dicho dominio de proteasa para producir una variante de proteína C activada; medir la actividad anticoagulante de dicha variante de proteína C activada; medir la actividad anti-apoptótica de dicha variante de proteína C activada; calcular la relación de la actividad antiapoptótica a la actividad anticoagulante; e identificar la variante de proteína C activada como potencialmente terapéutica si dicha relación es mayor que 1, 0; en donde la mutación es RR229/230AA y KKK191-193AAA;
o
(b) mutar la proteína C recombinante en un bucle de superficie de dicho dominio de proteasa para producir una variante de proteína C; convertir dicha variante de proteína C en una variante de proteína C activada; medir la actividad anticoagulante de dicha variante de proteína C activada; medir la actividad anti-apoptótica de dicha variante de proteína C activada; calcular la relación de la actividad anti-apoptótica a la actividad anticoagulante; e identificar la variante de proteína C activada como potencialmente terapéutica si dicha relación es mayor que 1, 0; en donde la mutación es RR229/230AA y KKK191-193AAA.
12. Un método in vitro para seleccionar las variantes citoprotectoras potencialmente terapéuticas de proteína C activada recombinante, que comprende:
(a) proporcionar un banco de agentes candidatos que son variantes de proteína C o variantes de proteína C activada, en donde dicha proteína C o proteína C activada tiene un dominio de proteasa, en donde dichas variantes comprenden al menos una mutación en un residuo en un bucle de superficie de dicho dominio de proteasa, y en donde dichas variantes de proteína C son capaces de ser convertidas en variantes de proteína C activada;
(b) convertir dichos agentes candidatos que son variantes de proteína C en variantes de proteína C activada;
(c) determinar la actividad anti-apoptótica de dichas variantes de proteína C activada de (a) o (b) en una o más células estresadas o lesionadas mediante la exposición de dichas células a una concentración de estaurosporina inductora de la apoptosis en presencia de una cantidad de un agente candidato;
(d) determinar la actividad anticoagulante de dichos agentes candidatos que se ensayan en (c) mediante la realización de un ensayo de coagulación de tiempo de protrombina diluida;
(e) calcular la relación de la actividad anti-apoptótica determinada en (c) con respecto a la actividad anticoagulante de (d) ; y (f) seleccionar los agentes candidatos que tienen una relación de actividad anti-apoptótica:anticoagulante mayor que 10 1, 0;
en donde dicha mutación es RR229/230AA y KKK191-193AAA.
13. Un agente seleccionado por un método como se reivindica en la reivindicación 11 o 12.
Patentes similares o relacionadas:
Composiciones para la supresión de la formación de inhibidores contra el factor VIII en pacientes con hemofilia A., del 22 de Julio de 2020, de THE TRUSTEES OF THE UNIVERSITY OF PENNSYLVANIA: Una composición que comprende material vegetal liofilizado que comprende al menos un fragmento de FVIII conjugado con la subunidad B de la toxina […]
Formulaciones liofilizadas para antídoto del factor Xa, del 1 de Julio de 2020, de PORTOLA PHARMACEUTICALS, INC.: Una formulación acuosa, que comprende de 10 mM a 55 mM de arginina, de 1% a 3% de sacarosa (p/v), de 2% a 8% de manitol (p/v), y al menos 5 mg/ml de un polipéptido […]
Trombina estabilizada, del 27 de Mayo de 2020, de OMRIX BIOPHARMACEUTICALS LTD.: Un método para estabilizar la actividad de la trombina en una solución, el método comprende: inhibir la actividad de la trombina poniendo en contacto la trombina con un oligonucleótido […]
Medicamento para tratamiento terapéutico y/o mejoría de la sepsis, del 8 de Abril de 2020, de ASAHI KASEI PHARMA CORPORATION: Un medicamento que comprende trombomodulina como un ingrediente activo para uso en el tratamiento terapéutico y/o mejoría de la sepsis, donde se ha de administrar […]
Uso terapéutico sinérgico de concentrados de complejo de protrombina con concentrados de FVIII, del 18 de Marzo de 2020, de CSL BEHRING GMBH: Composición que comprende factores de coagulación FII, FIX, FX y FVII aislados y una composición que comprende FVIII aislado y, opcionalmente, VWF aislado para […]
Métodos y composiciones para la condrogénesis in vitro e in vivo, del 18 de Diciembre de 2019, de Lineage Cell Therapeutics, Inc: Una composición que comprende una línea celular progenitora embrionaria clonal para su uso en un método in vivo de generación de cartílago, comprendiendo la composición: […]
Complejo del factor VIII con XTEN y proteína del factor de Von Willebrand y sus usos, del 27 de Noviembre de 2019, de Bioverativ Therapeutics Inc: Una proteína quimérica que comprende (i) un fragmento del factor de von Willebrand Factor (VWF) que comprende el dominio D' y el dominio D3 de VWF, (ii) […]
Direccionamiento de factores de coagulación al TLT-1 en plaquetas activadas, del 23 de Octubre de 2019, de NOVO NORDISK HEALTH CARE AG: Una proteína procoagulante que comprende (i) al menos un factor de coagulación, que es un polipéptido de FVII o un polipéptido de FIX, unido covalentemente […]