Vacunación con vectores poxvirales mediante alteración mecánica epidérmica.
Un poxvirus vivo, modificado, no replicante, que comprende un ácido nucleico que codifica un antígeno peptídico o polipeptídico que es exógeno al poxvirus,
en el que el poxvirus infecta células humanas, pero no se replica en ellas; para su uso en un procedimiento para suscitar una respuesta inmunitaria de linfocitos T de memoria en el antígeno exógeno, administrando el poxvirus a una epidermis mecánicamente alterada de un sujeto, de tal manera que el poxvirus que expresa el antígeno exógeno infecta la epidermis alterada y suscita una respuesta inmunitaria de linfocitos T de memoria.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2008/012345.
Solicitante: TremRx, Inc.
Inventor/es: KUPPER,THOMAS S, LIU,LUZHENG LISA.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K39/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53).
- A61K39/275 A61K […] › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Poxviridae, p. ej. avipoxvirus.
- A61P33/02 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 33/00 Agentes antiparasitarios. › Antiprotozoarios, p. ej. para la leishmaniasis, tricomoniasis, toxoplasmosis.
- A61P35/00 A61P […] › Agentes antineoplásicos.
- A61P37/00 A61P […] › Medicamentos para el tratamiento de problemas inmunológicos o alérgicos.
PDF original: ES-2547654_T3.pdf


Fragmento de la descripción:
Vacunación con vectores poxvirales mediante alteración mecánica epidérmica Investigación patrocinada por el gobierno La presente invención se realizó en parte con subvención gubernamental con los números de concesión U19 AI057330 y 5U54AI057159-05 del National Institute of Allergy and Infectious Diseases (NIAID) del National Institute of Health (NIH) . El gobierno de los Estados Unidos tiene determinados derechos relacionados con la presente invención.
Antecedentes de la invención Las vacunas están tradicionalmente constituidas por patógenos vivos, atenuados, organismos completos inactivados o toxinas inactivadas. En muchos casos estas estrategias han sido satisfactorias en la inducción de la inmunoprotección basada en respuestas mediadas por anticuerpos. Sin embargo, determinados patógenos, por ejemplo, el VIH, VHC, TB, la malaria y el cáncer requieren la inducción de inmunidad mediada por células (IMC) . Generalmente las vacunas no vivas han demostrado ser ineficaces en la producción de IMC. Además, aunque las vacunas vivas puedan inducir IMC, algunas vacunas vivas atenuadas pueden producir enfermedades en sujetos inmunosuprimidos.
Por lo tanto, hay una necesidad insatisfecha de vacunas que sean más eficaces y de medios para administrarlas que sean más eficaces que den como resultado una eficacia terapéutica y una respuesta inmunoprotectora potenciadas.
El documento WO 2004/058278 se refiere a un vector de poxviral recombinante, tal como un vector del virus de la vacuna, que comprende una secuencia de ácido nucleico que codifica la IL-15, una citocina que estimula la proliferación y diferenciación de linfocitos T in vitro y que puede aumentar las respuestas inmunitarias mediadas por linfocitos T in vivo.
Hodge y col (1999) Cancer Research 59; 5800-5807 describen la administración de un virus de vacuna recombinante que expresa el antígeno carcinoembrionario humano (ACE) con una, tres o ninguna molécula coestimuladora a ratones mediante la escarificación en la cola induciendo una respuesta de linfocitos T específica de ACE.
Sumario de la invención La invención se define en las reivindicaciones adjuntas.
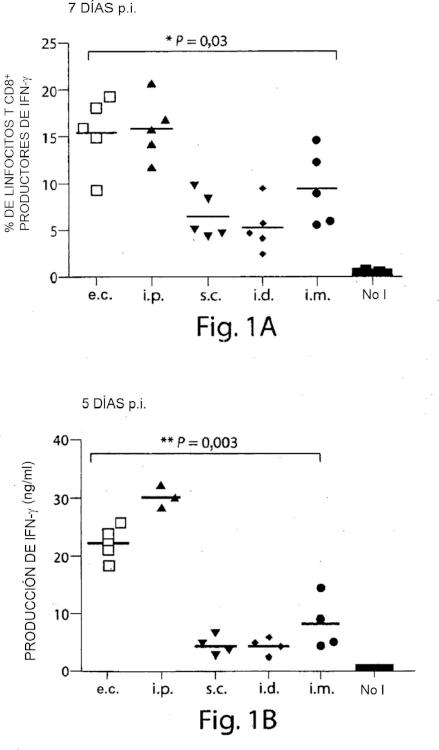
Los virus de vacunas atenuadas, con replicación deficiente, tales como la cepa Ankara del virus de la vacuna modificado (MVA) , se han propuesto previamente como vectores prometedores de vacunas virales vivas debido a su magnífico perfil de seguridad e inmunogenicidad y se han sometido a ensayos en estudios tanto clínicos como preclínicos. Sin embargo, vacunas virales, tales como MVA, se han administrado exclusivamente mediante vías de inyección, y hasta ahora, nunca mediante escarificación cutánea. Esto puede deberse a la suposición de que para el desarrollo de lesión por viruela y fuerte protección posterior contra la exposición antigénica se requiere replicación viral en la epidermis. Sin embargo, los inventores inmunizaron ratones con el MVA mediante escarificación cutánea y, para su sorpresa, la escarificación cutánea con MVA indujo lesiones características de viruela de una manera dependiente de la dosis y generó respuestas inmunitarias humorales y celulares dependientes de la dosis contra antígenos del virus de la vacuna (VV) . Sin pretender quedar ligado a ningún mecanismo o teoría particular, los inventores creen que para suscitar una fuerte respuesta inmunitaria a través de inmunización mediante escarificación cutánea no se requiere replicación viral.
La escarificación cutánea con MVA proporciona protección completa contra mortalidad y enfermedad en ratones expuestos a infección con el virus de la vacuna intranasal de la Reserva Occidental (WR-VV) a una dosis a la cual la inmunización VV replicativa mediante las vías de inyección convencionales fracasaban en la protección de ratones a la exposición letal. A una dosis comparable de inmunización con MVA, las vías de inyección convencionales solo suscitan respuestas de anticuerpos y de linfocitos T débilmente detectables, incluso después de exposición viral secundaria y ofrecen mala protección contra la exposición intranasal al WR-VV, mientras que se obtuvo una fuerte inmunoprotección mediante escarificación cutánea con cualquiera del MVA o VV. Por tanto, la inmunización epidérmica con vacunas virales vivas, tales como poxvirus con replicación deficiente, (por ejemplo, MVA) , usando alteración mecánica de la piel, genera una respuesta inmunitaria más fuerte y una protección más fuerte del huésped inmunizado a una dosis mucho menor en comparación con las vías de inyección actualmente usadas en la clínica, que requieren altas dosis y regímenes de inyección múltiples.
En el presente documento se desvela un nuevo procedimiento para la inmunización de un sujeto contra infecciones (o trastornos o enfermedades infecciosas) o cáncer, usando un vector poxviral modificado con replicación deficiente que contiene antígenos aplicado a la epidermis del sujeto mecánicamente alterada. Pueden usarse virus variantes de vacuna que se modifican para que tengan una replicación deficiente o menos infecciosa que se han modificado genéticamente para que contengan los ADNc que codifican el antígeno (o antígenos) .
También se desvela un procedimiento para estimular una respuesta inmunitaria. El procedimiento comprende administrar a un sujeto un poxvirus vivo, modificado, no replicante o con replicación deteriorada que comprende un antígeno en una cantidad suficiente para estimular la respuesta inmunitaria, en la que el poxvirus se administra a una epidermis del sujeto mecánicamente alterada. La respuesta inmunitaria puede ser una respuesta humoral y/o una respuesta celular. La respuesta celular puede suscitarse mediante linfocitos T CD4+ y/o CD8+ y/o linfocitos B.
Un aspecto de la invención proporciona un poxvirus vivo, modificado, no replicante que comprende un ácido nucleico que codifica un antígeno peptídico o polipeptídico que es exógeno al poxvirus, en el que el poxvirus infecta las células humanas pero no es replicante en las células humanas; para su uso en un procedimiento para suscitar una respuesta inmunitaria de linfocitos T de memoria contra el antígeno exógeno, administrando el poxvirus a una epidermis de un sujeto mecánicamente alterada de tal manera que el poxvirus que expresa el antígeno exógeno infecte la epidermis alterada y suscite una respuesta inmunitaria de linfocitos T de memoria.
El poxvirus puede ser orthopoxvirus, suipoxvirus, avipoxvirus, capripoxvirus, leporipoxvirus, parapoxvirus, moluscopoxvirus o yatapoxvirus. En algunas realizaciones, el poxvirus es TRICOM.
En algunas realizaciones, el orthopoxvirus es un virus de la vacuna. El virus de la vacuna puede ser la cepa Ankara del virus de la vacuna modificado (MVA) , la cepa WR, la cepa NYCBH, la cepa Wyeth, ACAM2000, la cepa Lister, LC16m8, Elstree-BNm, la cepa Copenhagen o la cepa Tiantan.
La epidermis puede alterarse mecánicamente mediante una aguja de escarificación, una aguja hipodérmica, o un dispositivo abrasivo. La epidermis puede alterarse mecánicamente esencialmente al mismo tiempo que la administración del poxvirus o antes de la administración del poxvirus.
En algunas realizaciones, el sujeto tiene o corre el riesgo de desarrollar cáncer. El cáncer puede ser cáncer de piel, de mama, de próstata, de cerebro, de pulmón, de ovario, de hígado, de páncreas, de estómago, de riñón, de vejiga y cáncer tiroideo o colorrectal. En algunas realizaciones, el cáncer es adenocarcinoma de próstata, neoplasia intraepitelial prostática, carcinoma pulmonar de células escamosas, adenocarcinoma pulmonar, carcinoma pulmonar microcítico, cáncer de ovario de origen epitelial, adenocarcinoma y leiomiosarcoma colorrectal, adenocarcinoma y leiomiosarcoma de estómago, carcinoma hepatocelular, colangiocarcinoma, adenocarcinoma ductal de páncreas, tumores pancreáticos endocrinos, carcinoma de células renales, carcinoma de células transicionales de riñón y vejiga, carcinoma de células escamosas de vejiga, cáncer tiroideo papilar, cáncer tiroideo folicular, astrocitoma o glioblastoma multiforme. El cáncer de piel puede ser melanoma, carcinoma de células escamosas cutáneas o carcinoma de células basales.
En algunas realizaciones, el sujeto tiene o corre el riesgo de desarrollar una infección. La infección puede ser una infección viral bacteriana, fúngica o protozoaria. Los ejemplos de infecciones virales incluyen, pero sin limitación, el VIH, el virus de la gripe, el virus del dengue, el virus de la Hepatitis A, el virus de la Hepatitis B, el virus de la Hepatitis C, el papilomavirus humano, el virus del Ebola, el virus de Marburg, el virus de la Rabia, el virus del Hanta, el virus del Nilo Occidental, los Coronavirus de tipo SARS (Síndrome... [Seguir leyendo]
Reivindicaciones:
1. Un poxvirus vivo, modificado, no replicante, que comprende un ácido nucleico que codifica un antígeno peptídico o polipeptídico que es exógeno al poxvirus, en el que el poxvirus infecta células humanas, pero no se replica en ellas; para su uso en un procedimiento para suscitar una respuesta inmunitaria de linfocitos T de memoria en el antígeno exógeno, administrando el poxvirus a una epidermis mecánicamente alterada de un sujeto, de tal manera que el poxvirus que expresa el antígeno exógeno infecta la epidermis alterada y suscita una respuesta inmunitaria de linfocitos T de memoria.
2. El poxvirus para su uso según la reivindicación 1, en el que el poxvirus se selecciona del grupo que consiste en: orthopoxvirus, suipoxvirus, capripoxvirus, leporipoxvirus, parapoxvirus, molluscipoxvirus y yatapoxvirus.
3. El poxvirus para su uso según la reivindicación 2, en el que el virus orthopoxvirus es un virus de la vacuna.
4. El poxvirus para su uso según la reivindicación 3, en el que el virus de la vacuna es el virus de la vacuna Ankara (MVA) modificado.
5. El poxvirus para su uso según la reivindicación 1, en el que la epidermis se altera mecánicamente mediante una aguja de escarificación, una aguja hipodérmica o un abrasivo.
6. El poxvirus para su uso según la reivindicación 1, en el que la epidermis se altera mecánicamente al mismo tiempo o antes de la administración del poxvirus.
7. El poxvirus para su uso según la reivindicación 1, en el que el sujeto tiene o corre el riesgo de desarrollar cáncer.
8. El poxvirus para su uso según la reivindicación 7, en el que el cáncer es cáncer de piel, de mama, de próstata, de pulmón, de cerebro, de ovario, de hígado, de páncreas, de estómago, de hígado, de vejiga y de tiroides o cáncer colorrectal.
9. El poxvirus para su uso según la reivindicación 7, en el que el cáncer se selecciona del grupo que consiste en melanoma, carcinoma de células escamosas cutáneas, carcinoma de células basales, carcinoma de células de Merkel, carcinoma adnexal, linfoma de linfocitos T o B cutáneos, sarcomas, adenocarcinoma, adenocarcinoma de próstata, neoplasia intraepitelial prostática, carcinoma pulmonar de células escamosas, adenocarcinoma pulmonar, carcinoma pulmonar microcítico, cáncer de ovario de origen epitelial, adenocarcinoma y leiomiosarcoma colorrectal, adenocarcinoma y leiomiosarcoma de estómago, carcinoma hepatocelular, colangiocarcinoma, adenocarcinomas ductales de páncreas, tumores pancreáticos endocrinos, carcinoma de células renales, carcinoma de células transicionales de riñón y vejiga y carcinoma de células escamosas de vejiga.
10. El poxvirus para su uso según la reivindicación 1, en el que el sujeto tiene o corre el riesgo de desarrollar una infección viral, bacteriana, fúngica o protozoaria.
11. El poxvirus para su uso según la reivindicación 10, en el que si la infección es una infección viral, la infección está causada por: el VIH, el virus de la gripe, el virus del dengue, el virus de la Hepatitis A, el virus de la Hepatitis B, el virus de la Hepatitis C, el papilomavirus humano, el virus del Ébola, el virus de Marburg, el virus de la Rabia, el infección por virus de Hanta, el virus del Nilo Occidental, los Coronavirus de tipo SARS, el virus del Herpes simple, virus de Varicela zóster, virus de Epstein-Barr, el herpesvirus Humano 8, los afavirus o la encefalitis de St. Louis; en el que si la infección es una infección bacteriana, la infección está causada por Mycobacterium tuberculosis, Salmonella typhi, Bacillus anthracis, Yersinia perstis, Francisella tularensis, Legionella, Chlamydia, Rickettsia typhi o Treponema pallidum; en el que si la infección es una infección fúngica, la infección está causada por Coccidioides immitis, Blastomyces dermatitidis, Cr y ptococcus neoformans, Candida albicans o especies de Aspergillus; en el que si la infección es una infección protozoaria, la infección está causada por Malaria (Plasmodium falciparum, Plasmodium vivax, Plasmodium ovale, Plasmodium malariae) , una especie de Leishmania, una especie de Tr y panosoma (africano y americana) , un cr y ptosporidium, una especie de Isospora, Naegleria fowleri, una especie de Acanthamoeba, Balamuthia mandrillaris, Toxoplasma gondii o Pneumocystis carinii.
12. El poxvirus para su uso según la reivindicación 1, en el que el antígeno es un antígeno asociado a tumor (AAT) , un antígeno específico de tumor (AET) o un antígeno específico de tejido.
13. El poxvirus para su uso según la reivindicación 1, en el que el antígeno es un antígeno viral, bacteriano, fúngico
o protozoario.
14. El poxvirus para su uso según la reivindicación 1, en el que una molécula coestimuladora, un factor de crecimiento, un adyuvante y/o una citocina se coadministra antes, al mismo tiempo o después del antígeno y en un mismo sitio o en un sitio diferente.
15. El poxvirus para su uso según la reivindicación 14, en el que la molécula coestimuladora o la citocina se coexpresa con el antígeno mediante el poxvirus.
16. El poxvirus para su uso según la reivindicación 14 o 15, en el que la molécula coestimuladora coexpresada se selecciona del grupo que consiste en: IL-1, IL-2, IL-7, IL-1 2, IL-15, IL-18, IL-23, IL-27, B7-2, B7-H3, CD40, CD40L, el ligando ICOS, OX-40L, 4-1BBL, GM-CSF, SCF, FGF, el ligando Flt3 y
17. El poxvirus para su uso según la reivindicación 14 o 15, en el que el poxvirus expresa B7-1, ICAM-1 y LFA-3.
18. Un kit que comprende un dispositivo para alterar mecánicamente el tejido epidérmico de un sujeto, tal como una aguja de escarificación o un abrasivo, y el poxvirus para su uso según una cualquiera de las reivindicaciones 1-17.
Patentes similares o relacionadas:
Eliminación de impurezas de cultivos celulares residuales, del 29 de Julio de 2020, de NOVARTIS AG: Un método para eliminar la Proteína Nuclear (NP) de la Gripe de una preparación que comprende proteínas del virus de la gripe de interés que incluyen hemaglutinina […]
 Cepas de Bordetella vivas atenuadas como vacuna de dosis única contra la tos ferina, del 29 de Julio de 2020, de INSTITUT PASTEUR DE LILLE: Una vacuna que comprende una cepa viva, atenuada y mutada de Bordetella pertussis que comprende al menos una mutación del gen (ptx) de la toxina […]
Cepas de Bordetella vivas atenuadas como vacuna de dosis única contra la tos ferina, del 29 de Julio de 2020, de INSTITUT PASTEUR DE LILLE: Una vacuna que comprende una cepa viva, atenuada y mutada de Bordetella pertussis que comprende al menos una mutación del gen (ptx) de la toxina […]
Inmunoterapia novedosa contra diversos tumores, entre ellos tumores cerebrales y neuronales, del 22 de Julio de 2020, de IMMATICS BIOTECHNOLOGIES GMBH: Péptido que comprende una secuencia de aminoácidos acorde con la SEQ ID N.º 19, en que dicho péptido tiene una longitud total de entre 9 y 16 aminoácidos.
Método para producir inmunoconjugados de anticuerpo-SN-38 con un enlazador CL2A, del 22 de Julio de 2020, de IMMUNOMEDICS, INC.: Un método para producir un compuesto, CL2A-SN-38, que presenta la estructura, **(Ver fórmula)** que comprende realizar un esquema de reacción como el que se muestra: **(Ver […]
Composición de vacuna que contiene un adyuvante sintético, del 22 de Julio de 2020, de INFECTIOUS DISEASE RESEARCH INSTITUTE: Una composición farmacéutica que comprende: un adyuvante lípido de glucopiranosilo (GLA), que tiene la fórmula: **(Ver fórmula)** en la que: […]
Arenavirus trisegmentados como vectores de vacunas, del 22 de Julio de 2020, de UNIVERSITE DE GENEVE: Una partícula de arenavirus trisegmentada infecciosa y competente para la replicación que comprende un segmento L y dos segmentos S, en donde uno de los dos segmentos […]
Composiciones para inducir la diferenciación de células supresoras derivadas mieloides para tratar el cáncer y las enfermedades infecciosas, del 15 de Julio de 2020, de OSE Immunotherapeutics: Un compuesto seleccionado del grupo que consiste en un anticuerpo y un fragmento de unión a antígeno del mismo que se une específicamente a la proteína […]
Polipéptidos biparatópicos antagonistas de la señalización WNT en células tumorales, del 15 de Julio de 2020, de Boehringer Ingelheim International GmbH & Co. KG: Un polipéptido que se une específicamente a LRP5 o LRP6, que comprende - un primer dominio variable individual de inmunoglobulina seleccionado del grupo de dominios […]