USO DEL VECTOR VIRUS POX CARENTE DE REPLICA PARA IMPULSAR LA RESPUESTA INMUNE DE CELULA T CD4+ AL ANTIGENO.
Uso de
(a) una primera composición que contiene una fuente de uno o más epítopos de célula T CD4+ de un antígeno de tuberculosis;
y
(b) una segunda composición que contiene una fuente de uno o más epítopos de célula T CD4+ del antígeno de tuberculosis, que incluye al menos un epítopo de célula T CD4+ que es el mismo que un epítopo de célula T CD4+ de la primera composición,
donde la fuente de epítopos de célula T en la primera composición no es un vector de virus pox,
donde la fuente de epítopos de CD4+ para la segunda composición es un vector de virus pox recombinante no replicante o con la réplica afectada;
para la fabricación de un medicamento que provoca una respuesta de célula T CD4+ del tipo TH1 contra el antígeno de tuberculosis, donde la primera y segunda composición se administran en cualquier orden
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB01/04116.
Solicitante: OXXON PHARMACCINES LIMITED.
Nacionalidad solicitante: Reino Unido.
Dirección: OXFORD BIOBUISNESS CENTER, LITTLEMORE PARK, LITTLEMORE,OXFORD, OX1 4SS.
Inventor/es: SCHNEIDER, JOERG, HILL,ADRIAN,V. S, MCSHANE,HELEN, GILBERT,SARAH, REECE,WILLIAM.
Fecha de Publicación: .
Fecha Concesión Europea: 28 de Abril de 2010.
Clasificación Internacional de Patentes:
- A61K39/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53).
- A61K39/015 A61K […] › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Antígenos de Hemosporidia, p. ej. antígenos de Plasmodium.
- A61K39/04 A61K 39/00 […] › Mycobacterium, p. ej. Mycobacterium tuberculosis.
Clasificación PCT:
- A61K39/00 A61K […] › Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53).
- A61K39/015 A61K 39/00 […] › Antígenos de Hemosporidia, p. ej. antígenos de Plasmodium.
- A61K39/04 A61K 39/00 […] › Mycobacterium, p. ej. Mycobacterium tuberculosis.
- A61P31/04 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 31/00 Antiinfecciosos, es decir antibióticos, antisépticos, quimioterápicos. › Agentes antibacterianos.
- A61P31/06 A61P 31/00 […] › para la tuberculosis.
- A61P31/12 A61P 31/00 […] › Antivirales.
- A61P33/06 A61P […] › A61P 33/00 Agentes antiparasitarios. › Contra la malaria.
Clasificación antigua:
- A61K39/12 A61K 39/00 […] › Antígenos virales.
Fragmento de la descripción:
Uso del vector virus pox carente de replica para impulsar la respuesta inmune de célula T CD4+ al antígeno.
La presente invención hace referencia a un método para inducir una respuesta de célula T CD4+ contra un antígeno objetivo usando una composición que contiene una fuente de epítopos de célula T CD4+.
Antecedentes
Aunque las vacunas con subunidades que provocan fuertes respuestas de anticuerpos llevan en el mercado varios años, ha resultado más difícil diseñar vacunas que estimulen el grupo celular del sistema inmune para producir fuertes respuestas protectoras de linfocito T.
Se ha prestado mucha atención a la producción de células T CD8+ que pueden ser citolíticas y han demostrado proteger contra algunas infecciones virales. A diferencia de ellas, las células T CD4+ han sido consideradas hasta hace poco como células T ayudantes que juegan un papel al ayudar a otros inmunecitos a generar protección, por ejemplo, amplificando las respuestas del anticuerpo.
Sin embargo, estudios recientes han demostrado que las células T CD4+ también pueden ser células efectoras que juegan un papel más directo en la protección. Por ejemplo, en el caso de la tuberculosis, malaria y la infección H. pylori, existen pruebas del papel protector de T CD4+ ya que segregan la citoquina, interferón gamma.
Existe por lo tanto la necesidad de desarrollar vacunas que sean capaces de estimular una respuesta efectiva de la célula T CD4+. Se sabe que los virus pox son buenos inductores de respuestas de célula T CD8 debido a su expresión intracitoplásmica. Sin embargo, se cree que son pobres a la hora de generar células T restringidas CD4 MHC clase II (ver por ejemplo, Haslett et al. Journal of Infectious Diseases 181:1264-72 (2000), página 1268).
Tuberculosis
Más de cien años después de que Koch descubriera el organismo causante, la tuberculosis continúa siendo un gran problema en la salud pública global. Se estima que hay 8-10 millones de nuevos casos por año y la mortalidad anual es de 3 millones aproximadamente. La variabilidad en la eficacia protectora de la vacuna actualmente disponible, Mybacterium bovis bacilo de Calmette-Guérin (BCG) [1], y la llegada de cepas resistentes a multifármacos de la tuberculosis indican que existe una necesidad urgente de una vacuna mejor.
M. tuberculosis es un patógeno intracelular y la respuesta inmune predominante implica el grupo celular del sistema inmune. Existen sólidas pruebas a partir de estudios con animales y humanos que demuestran que las células T CD4+ no son necesarias para el desarrollo de inmunidad protectora [2,3]. Existen también pruebas sobre el papel que pueden jugar las células T CD8+ [4,5].
Las vacunas de ADN provocan respuestas celulares inmunes, provocando tanto células T CD4+ como T CD8+, y por lo tanto representan un prometedor sistema de envío para una vacuna contra la tuberculosis. Una serie de estudios que examinan la eficacia protectora de vacunas de ADN codificadoras de una variedad de antígenos de M. tuberculosis han demostrado una protección parcial contra el rival que es equivalente a la protección conferida por BCG [6,7]. Sin embargo, ninguna de las vacunas candidatas testadas hasta el momento ha demostrado ser consistentemente superior a BCG. Aunque las vacunas de ADN son buenas al provocar células T CD4+ y T CD8+, puede que la frecuencia de células con respuesta que producen necesite ser significativamente superior con el fin de conferir protección contra el rival.
Por lo tanto, existe la necesidad de vacunas alternativas y mejoradas capaces de inducir una respuesta celular T CD4+, opcionalmente en conjunto con una respuesta celular T CD8+ para conseguir protección contra enfermedades tales como la tuberculosis.
WO 98/56919 describió un método para generar una respuesta inmune de células T CD4+ contra la malaria y otras enfermedades, administrando una composición de preparación que contenía epítopo de célula T CD8+ seguido de una composición de estimulación que contenía vector virus pox no replicante y afectado por la réplica que transportaba al menos un epítopo de célula T CD8+ que fue igual al epítopo de la composición de preparación.
Ramshaw & Ramsay (Immunology Today 21(4): 163-165 2000) describieron los regímenes "preparación-estimulación" para generar respuestas inmunes contra virus que incluían VIH y gripe, que consistían en una preparación con vacuna de ADN y una estimulación con un vector viral.
Jonson et al. (J. Virology 68(5): 3145-3153 1994) describieron la generación de respuestas inmunes de células T CD4+ y T CD8+ contra VIH usando una inmunización primaria con un virus en vacuna recombinante que expresaba gp160 y a continuación una inmunización impulsora con gp160 recombinante, y presentaron la identificación de epítopos CD8+ CTL a partir de regiones conservadas de gp120.
Resumen de la invención
La presente invención ha demostrado ahora que los virus pox defectuosos de réplica son capaces de provocar células T CD4+ efectivas que son protectoras. Usando ensayos ELISPOT para interferón-gamma con la reducción o disminución del subconjunto celular han probado que estas células efectivas T CD4+ se producen de manera adecuada tanteo en ratones como en humanos tras la inmunización. El uso de regímenes heterólogos preparación-estimulación con virus pox defectuosos de réplica produce sólidas respuestas de celulares de T CD4.
Por consiguiente, la presente invención proporciona el uso de:
donde la fuente de epítopos de célula T en la primera composición no es un vector virus pox,
donde la fuente de los epítopes CD4+ para la segunda composición es un vector virus pox recombínate no replicante o defectuoso en la réplica,
para la fabricación de un medicamento para inducir una respuesta celular T CD4+ del tipo TH1 contra un antígeno de tuberculosis, donde las dosis de la primera y la segunda composición pueden administrarse en cualquier orden.
Si el vector también proporciona una fuente de epítopos de células T CD8+ el método de la presente invención puede inducir una respuesta combinada de células T CD4+/CD8+.
Si la fuente de epítopos en (a) es un vector viral, el vector viral en (b) se deriva de un virus diferente.
La primera y segunda composición empleada en el método de la presente invención puede proporcionarse de manera conveniente en forma de un kit.
Además de los regímenes heterólogos preparación-estimulación, la presente invención ha demostrado que los virus pox defectuosos de réplica son capaces de actuar como agentes estimuladores para respuestas celulares T CD4+ pre-existentes. Por lo tanto, la presente invención también proporciona el uso de una fuente de uno o más epítopos de célula T CD4+de un antígeno de tuberculosis, donde la fuente es un vector virus pox recombinante no replicante o con la réplica afectada, en la fabricación de un medicamento para estimular una respuesta inmune celular T CD4+ del tipo TH1 preparada.
La capacidad de los vectores de pox virus recombinantes afectados en la réplica para inducir tales respuestas celulares funcionales T CD4+, tanto cuando se usan solos como en combinaciones preparación-estimulación, y tanto en animales como en el hombre, ha extendido la utilidad de vacunas profilácticas y terapéuticas.
Breve descripción de los dibujos
Figura 1: Un gráfico para mostrar la eficacia de varios regímenes de inmunización después de 8 semanas. Los datos representan el error medio y estándar de 7-15 ratones/grupo.
Figura 2: Un gráfico que muestra los resultados de un ensayo de liberación 51Cr realizado sobre los esplenocitos de ratones en el grupo DDDM
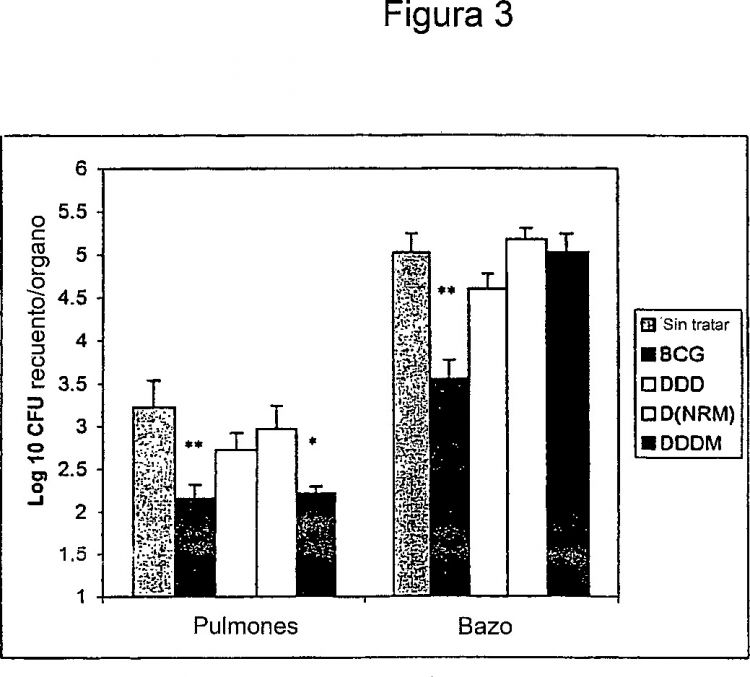
Figura 3: Un gráfico que compara la protección de los regímenes heterólogos y homólogos contra el rival. La media CFU cómputo/órgano se tomó a las 8 semanas. *, p < 0.05; **, p < 0.01 cuando se comparó con el grupo de control sin experiencia previa...
Reivindicaciones:
1. Uso de
donde la fuente de epítopos de célula T en la primera composición no es un vector de virus pox,
donde la fuente de epítopos de CD4+ para la segunda composición es un vector de virus pox recombinante no replicante o con la réplica afectada;
para la fabricación de un medicamento que provoca una respuesta de célula T CD4+ del tipo TH1 contra el antígeno de tuberculosis, donde la primera y segunda composición se administran en cualquier orden.
2. Uso de acuerdo con la reivindicación 1, donde el vector es el de la cepa de virus vaccinia Ankara modificado o un derivado del mismo.
3. Uso de acuerdo con la reivindicación 1, donde el vector es un vector de viruela aviar o un derivado del mismo.
4. Uso de acuerdo con cualquiera de las reivindicaciones precedentes, donde los epítopos en o codificados por la primera o segunda composición se proporcionan en una secuencia que no se da de manera natural como el producto expresado de un gen en M. tuberculosis.
5. Uso de acuerdo con cualquiera de las reivindicaciones precedentes, donde al menos una dosis de una composición es para administración a través de vía intradérmica.
6. Uso de acuerdo con cualquiera de las reivindicaciones precedentes, para administración de al menos una dosis de la primera composición seguida de al menos una dosis de la segunda composición.
7. Uso de acuerdo con la reivindicación 6, para administración de un conjunto de dosis secuenciales de la primera composición seguidas de al menos una dosis de la segunda composición.
8. Uso de acuerdo con la reivindicación 7, para administración de tres dosis secuenciales de la primera composición seguidas de al menos una dosis de la segunda composición.
9. Uso de una fuente de uno o más epítopos de célula T CD4+ de un antígeno de tuberculosis, donde la fuente de epítopos CD4+ es un vector de virus pox recombinante no replicante o con la réplica afectada, para la fabricación de un medicamento que estimule una respuesta preparada de célula T CD4+ del tipo TH1 contra el antígeno de tuberculosis.
10. Uso de acuerdo con cualquiera de las reivindicaciones 1 a 3 o 5 a 9, donde el antígeno de tuberculosis es ESAT6, MPT63 u 85A.
Patentes similares o relacionadas:
Eliminación de impurezas de cultivos celulares residuales, del 29 de Julio de 2020, de NOVARTIS AG: Un método para eliminar la Proteína Nuclear (NP) de la Gripe de una preparación que comprende proteínas del virus de la gripe de interés que incluyen hemaglutinina […]
 Cepas de Bordetella vivas atenuadas como vacuna de dosis única contra la tos ferina, del 29 de Julio de 2020, de INSTITUT PASTEUR DE LILLE: Una vacuna que comprende una cepa viva, atenuada y mutada de Bordetella pertussis que comprende al menos una mutación del gen (ptx) de la toxina […]
Cepas de Bordetella vivas atenuadas como vacuna de dosis única contra la tos ferina, del 29 de Julio de 2020, de INSTITUT PASTEUR DE LILLE: Una vacuna que comprende una cepa viva, atenuada y mutada de Bordetella pertussis que comprende al menos una mutación del gen (ptx) de la toxina […]
Arenavirus trisegmentados como vectores de vacunas, del 22 de Julio de 2020, de UNIVERSITE DE GENEVE: Una partícula de arenavirus trisegmentada infecciosa y competente para la replicación que comprende un segmento L y dos segmentos S, en donde uno de los dos segmentos […]
Inmunoterapia novedosa contra diversos tumores, entre ellos tumores cerebrales y neuronales, del 22 de Julio de 2020, de IMMATICS BIOTECHNOLOGIES GMBH: Péptido que comprende una secuencia de aminoácidos acorde con la SEQ ID N.º 19, en que dicho péptido tiene una longitud total de entre 9 y 16 aminoácidos.
Método para producir inmunoconjugados de anticuerpo-SN-38 con un enlazador CL2A, del 22 de Julio de 2020, de IMMUNOMEDICS, INC.: Un método para producir un compuesto, CL2A-SN-38, que presenta la estructura, **(Ver fórmula)** que comprende realizar un esquema de reacción como el que se muestra: **(Ver […]
Composición de vacuna que contiene un adyuvante sintético, del 22 de Julio de 2020, de INFECTIOUS DISEASE RESEARCH INSTITUTE: Una composición farmacéutica que comprende: un adyuvante lípido de glucopiranosilo (GLA), que tiene la fórmula: **(Ver fórmula)** en la que: […]
Formulaciones estables que contienen anticuerpos anti-PCSK9, del 15 de Julio de 2020, de AMGEN INC.: Una formulación estable que comprende un anticuerpo monoclonal que se une específicamente a PCSK9, en donde PCSK9 comprende los aminoácidos de la SEQ ID NO: […]
Métodos de tratamiento y prevención de infecciones por staphylococcus aureus y afecciones asociadas, del 15 de Julio de 2020, de NEW YORK UNIVERSITY: Una composición para uso en un método de inmunización de un sujeto contra la infección por S. aureus, comprendiendo dicha composición: (i) un fragmento de polipéptido […]