Uso terapéutico de anticuerpos anti-CS1.
Anticuerpo anti-CS1 o un fragmento de unión a antígeno anti-CS1 que es un antagonista de CS1 y que se une a una proteína codificada por SEC ID nº:
1, en el que dicho anticuerpo o fragmento de unión a antígeno:
a) comprende una región variable de cadena pesada con unas secuencias de región determinante de complementariedad (CDR) que presentan unas secuencias de aminoácidos que comparten una identidad de secuencia de 85% a 100% con las secuencias de aminoácidos representadas por SEC ID nº: 15, SEC ID nº: 16 y SEC ID nº: 17 como se representa en la tabla 4; y/o
b) comprende una región variable de cadena ligera con unas secuencias de CDR que presentan unas secuencias de aminoácidos que comparten una identidad de secuencia de 85% a 100% con las secuencias de aminoácidos representadas por SEC ID nº: 18, SEC ID nº: 19 y SEC ID nº: 20 como se representa en la tabla 4; en el que además dichos anticuerpo o fragmento de unión a antígeno compiten por la unión a dicha proteína con un anticuerpo de control, en el que el anticuerpo de control comprende una región VH que comprende SEC ID nº: 5 y una región VL que comprende SEC ID nº: 6.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E10183377.
Solicitante: AbbVie Biotherapeutics Inc.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 1500 SEAPORT BOULEVARD REDWOOD CITY, CA 94063 ESTADOS UNIDOS DE AMERICA.
Inventor/es: POWERS, DAVID, B., TSO,YUN,J, WILLIAMS,Marna, LANDOLFI,Nicolas,F, LIU,Gao.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K39/395 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- A61P35/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes antineoplásicos.
- A61P37/00 A61P […] › Medicamentos para el tratamiento de problemas inmunológicos o alérgicos.
- C07K14/705 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Receptores; Antígenos celulares de superficie; Determinantes celulares de superficie.
- C07K16/28 C07K […] › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra receptores, antígenos celulares de superficie o determinantes celulares de superficie.
- C12N5/20 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › siendo uno de los integrantes de la fusión un linfocito B.
PDF original: ES-2516840_T3.pdf
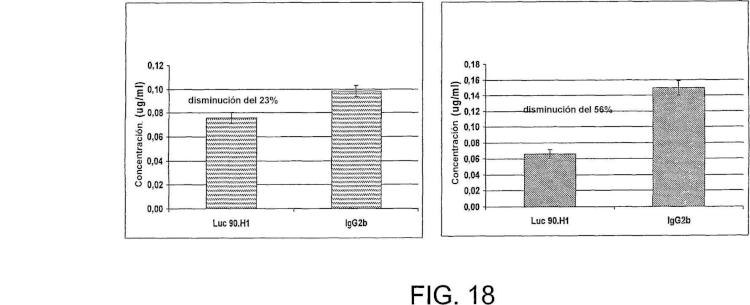
Fragmento de la descripción:
Uso terapéutico de anticuerpos anti-CS1.
Campo de la invención
La presente invención se refiere al campo de antagonistas y anticuerpos en el tratamiento de enfermedades, incluyendo enfermedades relacionadas con enfermedades autoinmunitarias y cáncer, y a métodos para detectar, identificar y modular estas enfermedades.
Antecedentes de la invención
La expresión incrementada de inmunoglobulina es una característica de muchas enfermedades. La secreción de inmunoglobulina en grandes cantidades provoca una variedad de trastornos, incluyendo síndrome de hiperviscosidad, un trastorno debilitante que da como resultado fatiga, cefaleas, disnea, confusión mental, dolor torácico, daño e insuficiencia renal, problemas de visión y fenómeno de Raynaud (mala circulación sanguínea, particularmente dedos de las manos, dedos de los pies, nariz y orejas). La enfermedad por crioaglutinina, y la crioglobulinemia mixta, la hipergammaglobulinemia, el síndrome de Sjogren, el liquen mixedematoso, y la enfermedad de Gaucher son ejemplos de enfermedades asociadas con la expresión incrementada de ¡nmunoglobulmas.
La expresión incrementada de inmunoglobulina dirigida a proteínas propias es un rasgo distintivo de las enfermedades autoinmunitarias. La enfermedad autoinmunitaria es un fallo del sistema ¡nmunitario para reconocer los autoantígenos como propios. En enfermedades autoinmunitarias, el sistema ¡nmunitario se ataca erróneamente a sí mismo, dirigiéndose contra células, tejidos y órganos, dando eventualmente como resultado la destrucción de sistemas fisiológicos. La autoinmunidad y las enfermedades autoinmunitarias tienen un origen multifactorial, estando implicados la predisposición genética, los factores del hospedante (por ejemplo debilidad de los controles inmunorreguladores, defectos en células T supresoras, o estimulación policlonal de células B resistentes a controles), los factores medioambientales y los mecanismos accionados por antígenos en el desarrollo de autoinmunidad y producción de autoanticuerpos para autoantígenos.
Los trastornos gastrointestinales y el lupus eritematoso sistémico (SLE) son dos ejemplos de enfermedades autoinmunitarias. La enfermedad inflamatoria del intestino (IBD), un subgrupo de trastornos gastrointestinales, es un grupo de trastornos Incurables que afecta a aproximadamente 4 millones de personas a nivel mundial. La etiología de la enfermedad Inflamatoria recurrente del intestino es actualmente desconocida. Las teorías incluyen una destrucción de células gastrointestinales, incluyendo linfocitos, mediada por el sistema autoinmunitario. Se ha demostrado previamente la agregación homotípica anormal en modelos de enfermedad inflamatoria heredable del Intestino, y se ha mostrado que las mutaciones en NOD2, un gen implicado en trastornos autoinmunitarios, predisponen a los pacientes a la enfermedad de Crohn. Ni, J. et al., Immunological abnormality in C3H/HeJ mice with heritable ¡nflammatory bowel disease, Cell Immunol. 169:7-15 (1996); Ogura, Y. et al., Aframeshift mutation in NOD2 assoclated with susceptibility to Crohns Disease, Nature 411: 603-606 (2001).
Las IBD afectan muy a menudo al intestino delgado y al colon, pero pueden implicar cualquier porción del tubo digestivo. Hay alrededor de 1 millón de personas diagnosticadas con IBD en los Estados Unidos sólo, diagnosticándose anualmente alrededor de 10.000 nuevos casos. Debido al efecto drástico en la calidad de vida de pacientes con IBD, se reclaman diez mil horas perdidas anualmente, que equivalen a mil millones de dólares en días de trabajo perdidos al año.
IBD produce un intervalo de síntomas gastrointestinales y extraintestinales, incluyendo diarrea, hemorragia rectal, dolor abdominal, pérdida de peso, trastornos de la piel y de los ojos, y crecimiento y maduración sexual retrasados en niños. Dos tipos de IBD son la colitis ulcerosa y la enfermedad de Crohn, que comparten síntomas y manifestaciones fisiológicas similares, pero difieren en la manera en que afectan al tubo digestivo. La colitis ulcerosa se caracteriza por inflamación ulcerosa de toda o parte de la mucosa colónica, muy frecuentemente incluyendo el recto. Sus síntomas incluyen hemorragia rectal y tenesmo rectal, tenesmo, y diarrea. La colitis ulcerosa está acompañada de complicaciones graves a corto y largo plazo. Las complicaciones más graves a corto plazo son colitis fulminante, megacolon tóxico, y perforación. Las complicaciones graves a largo plazo incluyen osteoporosis y cáncer colorrectal.
La enfermedad de Crohn es una inflamación transmural crónica, que puede afectar a cualquier parte del tubo digestivo, desde la boca hasta el ano. La enfermedad de Crohn es discontinua, con áreas no afectadas distribuidas a intervalos entre una o más áreas implicadas. Tarde en la enfermedad, la mucosa desarrolla un aspecto adoquinado, lo que resulta de ulceraciones longitudinales profundas entrelazadas con mucosa normal entremedia.
La mayoría de los pacientes con la enfermedad de Crohn presenta síntomas de dolor abdominal y dolor con la palpación, diarrea crónica o nocturna, hemorragia rectal, pérdida de peso, y fiebre. La enfermedad de Crohn evoluciona con el tiempo desde una enfermedad principalmente inflamatoria hasta uno de dos patrones clínicos:
compresivo (obstructivo) o penetrante (fistulizante). En la forma compresiva, la inflamación transmural produce proliferación fibromuscular en la pared intestinal, seguido de estrechamiento luminal. Los síntomas de la obstrucción se hacen más habituales a medida que progresa la CD. En la forma penetrante, se forman fístulas como túneles de Inflamación a través de la pared intestinal y rompen la superficie serosa, fistulizándose en tejidos contiguos e incluso a través de la piel.
La colitis ulcerosa y la enfermedad de Crohn se diagnostican generalmente usando criterios clínicos, endoscópicos, e histológicos. Sin embargo, hasta ahora las técnicas de diagnóstico tradicionales han establecido que ningún hallazgo Individual es absolutamente de diagnóstico para una enfermedad u otra. Además, aproximadamente 20% de los pacientes tienen un cuadro clínico que cae entre la enfermedad de Crohn y la colitis ulcerosa. Se afirma que estos pacientes que se ajustan a este perfil tienen colitis indeterminada.
Los síntomas de IBD pueden ¡mpactar enormemente en el bienestar del paciente, la calidad de vida, y la capacidad para vivir. Los períodos Inflamatorios son prolongados y frecuentes, y, dependiendo de la gravedad, discapacitantes. Debido a que la IBD es crónica y tiene típicamente un comienzo antes de los 30 años de edad, los pacientes requieren generalmente un tratamiento duradero. La elucidación del papel para nuevas proteínas y compuestos en estados mórbidos para la Identificación de dianas potenciales y marcadores de diagnóstico es valiosa para mejorar el tratamiento actual de pacientes con enfermedad Inflamatoria del intestino.
SLE se caracteriza por la producción de auto-anticuerpos frente a una variedad de moléculas ubicuas, lo que puede tener consecuencias patógenas, Incluyendo daño a numerosos órganos y tejidos, incluyendo piel, riñón, cerebro, y corazón. Los tratamientos aprobados actuales para SLE Implican inmunosupresión no específica y el control de los síntomas mediante esteroldes, fármacos ¡nmunosupresores, inmunomoduladores, y fármacos antimaláricos. Sin embargo, estos enfoques de tratamiento dan como resultado riesgos de toxicidad renal y mortalidad prematura. De este modo, es deseable desarrollar un nuevo enfoque que Interfiera específicamente con la activación de linfocitos y la producción de autoantlcuerpos.
Otras enfermedades autolnmunltarlas en las que la expresión Incrementada de inmunoglobulina y/o células B desempeña un papel significativo Incluyen trombocltopenla ¡dlopátlca, artritis reumática (RNA), anemia hemolítica autolnmunltarla, y mlastenla grave. Las pruebas del papel de las células B y/o de la inmunoglobulina incrementada proceden de estudios con pacientes tratados con esteroldes, agentes ¡nmunosupresores, y/o anticuerpos anti-CD20 (que seleccionan como dianas a células B). La mejora en los síntomas en estas enfermedades se correlaciona con una disminución en las células B y/o en la inmunoglobulina sérica, subrayando el papel central que las células B desempeñan en una variedad de enfermedades autoinmunitarias.
La expresión incrementada de inmunoglobulina también se puede observar en enfermedades cancerígenas. Al igual que los trastornos autoinmunitarios, la etiología del cáncer es de origen similarmente multifuncional. El cáncer, que es la segunda causa principal de muerte en los Estados Unidos de América, se ha relacionado con mutaciones en el ADN, que causan... [Seguir leyendo]
Reivindicaciones:
1. Anticuerpo anti-CS1 o un fragmento de unión a antígeno anti-CS1 que es un antagonista de CS1 y que se une a una proteína codificada por SEC ID n°: 1, en el que dicho anticuerpo o fragmento de unión a antígeno:
a) comprende una región variable de cadena pesada con unas secuencias de región determinante de complementariedad (CDR) que presentan unas secuencias de aminoácidos que comparten una identidad de secuencia de 85% a 100% con las secuencias de aminoácidos representadas por SEC ID n°: 15, SEC ID n°: 16 y SEC ID n°: 17 como se representa en la tabla 4; y/o
b) comprende una región variable de cadena ligera con unas secuencias de CDR que presentan unas secuencias de aminoácidos que comparten una identidad de secuencia de 85% a 100% con las secuencias de aminoácidos representadas por SEC ID n°: 18, SEC ID n°: 19 y SEC ID n°: 20 como se representa en la tabla 4;
en el que además dichos anticuerpo o fragmento de unión a antígeno compiten por la unión a dicha proteína con un anticuerpo de control, en el que el anticuerpo de control comprende una región VH que comprende SEC ID n°: 5 y una región VL que comprende SEC ID n°: 6.
2. Anticuerpo anti-CS1 monoclonal o fragmento de unión a antígeno anti-CS1 según la reivindicación 1, que disminuye en al menos 50% en un ensayo de unión competitiva la unión del anticuerpo de control a la proteína.
3. Anticuerpo anti-CS1 monoclonal o fragmento de unión a antígeno anti-CS1 según cualquiera de las
reivindicaciones 1 o 2, que comprende una región variable de cadena pesada con unas secuencias de CDR que presentan unas secuencias de aminoácidos representadas por SEC ID n°: 15, SEC ID n°: 16 y SEC ID n°: 17; y una región variable de cadena ligera con unas secuencias de CDR que presentan unas secuencias de aminoácidos representadas por SEC ID n°: 18, SEC ID n°: 19 y SEC ID n°: 20.
4. Anticuerpo anti-CS1 monoclonal o fragmento de unión a antígeno anti-CS1 según cualquiera de las
reivindicaciones 1 o 3, que presenta una cadena pesada que comprende la secuencia de aminoácidos representada por SEC ID n°: 5 y una cadena ligera que comprende la secuencia de aminoácidos representada por SEC ID n°: 6 como se representa en la tabla 4.
5. Anticuerpo anti-CS1 monoclonal o fragmento de unión a antígeno anti-CS1 según cualquiera de las
reivindicaciones 1 o 2, que comprende una región variable de cadena pesada con unas secuencias de CDR que presentan unas secuencias de aminoácidos representadas por SEC ID n°: 15, SEC ID n°: 95 (la secuencia de aminoácidos EINPDSSTINYAPSLKD), y SEC ID n°: 17; y una región variable de cadena ligera con unas secuencias de CDR que presentan unas secuencias de aminoácidos representadas por SEC ID n°: 18, SEC ID n°: 19 y SEC ID n°: 20
6. Anticuerpo anti-CS1 monoclonal o fragmento de unión a antígeno anti-CS1 según cualquiera de las
reivindicaciones 1, 2 o 5, que presenta una cadena pesada que comprende la secuencia de aminoácidos
representada por SEC ID n°: 47 y una cadena ligera que comprende la secuencia de aminoácidos representada por
SEC ID n°: 50 como se representa en las tablas 7 y 8.
7. Anticuerpo anti-CS1 monoclonal o fragmento de unión a antígeno anti-CS1 según cualquiera de las
reivindicaciones 1, 2 o 5, que está humanizado.
8. Anticuerpo anti-CS1 monoclonal o fragmento de unión a antígeno anti-CS1 según cualquiera de las
reivindicaciones anteriores, que es un lgG1.
9. Anticuerpo anti-CS1 o fragmento de unión a antígeno anti-CS1 según cualquiera de las reivindicaciones anteriores, para la utilización en el tratamiento del cáncer.
10. Anticuerpo anti-CS1 o fragmento de unión a antígeno anti-CS1 para la utilización según la reivindicación 9, en el que el cáncer es un mieloma o un mieloma múltiple.
11. Anticuerpo anti-CS1 o fragmento de unión a antígeno anti-CS1 que es un antagonista de CS1 y que se une a una proteína codificada por la SEC ID n° 1 para la utilización en el tratamiento del mieloma o el mieloma múltiple.
12. Anticuerpo anti-CS1 o fragmento de unión a antígeno anti-CS1 para la utilización según la reivindicación 11, en el que dicho anticuerpo o fragmento de unión a antígeno compite por la unión a dicha proteína con un anticuerpo de control, en el que además el anticuerpo de control comprende una región VH que comprende la SEC ID n°: 5 y una región VL que comprende la SEC ID n°: 6.
13. Anticuerpo anti-CS1 o fragmento de unión a antígeno anti-CS1 para la utilización según la reivindicación 11 o 12, en el que dicho anticuerpo anti-CS1 o fragmento de unión a antígeno anti-CS1 está humanizado y/o es un lgG1.
14. Anticuerpo anti-CS1 o fragmento de unión a antígeno anti-CS1 para la utilización según cualquiera de las 5 reivindicaciones 9 a 13 mediante la administración tras o en combinación con uno o más fármacos
inmunosupresores e inmunomoduladores.
15. Anticuerpo anti-CS1 o fragmento de unión a antígeno anti-CS1 para la utilización según cualquiera de las reivindicaciones 9 a 13 mediante la administración tras o en combinación con un inmunomodulador.
16. Anticuerpo anti-CS1 monoclonal o fragmento de unión a antígeno anti-CS1 según las reivindicaciones 1 a 8, o anticuerpo anti-CS1 o fragmento de unión a antígeno anti-CS1 para la utilización según las reivindicaciones 9 a 15, en el que dicho anticuerpo o fragmento de unión a antígeno se conjuga a un resto efector.
17. Anticuerpo anti-CS1 monoclonal o fragmento de unión a antígeno anti-CS1 según la reivindicación 16, o
anticuerpo anti-CS1 o fragmento de unión a antígeno anti-CS1 para la utilización según la reivindicación 16, en el que dicho resto efector es un marcador detectable tal como un marcador fluorescente, un radioisótopo o un producto químico citotóxico.
18. Anticuerpo anti-CS1 monoclonal o fragmento de unión a antígeno anti-CS1 según la reivindicación 16, o
anticuerpo anti-CS1 o fragmento de unión a antígeno anti-CS1 para la utilización según la reivindicación 16, en el que dicho resto efector es un resto de detección, un resto activable, un agente quimioterápico, una lipasa, un antibiótico, un agente quimiotáctico, un modulador inmunitario o un radioisótopo.
Patentes similares o relacionadas:
 Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Derivados de piperidina 1,4 sustituidos, del 29 de Julio de 2020, de 89Bio Ltd: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de […]
Profármacos de gemcitabina, del 29 de Julio de 2020, de NuCana plc: Una formulación farmacéutica que comprende gemcitabina-[fenil-benzoxi-L-alaninil)]-(S)-fosfato 3: **(Ver fórmula)** o una sal o solvato […]
Formas cristalinas de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, del 29 de Julio de 2020, de Hutchison Medipharma Limited: Forma I de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, en donde el difractograma de rayos X de polvo de la Forma […]
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Complejos de agentes terapéuticos de base vírica y poli(beta-amino-ésteres) modificados, del 29 de Julio de 2020, de Sagetis Biotech, SL: Un complejo de un agente terapéutico de base vírica con un polímero de fórmula I: **(Ver fórmula)** donde cada L1 y L2 están seleccionados […]
Compuestos de alquinilbenceno heterocíclicos, y composiciones médicas y usos de los mismos, del 29 de Julio de 2020, de Guangzhou Healthquest Pharma Co., Ltd: Un compuesto de alquinilbenceno heterocíclico que tiene la fórmula (I) y una sal farmacéuticamente aceptable, o estereoisómero del mismo, **(Ver […]
Régimen de terapia y métodos para sensibilizar células de cáncer tratadas con una terapia epigenética frente a inhibidores de PARP en múltiples cánceres, del 22 de Julio de 2020, de THE JOHNS HOPKINS UNIVERSITY: Una combinación que comprende un agente desmetilante del ADN y un inhibidor de poli ADP ribosa polimerasa (PARP) para su uso en el tratamiento del cáncer, en […]