Uso del 3-(2-isotiocianatoetil)-5-metoxi-1H-indol para el tratamiento de enfermedades neurodegenerativas.
Uso del 3-(2-isotiocianatoetil)-5-metoxi-1H-indol para el tratamiento de enfermedades neurodegenerativas.
La presente invención se refiere al uso del 3-(2-isotiocianatoetil)-5-metoxi-1H-indol o de una composición que comprende el 3-(2-isotiocianatoetil)-5-metoxi-1H-indol para el tratamiento de enfermedades que cursan con declive de la capacidad cognitiva o motoras secundarias a degeneración neuronal. La presente invención también se refiere al uso del 3-(2-isotiocianatoetil)-5-metoxi-1H-indol para el tratamiento de otras enfermedades neurodegenerativas que cursan con elevados niveles de estrés oxidativo y/o neuroinflamación y/o autoinmunes. Preferiblemente, la presente invención se refiere al uso del 3-(2-isotiocianatoetil)-5-metoxi-1H-indol para el tratamiento de la enfermedad de Alzheimer, la enfermedad de Parkinson, la enfermedad de Huntington, esclerosis múltiple, ictus cerebral o esclerosis lateral amiotrófica.
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P201300667.
Solicitante: FUNDACIÓN PARA LA INVESTIGACIÓN BIOMÉDICA DEL HOSPITAL UNIVERSITARIO DE LA PRINCESA.
Nacionalidad solicitante: España.
Inventor/es: LEON MARTINEZ,RAFAEL, EGEA MAIQUEZ,JAVIER, BUENDÍA ABAITUA,Izaskun, PARADA PÉREZ,Esther, NAVARRO GONZÁLEZ DE MESA,Elisa.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/404 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Indoles, p. ej. pindolol.
- A61P25/28 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 25/00 Medicamentos para el tratamiento de trastornos del sistema nervioso. › de los problemas neurodegenerativos del sistema nervioso central, p. ej. noótropos, activadores del conocimiento, medicamentos para el tratamiento del Alzheimer o de otras formas de demencia.
PDF original: ES-2526979_A1.pdf
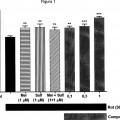
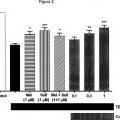
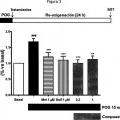
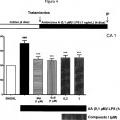
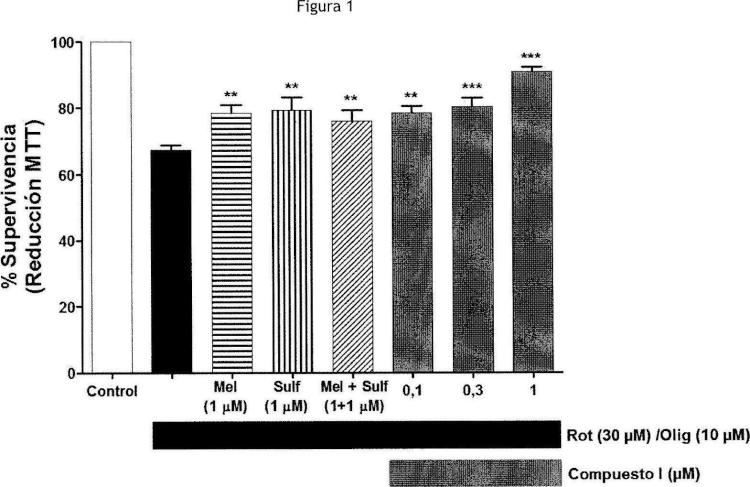
Fragmento de la descripción:
Uso del 3-(2-isotiocianatoetil)-5-metoxi-1H-indol para el tratamiento de enfermedades neurodegenerativas
Sector de la técnica
La invención se encuadra en el ámbito de la industria farmacéutica y, en concreto, en el uso del 3-(2-isotiocianatoetil)-5-metoxi-1H-indol en el tratamiento de aquellas enfermedades que cursan con un declive de la capacidad cognitiva o motora secundarias a degeneración neuronal, tal como la enfermedad de Alzheimer (EA), enfermedad de Parkinson (EP), esclerosis lateral amiotrófica (ELA) y enfermedad de Huntington (EH) o el ictus, así como la pérdida de neuronas secundaria a enfermedades autoinmunes como la esclerosis múltiple (EM).
Estado de la técnica
El envejecimiento es un riesgo inherente a las enfermedades neurodegenerativas. En estas patologías influyen factores como el incremento en la oxidación de proteínas y lípidos, así como la disminución de las defensas anti-oxidantes en las neuronas. En este contexto, la ruta Nrf2-ARE (Nuclear Factor Erythroid-2-Related Factor 2) se está utilizando como diana terapéutica para la prevención y el tratamiento de este tipo de patologías (de Vries y col., 2008, Free Radie. Biol. Med., 45: 1375-83, Johnson y col., 2008, Ann. N. Y. Acad. Sci., 1147: 61-9, van Muiswinkel y col., 2005, Curr. Drug Targets CNS Neurol. Disord., 4: 267-81).
El sistema nervioso central (SNC) es particularmente vulnerable a radicales libres debido a la gran acumulación de ácidos grasos poli- insaturados fácilmente oxidables por las especies reactivas de oxígeno. Además, existen cantidades significativas de iones metálicos como hierro (II) y cobre (I) que catalizan reacciones redox para producir dichos radicales libres, incrementándose así el estrés oxidativo. El alto consumo de oxígeno
del cerebro lleva a altos niveles de peroxidación lipídica, proteica, de ADN y ARN que causan una considerable disfunción y muerte neuronal.
Una vía por la cual las células regulan su capacidad antioxidante es a través de la activación del factor de transcripción Nrf2. El elemento de respuesta antioxidante (ARE) es un regulador que gobierna la expresión de enzimas detoxificantes de fase II. Así, el Nrf2 regula la activación de las secuencias ARE de forma que activa la expresión de genes de fase II por interacción con estas secuencias. En condiciones normales, el factor Nrf2 se encuentra secuestrado en el citosol por la proteína Keapl (Itoh y col., 1999, Genes Dev., 13: 76-86), que es ubiquitinado y degradado rápidamente por el sistema ubiquitina-proteosoma. En condiciones de estrés oxidativo, se interrumpe la interacción entre el factor Nrf2 y Keapl, de esta manera se facilita la translocación de Nrf2 al núcleo. En el núcleo, se une a proteínas Maf que incrementan la tasa de transcripción de los genes inducidos por las secuencias ARE.
Los múltiples genes relacionados con el equilibrio redox, el efecto anti-inflamatorio y la detoxificación de especies reactivas de oxígeno se inducen por la vía Nrf2-ARE. Estos genes tienen efecto citoprotector frente al daño celular por estrés oxidativo en diferentes tejidos y órganos, incluido el SNC. Los sistemas de enzimas antioxidantes regulados por Nrf2 incluyen la regulación rédox [superóxido dismutasa (SOD), catalasa (CAT), sulfaredoxin (Srx), tioredoxin (Trx), peroxiredoxin (Prdx)], síntesis y metabolismo de glutation [glutation peroxidasa (Gpx), glutation reductasa (GR), y-glutamina cisteína ligasa (GCL) y sintasa (GCS)], reciclado de quinonas [NAD(P)H quinona oxidoreductasa (NQ01)] y homeostasis del hierro [hemo-oxigenasa-1 (HO-1), ferritina]. Algunos genes antioxidantes tienen efectos más importantes que otros en el cerebro dependiendo de la enfermedad, el entorno celular o el subtipo celular. En condiciones normales, la expresión de genes dependientes de la ruta Nrf2-ARE está menos activada en las neuronas que en los astrocitos (Lee y col., 2003, J. Biol. Chem., 278: 12029- 38, Kraft y col., 2004, J. Neurosci., 24: 1101-12); por tanto, generalmente,
las neuronas dependen de los astrocitos para protegerse frente al estrés oxidativo (Tanaka y col., 1999, Glia, 28: 85-96).
Enfermedad de Alzheimer: La EA es una enfermedad neurodegenerativa progresiva asociada al envejecimiento, caracterizada por pérdida de memoria y disfunción cognitiva; es la demencia más común en el envejecimiento. La EA se caracteriza por la atrofia del cerebro debida a una marcada pérdida neuronal y de sinapsis, aparición de placas seniles formadas principalmente por el péptido amiloide-p (A|3) y ovillos neurofibrilares formados por agregados de proteína tau hiperfosforilada. La EA también se caracteriza por disfunción mitocondrial, gliosis reactiva y lesión oxidativa en lípidos y proteínas (Schipper y col., 2006, Neurobiol. Aging, 27: 252-61, Shaftel y col., 2008, J. Neuroinflammation, 5: 7, Smith y col., 1997, J. Neurosci., 17: 2653-7, Wáng y col., 2007, Free Radie. Biol. Med., 43: 1569-73).
En cerebros post-mortem de pacientes de EA se observa sobreexpresión de HO-1 en el córtex temporal e hipocampo, en comparación con sujetos control (Schipper y col., 2006, Neurobiol. Aging, 27: 252-61). Además, se encuentra una actividad anormalmente alta de la enzima NQ.01 en astrocitos y neuronas, lo que demuestra la presencia de un alto nivel de estrés oxidativo (Wang y col., 2000, Neurobiol. Aging, 21: 525-31, Raina y col., 1999, Redox Rep., 4: 23-7). Por otra parte, la localización del factor de transcripción Nrf2 es predominantemente citoplasmática en neuronas hipocampales de enfermos de EA (Raina y col., 1999, Redox Rep., 4: 23-7, Ramsey y col., 2007, J. Neuropathol. Exp. Neurol., 66: 75-85). Estudios recientes en modelos animales envejecidos de EA con la mutación APP/PS1 mostraron una reducción en los niveles del factor Nrf2, de NQ01 y de las enzimas sintetizadoras de GSH; estos hechos demuestran la existencia de una regulación negativa de este factor durante el transcurso de la enfermedad (Kanninen y col., 2008, Mol. Cell. Neurosci., 39: 302-13). También ha sido demostrado que la manipulación de las rutas antioxidantes
celulares endógenas se traduce en protección frente a la toxicidad neuronal inducida por Ap (Kanninen y col., 2008, Mol. Cell. Neurosa., 39: 302-13, Wruck y col., 2008, Mol. Pharmacol., 73: 1785-95). Estos y otros resultados in vitro e in vivo indican que la ruta Nrf2-ARE es una diana terapéutica con gran potencial para el tratamiento de la EA.
Enfermedad de Parkinson: Es una enfermedad neurodegenerativa caracterizada por síntomas motores como temblor, bradicinesia, inestabilidad postural y rigidez. También se observan síntomas psiquiátricos como cambios de humor, déficit cognitivo, alteraciones del comportamiento, y en algunos casos, demencia (Shtilbans y col., 2012, Curr. Opin. Neurol., 25: 460-5). El principal marcador patológico es la pérdida de neuronas dopaminérgicas en la substancia negra que proyectan al estriado, junto a la aparición de los cuerpos de Lewy por la acumulación de a-sinucleína unida a ubiquitina (Shtilbans y col., 2012, Curr. Opin. Neurol., 25: 460-5). También se observa una marcada astrogliosis así como microgliosis. En la EP también se ha demostrado la implicación del estrés oxidativo, una distribución predominantemente citoplasmática del factor Nrf2 y la disfunción mitocondrial en las neuronas dopaminérgicas (Alam y col., 1997, J. Neurochem., 69: 1196-203, Clements y col., 2006, Proc. Nati. Acad. Sci. U. S. A., 103: 15091-6). Existen diversos estudios in vitro e in vivo que demuestran que la inducción del factor Nrf2 ejerce efectos neuroprotectores frente a tóxicos que inducen parkinsonismo y en modelos transgénicos de la EP (Chen y col., 2009, Proc. Nati. Acad. Sci. U. S. A., 106: 2933-8, Innamorato y col., 2010, PLoS One, 5: e11838, Burton y col., 2006, Neurotoxicol., 27: 1094-100, Rojo y col., 2010, Clia, 58: 588-98, Lastres-Becker y col., 2012, Hum. Mol. Genet., 21: 3173-92).
Enfermedad de Huntington: se trata de una enfermedad neurodegenerativa progresiva autosómica dominante causada por la repetición expandida de tripletes de bases CAG en el gen de la proteína huntingtina. Esta repetición resulta en la expansión de poliglutaminas en el extremo N-terminal de la huntingtina y la acumulación de proteína muíante
en forma de agregados citosólicos y nucleares. La EH se caracteriza por la degeneración del neoestriado (caudado y putamen) y córtex cerebral relacionado con los problemas motores, declive cognitivo y síntomas psiquiátricos que empeoran con el avance de la enfermedad. Se ha implicado al estrés oxidativo y la disfunción mitocondrial en pacientes y modelos de EH. Prueba de ello son los defectos observados en los complejos mitocondriales II, III y IV en cerebros post-mortem de EH. Los estudios realizados... [Seguir leyendo]
Reivindicaciones:
1. El uso de un compuesto de fórmula (I), o sus sales farmacéuticamente aceptables para la preparación de medicamentos con efecto inductor de Nrf2 y/o antioxidante y/o neuroprotector y/o inmunomodulador para el tratamiento preventivo o terapéutico de las enfermedades neurodegenerativas centrales o periféricas.
2. El uso según la reivindicación 1 donde el compuesto de fórmula (I) y/o una sal farmacéuticamente aceptable, en la fabricación de un medicamento para el tratamiento de enfermedades neurodegenerativas centrales y/o periféricas.
3. El uso según reivindicaciones 1 a 2, en la fabricación de un medicamento para la enfermedad de Alzheimer.
4. El uso según reivindicaciones 1 a 2, en la fabricación de un medicamento para la enfermedad de Parkinson.
5. El uso según reivindicaciones 1 a 2, en la fabricación de un medicamento para la enfermedad de Huntington.
6. El uso según reivindicaciones 1 a 2, en la fabricación de un medicamento para la esclerosis múltiple.
7. El uso según reivindicaciones 1 a 2, en la fabricación de un medicamento para el ictus cerebral.
8. El uso según reivindicaciones 1 a 2, en la fabricación de un medicamento para el tratamiento de enfermedades periféricas neuropáticas.
9. El uso según reivindicación 8, en la fabricación de un medicamento para la esclerosis lateral amiotrófica.
10. El uso según reivindicaciones 1 a 9, en la fabricación de un medicamento para su administración por vía oral, rectal, subcutánea, intramuscular o intravascular.
11. El uso según reivindicaciones 1 a 9, en la fabricación de un medicamento con dosificaciones de 0,1 a 500 mg del compuesto de fórmula (I).
12. El uso según reivindicaciones 1 a 10, en la fabricación de un medicamento administrado a dosis comprendidas entre 0,1 mg/kg y 50 mg/kg.
Patentes similares o relacionadas:
Composiciones que comprenden una proteína de fusión de VIP-ELP para su uso en el tratamiento de fibrosis quística, del 29 de Julio de 2020, de Phasebio Pharmaceuticals, Inc: Una composición farmacéutica que comprende una proteína de fusión que comprende un péptido intestinal vasoactivo (VIP) y uno o más péptidos de tipo elastina (ELP), que […]
Análogos de indolina y usos de los mismos, del 8 de Julio de 2020, de Oncternal Therapeutics, Inc: Un compuesto que tiene la fórmula (I): **(Ver fórmula)** o un estereoisómero, una sal farmacéuticamente aceptable, o solvato del mismo, donde A se […]
Tratamiento de disfunción eréctil y otras indicaciones, del 1 de Julio de 2020, de STRATEGIC SCIENCE & TECHNOLOGIES, LLC: Una composición para su uso en un método de tratamiento de la disfunción sexual en un sujeto, preferiblemente un sujeto humano, comprendiendo la composición: […]
Forma de dosificación para su inserción en la boca, del 17 de Junio de 2020, de Nal Pharmaceutical Group Limited: Composición farmacéutica para aplicación a la mucosa oral que comprende: una matriz soluble en agua que comprende una cantidad eficaz de un agente farmacéuticamente […]
Compuestos heterocíclicos y métodos para su uso, del 8 de Abril de 2020, de NOVARTIS AG: Un compuesto de formula (I): **(Ver fórmula)** donde: X esta ausente e Y es -CHR3CH2-, -CH2CHR3-, -CHR3CHR4CH2-, -CH2CHR3CHR4-, -CH2CH2CHR3-, -CR3=CHCH2-, […]
Composiciones para el tratamiento del síndrome X frágil, del 8 de Abril de 2020, de CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE: Un abridor de un canal de potasio maxi-K para su uso en el tratamiento del síndrome X frágil, donde dicho abridor de canal de potasio […]
ACILHIDRAZONAS PARA EL TRATAMIENTO DE ENFERMEDADES NEUROLÓGICAS, del 2 de Abril de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC): La presente invención se refiere a un grupo de compuestos con un núcleo estructural de acilhidrazona que presentan capacidad moduladora de la interacción […]
Medicamentos para el tratamiento o la prevención de enfermedades fibróticas, del 25 de Marzo de 2020, de BOEHRINGER INGELHEIM INTERNATIONAL GMBH: 3-Z-[1-(4-(N-((4-metil-piperazin-1-il)-metilcarbonil)-N-metil-amino)-anilino)-1-fenil-metilen]-6-metoxicarbonil-2- indolinona, los tautómeros, los diastereómeros,…