Uso del factor de crecimiento de hígado (LGF) como regenerador de tejido nervioso.
Uso del factor de crecimiento de hígado (LGF) como regenerador detejido nervioso.
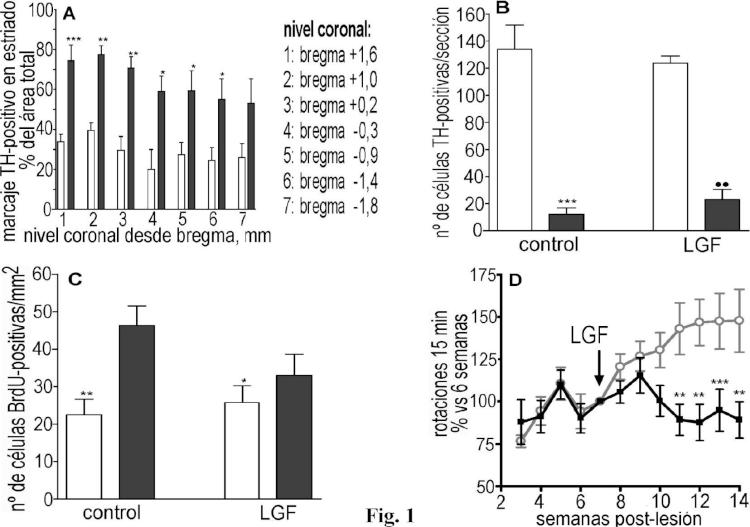
La invención consiste en proporcionar el uso del LGF en la fabricación de medicamentos útiles en la regeneracióntisular pleiotrópica de uno o más tejidos lesionados, en el queal menos uno de los tejidos lesionados forma parte del Sistema Nervioso Central y el medicamento está diseñado para ser administrado por vía sistémica. Se basa en el hecho de que la administración de LGF por vía intraperitoneal es capaz de promover un efecto positivo sobre un modelo de la enfermedad de Parkinson cuando se administra por vía intraperitoneal. Por ello, es una realización preferida de la invención aquélla en la que el medicamento se destina al tratamiento de la enfermedad de Parkinson, particularmentecuando el medicamento se destina a seres humanos.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/ES2009/070106.
Solicitante: Díaz Gil, Juan José.
Nacionalidad solicitante: España.
Inventor/es: DIAZ GIL, JUAN JOSE.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/18 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Factores de crecimiento; Reguladores de crecimiento.
- A61P9/10 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 9/00 Medicamentos para el tratamiento de trastornos en el aparato cardiovascular. › para enfermedades isquémicas o ateroscleróticas, p.ej. medicamentos antianginosos, vasodilatadores coronarios,medicamentos para el tratamiento del infarto de miocardio, de la retinopatía, de la insuficiencia cerebrovascular, de la arterioesclerosis renal.
PDF original: ES-2553426_T3.pdf
Patentes similares o relacionadas:
Neuregulina para tratar la insuficiencia cardíaca, del 29 de Julio de 2020, de Zensun (Shanghai) Science & Technology, Co., Ltd: Neuregulina para usar en un método para tratar la insuficiencia cardíaca crónica en un paciente, donde el paciente tiene un nivel plasmático de NT-proBNP […]
Dispositivo médico que tiene un revestimiento que comprende ACCS, del 15 de Julio de 2020, de Noveome Biotherapeutics, Inc: Un dispositivo médico implantable que tiene un revestimiento en su superficie, útil para la implantación quirúrgica en el cuerpo de un sujeto, […]
Composiciones que comprenden cócteles de fagos antibacterianos y usos de las mismas para el tratamiento de infecciones bacterianas, del 24 de Junio de 2020, de Tecnifar-Indústria Técnica Farmacêutica, S.A: Una composicion que comprende: una primera y una segunda cepa purificada de bacteriofago, cada una de dichas cepas que tiene un genoma que comprende […]
Formulaciones con oxidación reducida, del 3 de Junio de 2020, de F. HOFFMANN-LA ROCHE AG: Una formulación líquida que comprende un anticuerpo y un compuesto que previene la oxidación del anticuerpo en la formulación líquida, en la que el compuesto es […]
Trampas de GDF, del 3 de Junio de 2020, de ACCELERON PHARMA, INC: Un polipéptido aislado que comprende la secuencia de aminoácidos de SEQ ID NO: 28.
Combinacion de peptidos tolerogenos con TFG-â para inducir y mantener la tolerancia oral en mamiferos jovenes, del 3 de Junio de 2020, de SOCIETE DES PRODUITS NESTLE S.A.: Una composición nutricional - que contiene al menos un péptido de cinco hasta doce aminoácidos de longitud e incluye una secuencia elegida entre […]
Modulación de la actividad del factor de crecimiento epidérmico de unión a heparina para la curación de la membrana timpánica, del 6 de Mayo de 2020, de THE BOARD OF TRUSTEES OF THE LELAND STANFORD JUNIOR UNIVERSITY: Un agente que proporciona actividad de factor de crecimiento epidérmico de unión a heparina (HB-EGF) para su uso en el tratamiento de una perforación crónica de la membrana […]
Composiciones para lograr niveles plasmáticos deseados del factor 2 de crecimiento glial, del 6 de Mayo de 2020, de ACORDA THERAPEUTICS, INC: Factor de crecimiento glial 2 (GGF2) para su uso en la promocion de la remielinizacion celular en un paciente, donde el GGF2 se administra al paciente en una cantidad de […]