Uso de epotilona D en el tratamiento de enfermedades asociadas a Tau incluyendo enfermedad de Alzheimer.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2009/041634.
Solicitante: BRISTOL-MYERS SQUIBB COMPANY.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: ROUTE 206 AND PROVINCE LINE ROAD P.O. BOX 4000 PRINCETON, NJ 08543-4000 ESTADOS UNIDOS DE AMERICA.
Inventor/es: LEE,FRANCIS,Y, ALBRIGHT,CHARLES F, BARTEN,DONNA MARIE.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/427 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › no condensados y conteniendo otros heterociclos.
- A61P25/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Medicamentos para el tratamiento de trastornos del sistema nervioso.
- A61P25/16 A61P […] › A61P 25/00 Medicamentos para el tratamiento de trastornos del sistema nervioso. › Medicamentos contra el Parkinson.
- A61P25/28 A61P 25/00 […] › de los problemas neurodegenerativos del sistema nervioso central, p. ej. noótropos, activadores del conocimiento, medicamentos para el tratamiento del Alzheimer o de otras formas de demencia.
- A61P27/00 A61P […] › Medicamentos para tratar los trastornos de los sentidos.
PDF original: ES-2501565_T3.pdf
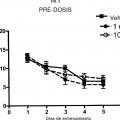

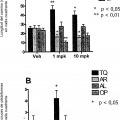
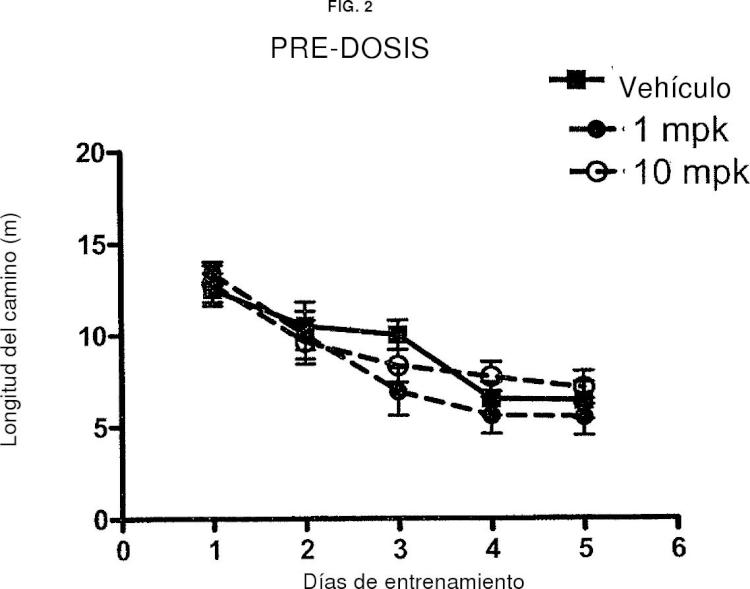
Fragmento de la descripción:
Uso de epotilona D en el tratamiento de enfermedades asociadas a Tau incluyendo enfermedad de Alzheimer Campo de la invención
La presente invención se refiere, en general, a epotilona D para su uso en el tratamiento de enfermedades asociadas a Tau y más específicamente, en el tratamiento de la enfermedad de Alzheimer.
Antecedentes de la invención
La enfermedad de Alzheimer (AD) es la forma más común de demencia, afectando según se estima a 27 millones de personas en todo el mundo en 26. La edad es el mayor factor de riesgo conocido para la AD con una incidencia del 25-5 % en personas de edad de 85 años o mayores. A medida que se incrementa la edad media de la población, se espera que el número de pacientes con AD aumente exponencialmente. La AD es la quinta causa principal de muerte en personas de 65 años de edad o mayores y la mayoría de los pacientes necesitan eventualmente cuidados asistenciales en el hogar. Por consiguiente, la AD tiene un impacto económico enorme, por ejemplo, los costes directos e indirectos estimados para 25 solamente en los Estados Unidos fueron de 148. millones de dólares. Además de los costes económicos, la AD tiene un impacto devastador sobre los pacientes y los miembros de sus familias, causando una grave angustia emocional y confusión.
Se diagnostica a los pacientes probable AD en base a la presencia de demencia con empeoramiento progresivo de la memoria y de otras funciones cognitivas y con la exclusión de otras causas de demencia. Un diagnóstico de AD solamente puede confirmarse post mortem ya que el diagnóstico clínico se basa en neuropatología del cerebro, específicamente, el diagnóstico requiere una evaluación del tejido cerebral, incluyendo la existencia y concentración de placas extracelulares en el cerebro, marañas intracelulares y neurodegeneración cerebral. La demencia es también una parte requerida del diagnóstico, dado que las placas y las marañas se observan también en adultos normales cognitlvamente, aunque usualmente en un menor grado.
Están actualmente aprobadas para la AD dos clases de medicamentos, inhibidores de colinesterasa y un antagonista de ácido N-metil-D-aspártico (NMDA). Aunque estas dos clases de productos terapéuticos muestran algún beneficio clínico, muchos pacientes no responden y estos fármacos solo mejoran los síntomas de la AD (por ejemplo, función cognitiva) con escasa o nula modificación de la progresión de la enfermedad. Por estas razones, la identificación de productos terapéuticos modificadores de esta devastadora enfermedad es un objetivo principal de la industria farmacéutica.
Los estabilizadores de microtúbulos se han sugerido como terapias para tratar tauopatías incluyendo AD. Véase, por ejemplo, Lee y col. (lista de referencias, infra). En la Patente de los Estados Unidos 5.58.898, presentada en mayo de 1994 y concedida el 3 de diciembre de 1996, a Trojanowski y col. se sugiere el uso de paclitaxel (TAXOL@) para tratar pacientes que sufren de AD mediante la estabilización de los microtúbulos. El paclitaxel ha probado ser altamente eficaz como agente estabilizador de microtúbulos en el tratamiento de pacientes de cáncer; sin embargo, presenta penetración cerebral y establece neuropatía periférica cuando se considera para AD (descrito adicionalmente más adelante) y no ha surgido como una terapia viable para tratar AD.
En 1995, se comunicó que epotilona B ejerce efectos estabilizadores de microtúbulos similares a paclitaxel (Bollag y col. 1995). La epotilona A y la epotilona B son compuestos que se dan en la naturaleza que se aislaron por Hofle y col. a partir de productos de fermentación del microorganismo Sorangium cellulosum (por ejemplo, documento WO 93/1121). Hofle y col. también descubrieron 37 variantes naturales de epotilona y compuestos relacionados producidos por S. cellulosum y cepas modificadas, incluyendo epotilonas C, D, E, F y otros isómeros y variantes (por ejemplo, Patente de los Estados Unidos N.2: 6.624.31).
Las características únicas de las epotilonas naturales generaron mucho interés en su exploración como fármacos anticancerígenos potenciales. Ahora, han pasado cerca de veinte años desde el primer descubrimiento de las epotilonas naturales A y B. Se han descubierto cientos de análogos de epotilona y se han descrito en diversas solicitudes de patente y se ha publicado bibliografía abundante con el título, epotilonas {Véase, por ejemplo, Altmann y col., lista de referencias, infra, en 396-423).
El cesionario de la presente solicitud ha desarrollado ixabepilona, un análogo semisintético de epotilona B, para el tratamiento de cáncer. La ixabepilona tiene la fórmula estructural:
El nombre químico para ixabepilona es (1S,3S,7S,1fí,11S,12S,16fí)-7,11-dihidroxi-8,8,1,12,16-pentametil-3-[(1E)- 1-metil-2-(2-metil-4-tiazolil)etenil]-17-oxa-4-azabiciclo[14.1.]heptadecano-5,9-diona. Véase también la Patente de los Estados Unidos N.2: 6.65.599, cedida al presente cesionario, Bristol-Myers Squibb Company (BMS). La 5 ixabepilona es un agente estabilizador de microtúbulos que se ha aprobado por la FDA para el tratamiento de cáncer de mama metastático y se comercializa por BMS con el nombre comercial IXEMPRA®. La ixabepilona se puede preparar como se describe las patentes de los Estados Unidos N.2S: 6.65.599 o US 7.172.884.
Se incluyen otras epotilonas naturales y análogos en ensayos clínicos avanzados para tratamiento de cáncer incluyendo epotilona B (papitulona de a/k/a, o EPO-96), en ensayos de Fase III por Novartis Pharma AG, para 1 tratamiento de cáncer ovárico; sagopilona (o ZK-EPO), un análogo sintético de benzotiazolil-7-propenilo de epotilona B, en ensayos de Fase II por Bayer Schering AG para tratamiento de diversos cánceres incluyendo tumores del ovario, mama, pulmón, próstata y melanoma. En 27, un ensayo de Fase II con sagopilona se inició en los Estados Unidos para tratamiento de metástasis cerebrales a partir de cáncer de mama. Adicionalmente, un análogo de epotilona D, KOS-1584, ha avanzado a ensayos clínicos de Fase II para tratamiento de cáncer por Kosan 15 Biosciences Inc. (ahora una filial subsidiaria de BMS) para el tratamiento de cáncer de pulmón de células no pequeñas y de tumores sólidos y epotilona D ha avanzado a ensayos clínicos de Fase II para tratamiento de cáncer por Kosan en colaboración con Hoffmann-La Roche, Inc.; sin embargo, los ensayos clínicos con epotilona D para tratar cáncer se interrumpieron en 27. La estructura para epotilona D se puede representar por la siguiente fórmula:
El compuesto epotilona B se reivindica, como composición del asunto que nos ocupa, en la Solicitud de Patente de los Estados Unidos de N.2 de Serie 91313.524 cedida a Hofle y col. y se describe en las Patentes de los Estados Unidos N.qS: 6.242.469 y 6.284.781 cedidas a Danishefsky y col., solicitud y patentes que fueron el sujeto de Interferencia N.2: 15.298, antes del Consejo de Apelaciones e Interferencias en materia de Patentes de la USPTO.
El cesionario de la presente solicitud también ha evaluado clínicamente BMS-3175 (Compuesto II en el presente documento), para terapia del cáncer. BMS-3175 se continuó a través de ensayos clínicos de Fase I para tratamiento de cáncer ovárico; es un análogo de amino-epotilona F y tiene la estructura química:
Se puede preparar el Compuesto II (BMS 3175) como se describe en la patente de Estados Unidos N.2: 3 6.262.94.
Aunque algunos de los compuestos de epotilona y análogos se han evaluado clínicamente para tratar cánceres, es altamente impredecible si un fármaco contra el cáncer se puede usar de forma eficaz para tratar enfermedades neurodegenerativas incluyendo la AD. Hay diversos factores que afectan a esto de forma impredecible. Un factor es la dificultad sustancial de lograr buena penetración cerebral debido a la barrera hematoencefálica (BHE). Para que un compuesto sea útil en el tratamiento de enfermedades cerebrales neurodegenerativas, es necesario que el compuesto cruce la BHE; sin embargo, dado que una función de la BHE es proteger el cerebro de sustancias y toxinas externas, resulta un desafío descubrir un fármaco útil que tenga buena penetración de la BHE. Además, la penetración de la BHE es una característica indeseable para un fármaco contra el cáncer (distinto de los fármacos contra el cáncer de cerebro). Con un fármaco contra el cáncer, se busca usualmente que se evite la penetración de la BHE, mientras que para un fármaco diseñado para tratar AD u otras enfermedades cerebrales neurodegenerativas, es necesaria buena penetración de la BHE para que el compuesto sea eficaz. Así, por ejemplo, mientras que paclitaxel es un fármaco contra el cáncer altamente exitoso, no ha surgido como una terapia útil para tratar enfermedades... [Seguir leyendo]
Reivindicaciones:
1. Uso de epotilona D en la preparación de un medicamento para el tratamiento de enfermedad de Alzheimer en un paciente humano que necesita tratamiento de la misma.
2. Uso de epotilona D en la preparación de un medicamento para el tratamiento de enfermedad asociada a Tau en un paciente humano que necesita tratamiento de la misma, en el que enfermedad asociada a Tau está seleccionada entre demencia frontotemporal con parkinsonismo ligado al cromosoma 17 (FTDP-17), parálisis supranuclear progresiva, degeneración corticobasal, enfermedad de Pick, enfermedad de los granos argirófilos, síndrome de Down, distrofia miotónica, enfermedad de Niemann-Pick C, demencia pugilística, enfermedad de Blint y daño cerebral traumático.
3. Uso de epotilona D de acuerdo con la reivindicación 1 o 2, en el que la epotilona D es administrada intravenosamente.
4. Uso de epotilona D de acuerdo con la reivindicación 3, en el que la dosis mensual acumulativa de epotilona D a administrar al paciente humano es de 3 mg/m2 o menos.
5. Uso de epotilona D de acuerdo con la reivindicación 4, en el que la dosis mensual acumulativa de epotilona D a administrar al paciente humano es de 6 mg/m2 o menos.
6. Uso de acuerdo con la reivindicación 3, en el que la dosis de epotilona D a administrar intravenosamente durante un ciclo de un mes, independientemente del calendario de administración, está en el intervalo de ,1 -5 mg/m2.
7. Uso de epotilona D de acuerdo con la reivindicación 6, en el que la dosis de epotilona D a administrar intravenosamente durante un ciclo de un mes, independientemente del calendario de administración, está en el intervalo de ,1-3 mg/m2.
8. Uso de la reivindicación 1 o la reivindicación 2, en el que la epotilona D es para ser administrada por vía oral.
9. Uso de epotilona D de acuerdo con la reivindicación 8, en el que la dosis de epotilona D a administrar por vía oral durante un ciclo de un mes, independientemente del calendario de administración, está en el intervalo de ,3 a 6 mg/m2.
1. Una formulación farmacéutica para la administración a un paciente humano para su uso en el tratamiento de enfermedad de Alzheimer, en el que dicha formulación comprende una monodosis de epotilona D de ,1-1
mg/m2.
11. Una formulación farmacéutica para la administración a un paciente humano para su uso en el tratamiento de una enfermedad asociada a Tau seleccionada de demencia frontotemporal con parkinsonismo ligado al cromosoma 17 (FTDP-17), parálisis supranuclear progresiva, degeneración corticobasal, enfermedad de Pick, enfermedad de los granos argirófilos, síndrome de Down, distrofia miotónica, enfermedad de Niemann-Pick C, demencia pugilística, enfermedad de Blint y daño cerebral traumático, en la que dicha formulación comprende una monodosis de epotilona D de ,1-1 mg/m2.
12. Epotilona D para su uso en el tratamiento de enfermedad de Alzheimer.
13. Epotilona D para su uso en el tratamiento de una enfermedad asociada a Tau seleccionada de demencia frontotemporal con parkinsonismo ligado al cromosoma 17 (FTDP-17), parálisis supranuclear progresiva, degeneración corticobasal, enfermedad de Pick, enfermedad de los granos argirófilos, síndrome de Down, distrofia miotónica, enfermedad de Niemann-Pick C, demencia pugilística, enfermedad de Blint y daño cerebral traumático.
Patentes similares o relacionadas:
Péptidos para inhibir la angiogénesis, del 15 de Julio de 2020, de The Board of Trustees of the University of Illionis: Un peptido aislado para su uso en la inhibicion de la angiogenesis en un paciente que lo necesita, en donde el peptido comprende la secuencia de aminoacidos de KFARLWTEIPTAIT […]
Síntesis de indazoles, del 13 de Mayo de 2020, de Bayer Pharma Aktiengesellschaft: Un procedimiento para la preparación de un compuesto de fórmula (I): **(Ver fórmula)** que comprende la siguiente etapa (A): en la que un compuesto de fórmula […]
Derivados de pirazol como inhibidores de la calicreína plasmática, del 13 de Mayo de 2020, de Kalvista Pharmaceuticals Limited: Un compuesto seleccionado del grupo que consiste de: **(Ver fórmula)** y sales y solvatos farmacéuticamente aceptables de los mismos.
Anticuerpos anti-CD40, del 29 de Abril de 2020, de BOEHRINGER INGELHEIM INTERNATIONAL GMBH: Un anticuerpo anti-CD40 humanizado que tiene una cadena pesada variable y una cadena ligera variable que comprende las secuencias de aminoácidos de SEQ ID NO: 53 y SEQ ID NO: […]
Derivados de 4-(p-quinonil)-2-hidroxibutanamida para el tratamiento de enfermedades mitocondriales, del 15 de Abril de 2020, de PTC THERAPEUTICS, INC. (100.0%): Un compuesto seleccionado entre el grupo que consiste en: • 2-5 hidroxi-2-metil-4-(2,4,5-trimetil-3,6-dioxociclohexa-1,4-dienil)butanamida y • su forma de […]
Uso de fenofibrato o un derivado del mismo para prevenir la retinopatía diabética, del 8 de Abril de 2020, de BGP Products Operations GmbH: Uso de fenofibrato, ácido fenofíbrico o una sal fisiológicamente aceptable de ácido fenofíbrico para la fabricación de un medicamento para la prevención de retinopatía, en […]
Mezcla de ácidos grasos (F.A.G., grupo de ácidos grasos) para su uso en el tratamiento de patologías inflamatorias, del 19 de Febrero de 2020, de Again Life Italia Srl: Composición farmacéutica, cosmética y/o dietética que comprende una mezcla de al menos cinco ácidos grasos seleccionados de ácido palmítico, ácido […]
Composiciones que comprenden mezclas de alcanos semifluorados, del 20 de Noviembre de 2019, de NOVALIQ GMBH: Una composición oftálmica que comprende: -un primer alcano semifluorado de la fórmula F(CF2)n(CH2)mH, en donde n es un número entero que oscila de 3 a 8 y m es un número entero […]