Terapia contra el cáncer con un parvovirus combinado con un inhibidor de HDAC.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2011/001328.
Solicitante: DEUTSCHES KREBSFORSCHUNGSZENTRUM.
Nacionalidad solicitante: Alemania.
Dirección: IM NEUENHEIMER FELD 280 69120 HEIDELBERG ALEMANIA.
Inventor/es: ROMMELAERE,JEAN, EL-ANDALOUSSI,NAZIM, MARCHINI,ANTONIO, HRISTOV,GEORGI, LI,JUNWEI.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/165 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › teniendo ciclos aromáticos, p. ej. colchicina, atenolol, progabide.
- A61K31/19 A61K 31/00 […] › Acidos carboxílicos, p. ej.ácido valproico (ácido salicílico A61K 31/60).
- A61K35/76 A61K […] › A61K 35/00 Preparaciones medicinales que contienen sustancias de constitución indeterminada o sus productos de reacción. › Virus; Partículas subvirales; Bacteriófagos.
- A61K45/06 A61K […] › A61K 45/00 Preparaciones medicinales que contienen ingredientes activos no previstos en los grupos A61K 31/00 - A61K 41/00. › Mezclas de ingredientes activos sin caracterización química, p. ej. compuestos antiflojísticos y para el corazón.
- A61P35/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes antineoplásicos.
PDF original: ES-2518116_T3.pdf




Fragmento de la descripción:
Terapia contra el cáncer con un parvovirus combinado con un inhibidor de HDAC
La presente invención se refiere a composiciones farmacéuticas que comprenden (a) un parvovirus y (b) un inhibidor de la histona-desacetilasa (HDACI, por sus siglas en inglés) y el uso de dicha composición para el tratamiento del carcinoma cervicouterino o carcinoma pancreático.
El carcinoma cervicouterino es la segunda neoplasia maligna más frecuente en mujeres a nivel mundial y es responsable de más 27 muertes y de 5 nuevos casos cada año. Ciertos tipos de virus de los papilomas humanos (HPV, por sus siglas en inglés), denominados tipos de alto riesgo (p. ej., los tipos 16 y 18), son los agentes causantes de la carcinogénesis cervicouterina. Dos oncogenes víricos de los HPV de alto riesgo, E6 y E7, son responsables de la conversión maligna de la célula y su expresión continua está asociada con la inactivación de las rutas de muerte celular que activan normalmente los agentes genotóxicos o ligandos solubles inductores de la muerte. El tratamiento convencional por radioterapia, quimioterapia y cirugía es a día de hoy en gran medida ineficaz contra los carcinomas asociados a HPV y se necesitan urgentemente nuevas estrategias terapéuticas. El reciente lanzamiento de vacunas profilácticas, a pesar de proporcionar la esperanza de conseguir una prevención eficaz de la infección mediante la vacunación, requerirá varias décadas antes de traducirse en un descenso de la incidencia del cáncer cervicouterino.
El adenocarcinoma ductal pancreático (PDAC, por sus siglas en inglés) es una de las neoplasias malignas gastrointestinales más letales. El PDAC es la cuarta causa más frecuente de mortalidad relacionada con el cáncer en Norteamérica, la sexta en Europa y la quinta en RU. La enfermedad es muy resistente a los tratamientos disponibles en la actualidad. La resección quirúrgica proporciona la mejor posibilidad de supervivencia a largo plazo, pero únicamente es practicable en una minoría de pacientes y no está exenta de riesgos. En la enfermedad avanzada, donde la cirugía no es una opción, la quimioterapia entra en juego, utilizando en concreto gemcitabina o 5-FU (5-fluorouracilo), aunque los efectos son todavía modestos y siempre acompañados por una toxicidad general elevada. La gemcitabina ha sido aprobada por la FDA como terapia de elección para los pacientes con cáncer pancreático localmente avanzado o metastásico. Este fármaco es un análogo de desoxicitidina dependiente del ciclo celular de la clase de antimetabolitos, que es transportado al interior de las células mediante transportadores de nucleósidos equilibrativos humanos (hENT, por sus siglas en inglés) y es fosforilado en su forma trifosfato activa por la desoxicitidina-cinasa (dCK, por sus siglas en inglés). Una preocupación importante en la terapia con gemcitabina reside en el desarrollo de resistencia hacia este agente quimioterapéutico. Esta resistencia puede deberse al importe/fosforilación reducidos del fármaco y/o a la salida potenciada desde la célula mediante los miembros de la familia de transportadores ABC MDR y MRP1/2, lo que conlleva un agotamiento de la reserva intracelular de gemcitabina activada. Se están explorando combinaciones de gemcitabina con otras pautas terapéuticas para mejorar el efecto anticanceroso erradicando las variantes resistentes o para permitir la reducción de las dosis quimioterapéuticas y de la toxicidad subsiguiente.
Varios miembros del grupo parvovirus de los roedores, incluido el parvovirus de rata H-1 PV y el virus diminuto de los ratones (MVM, por sus siglas en inglés), su homólogo en ratones, han atraído una gran atención por su potencial anticanceroso. Efectivamente, estos virus no son patógenos en humanos y poseen propiedades oncolíticas y oncosupresoras intrínsecas. Además, el hecho de que la población humana no se haya visto expuesta previamente a la infección por H-1 PV indica que el problema de una inmunidad antivírica preexistente, una razón común para la baja eficacia de los tratamientos basados en virus, no existe en el caso de H-1 PV. Por lo tanto, el sistema inmunitaño del paciente no elimina el virus inmediatamente tras la administración, lo que aumenta el tiempo de eficacia del tratamiento.
El genoma del parvovirus está constituido por una única hebra de ADN de aproximadamente 51 bases que contiene dos promotores, P4 y P38, que regulan la expresión de las proteínas no estructurales (NS1 y NS2) y de la cápside (VP1 y VP2) respectivamente. Los parvovirus de roedores han demostrado que activan varias rutas de muerte celular. En particular, dependiendo del tipo celular y de las condiciones de crecimiento, H-1 PV es capaz de inducir la apoptosis, necrosis o muerte celular dependiente de la catepsina B.
La replicación y oncolisis de los parvovirus están estimuladas por cambios celulares asociados con la transformación neoplásica. Se podría mostrar que H-1 PV presenta de manera natural actividad antineoplásica contra líneas celulares derivadas de carcinomas cervicouterinos humanos tanto en cultivos celulares como en modelos en animales. Estos resultados subrayan el potencial terapéutico de H-1 PV contra los carcinomas. Sin embargo, debería señalarse también que los parvovirus fallan, en algunos casos, en erradicar el tumor completamente o en detener su crecimiento. A menudo se desarrollan células resistentes, lo que lleva a la posibilidad de recidiva del tumor. Además, aunque el virus se replica preferentemente en células tumorales, también es capaz de entrar en células normales, lo que reduce la cantidad de virus adecuada para el tratamiento. Por lo tanto, supondría una gran ventaja el reforzar su actividad oncolítica y el encontrar otros agentes que pudieran actuar de manera concertada con los parvovirus en la destrucción de las células cancerosas.
En resumen, desafortunadamente, los virus oncolíticos estudiados en seres humanos cuando se utilizan en los protocolos de monoterapia han mostrado un éxito limitado en la inducción por si solos de la erradicación completa y permanente del tumor. Una fracción de las células tumorales escapa al tratamiento vírico lo que incrementa el riesgo de una recidiva del tumor. El hecho de que se hayan aislado parvovirus de los tumores en crecimiento indica que estos virus solos no son siempre lo suficientemente potentes para detener el crecimiento o provocar la regresión completa de las lesiones neoplásicas. Por lo tanto, es sumamente deseable encontrar fármacos que puedan actuar con el virus para destruir eficazmente las células cancerosas sin efectos secundarios dañinos adicionales. Estos agentes podrían mejorar el resultado del tratamiento al (i) destruir por otros medios las células resistentes a parvovirus, (ii) convertir las células cancerosas en más susceptibles a la citotoxicidad de parvovirus, para permitir de esta manera la reducción de la dosis vírica necesaria para lograr la eficacia y/o (iii) hacer posible que los fármacos se utilicen en concentraciones más bajas, mejorando de esta manera su seguridad.
El documento WO 27/7165 divulga una terapia combinada que conlleva un virus tóxico selectivo para el tumor y uno o más agentes terapéuticos que reducen la formación de vasos sanguíneos tumorales o dañan el sistema vascular tumoral, para utilizar en el tratamiento de las neoplasias (remítase a la página 1, líneas 2-6). El virus selectivo para el tumor puede ser un parvovirus (remítase a la página 8, líneas 2-26) y el agente terapéutico puede ser un inhibidor de la histona-desacetilasa (remítase a la página 14, línea 9-página 15, línea 14 y las reivindicaciones 3, 6 y 7). Entre las neoplasias que se van a tratar se divulga el cáncer de páncreas (remítase a la página 6, líneas 19-24).
Por lo tanto, es el objeto de la presente invención proporcionar medios para una terapia a base de parvovirus mejorada.
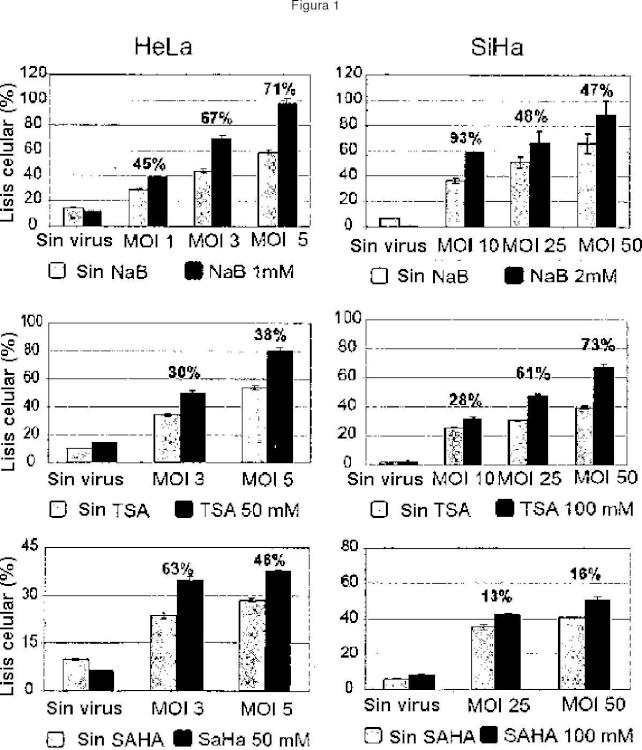
De acuerdo con la invención, esto se logra mediante la materia definida en las reivindicaciones. La presente invención se basa en los hallazgos del solicitante de que mediante el tratamiento combinado con un parvovirus y un inhibidor de la histona-desacetilasa (HDACI) se puede mejorar de manera sinérgica la eficacia terapéutica. Los HDACI son un grupo estructuralmente heterogéneo de moléculas. Se observó que dosis subletales de HDACI, concretamente butirato de sodio (NaB), tricostatina A (TSA), ácido valproico (VPA) y el ácido suberoilanilida hidroxámico (SAHA) potencian la actividad antineoplásica de los parvovirus de manera sinérgica en distintos tipos de cáncer, p. ej., células HeLa (que contienen ADN de HPV-18), CaSki y SiHa (que contienen ADN de HPV-16) derivadas de carcinoma cervicouterino y células de carcinoma cervicouterino primario así como en líneas celulares... [Seguir leyendo]
Reivindicaciones:
1. Composición farmacéutica que contiene (a) un parvovirus H-1 (H-1 PV) y (b) un inhibidor de la histona- desacetilasa (HDACI) para su uso en un método para tratar el carcinoma cervicouterino o carcinoma pancreático.
2. La composición farmacéutica para su uso de acuerdo con la reivindicación 1, que contiene (a) un parvovirus H-1
(H-1 PV) y (b) un HDCAI como entidades separadas.
3. La composición farmacéutica para su uso de acuerdo con la reivindicación 1 o 2, donde dicho HDACI es butirato de sodio (NaB), tricostatina A (TSA), ácido valproico (VPA) o ácido suberoilanilida hidroxámico (SAHA).
4. La composición farmacéutica para su uso de acuerdo con cualquiera de las reivindicaciones 1-3, donde (a) el parvovirus H-1 (H-1 PV) y (b) el HDACI se administran secuencialmente.
5. La composición farmacéutica para su uso de acuerdo con la reivindicación 4, donde el parvovirus H-1 (H-1 PV) (a)
se administra antes del HDACI (b).
6. La composición farmacéutica para su uso de acuerdo con cualquiera de las reivindicaciones 1-5, donde dicho parvovirus H-1 (H-1 PV) se administra mediante administración intratumoral.
7. El uso de un parvovirus H-1 (H-1 PV) y un inhibidor de la histona-desacetilasa (HDACI) para la preparación de 15 una o más composiciones para el tratamiento del carcinoma cervicouterino o carcinoma pancreático.
Patentes similares o relacionadas:
 Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Derivados de piperidina 1,4 sustituidos, del 29 de Julio de 2020, de 89Bio Ltd: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de […]
Profármacos de gemcitabina, del 29 de Julio de 2020, de NuCana plc: Una formulación farmacéutica que comprende gemcitabina-[fenil-benzoxi-L-alaninil)]-(S)-fosfato 3: **(Ver fórmula)** o una sal o solvato […]
Formas cristalinas de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, del 29 de Julio de 2020, de Hutchison Medipharma Limited: Forma I de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, en donde el difractograma de rayos X de polvo de la Forma […]
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Complejos de agentes terapéuticos de base vírica y poli(beta-amino-ésteres) modificados, del 29 de Julio de 2020, de Sagetis Biotech, SL: Un complejo de un agente terapéutico de base vírica con un polímero de fórmula I: **(Ver fórmula)** donde cada L1 y L2 están seleccionados […]
Compuestos de alquinilbenceno heterocíclicos, y composiciones médicas y usos de los mismos, del 29 de Julio de 2020, de Guangzhou Healthquest Pharma Co., Ltd: Un compuesto de alquinilbenceno heterocíclico que tiene la fórmula (I) y una sal farmacéuticamente aceptable, o estereoisómero del mismo, **(Ver […]
Régimen de terapia y métodos para sensibilizar células de cáncer tratadas con una terapia epigenética frente a inhibidores de PARP en múltiples cánceres, del 22 de Julio de 2020, de THE JOHNS HOPKINS UNIVERSITY: Una combinación que comprende un agente desmetilante del ADN y un inhibidor de poli ADP ribosa polimerasa (PARP) para su uso en el tratamiento del cáncer, en […]