Terapia de combinación y método de evaluación de la resistencia a un tratamiento.
Un método para la determinación de la resistencia de un sujeto a un tratamiento contra un trastorno proliferativo con el compuesto 2,
2-dimetil-N-((S)-6-oxo-6,7-dihidro-5H-dibenzo[b,d]azepin-7-il)-N'-(2,2,3,3,3-pentafluoro-propil)- malonamida (Compuesto I), que comprende medir el nivel de un biomarcador presente en una muestra biológica obtenida de dicho sujeto, siendo dicho biomarcador IL-6 o IL-8.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2011/057909.
Solicitante: F. HOFFMANN-LA ROCHE AG.
Inventor/es: HE,Wei, BOYLAN,JOHN FREDERICK.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00).
- G01N33/574 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › para el cáncer.
PDF original: ES-2488628_T3.pdf




Fragmento de la descripción:
Terapia de combinación y método de evaluación de la resistencia a un tratamiento
La presente invención se refiere a un método y a un kit para la determinación de la resistencia de un sujeto a un tratamiento con 2,2-dimetil-A/-((S)-6-oxo-6,7-dihidro-5/-/-dibenzo[b,d]azepin-7-il)-A/'-(2,2,3,3,3-pentafluoro-propil)-
malonamida. La invención también se refiere a una terapia de combinación para el tratamiento de un paciente que padece un trastorno proliferativo, que comprende la administración de 2,2-dimet¡l-A/-((S)-6-oxo-6,7-dihidro-5H- d¡benzo[b,d]azep¡n-7-il)-A/,-(2,2,3,3,3-pentafluoro-propil)-malonam¡da y al menos uno de entre un agente anti-IL-6 y un agente anti-IL-8.
Antecedentes de la invención
La proteína Notch es una proteína transmembrana presente en la mayoría de los organismos, incluyendo los mamíferos, que tiene un papel en la regulación de la expresión génica. Tras la unión de un ligando al dominio extracelular de Notch, la proteína Notch es escindida justo fuera de la membrana por la enzima conversora del factor de necrosis tumoral a (TACE), liberando el dominio extracelular que permanece en interacción con el ligando. A continuación, la secretasa y escinde la proteína justo dentro de la membrana, liberando el dominio intracelular (conocido como Notch intracelular activa o "ICN"). La ICN se transloca al núcleo de la célula y activa el factor de transcripción CSL, induciendo de este modo la transcripción génica.
La señalización de Notch defectuosa se ha implicado en diversos trastornos, incluyendo trastornos proliferativos. Como tal, la inhibición de la señalización de Notch es un campo de gran interés en oncología. La inhibición de la secretasa y bloquea la vía de señalización de Notch y, como tales, los inhibidores de la secretasa y tienen actividad antiproliferativa.
La2 ,2-d¡met¡l-A/-((S)-6-oxo-6,7-d¡h¡dro-5H-dibenzo[b,d]azepin-7-il)-A/-(2,2,3,3,3-pentafluoro-propil)-malonamida (también denominada en el presente documento "Compuesto I") es un inhibidor potente y selectivo de la secretasa y que inhibe la señalización de Notch en las células tumorales. Se sabe que los xenoinjertos tratados con el Compuesto I muestran una reducción en la expresión de los genes asociados con la angiogénesis que coincide con la capacidad del Compuesto I para inhibir la angiogénesis tumoral. Luistro et al., Cáncer Research, 69:7672-8 (29). Curiosamente, estos estudios mostraron poco cambio en el perfil de genes angiogénicos para el xenoinjerto H46a.
La interleucina-6 (IL-6) y la interleucina-8 (IL-8) son potentes citocinas que desempeñan un papel importante en diversos trastornos tales como la infección y la inmunidad, la inflamación, las enfermedades autoinmunes y el cáncer. Los solicitantes han encontrado que la expresión elevada tanto de IL-6 como de IL-8 confiere resistencia al tratamiento con el Compuesto I.
Sumario de la invención
La presente invención se refiere a un método para la determinación de la resistencia de un sujeto a un tratamiento contra una enfermedad proliferativa con 2,2-dimetil-A/-((S)-6-oxo-6,7-dihidro-5H-dibenzo[b,d]azepin-7-il)-A/'- (2,2,3,3,3-pentafluoro-propil)-malonamida, que comprende la medición del nivel de un biomarcador presente en una muestra biológica obtenida de dicho sujeto, siendo dicho biomarcador IL-6 o IL-8.
La presente invención se refiere además a un método de tratamiento de un paciente que padece un trastorno proliferativo, que comprende la administración al paciente de: (A) Compuesto I; y (B) un agente anti-IL-6 o anti-IL-8.
La presente invención se refiere además a una combinación secuencial o simultánea de (A) Compuesto I; y (B) un agente anti-IL-6 y/o anti-IL-8 para su uso como un medicamento, en particular como medicamento para su uso en el tratamiento de un trastorno proliferativo tal como el cáncer, especialmente tumores sólidos, más particularmente tumores de mama, colorrectal, de pulmón y de próstata.
Un aspecto adicional de la presente invención es un kit que comprende: (A) Compuesto I; y (B) un agente anti-IL-6 o anti-IL-8.
En otro aspecto adicional más, la presente invención se refiere al uso de una combinación de (A) Compuesto I; y (B) un agente anti-IL-6 y/o anti-IL-8 para la fabricación de un medicamento para el tratamiento de un trastorno proliferativo, en particular, de cáncer, más particularmente, de tumores sólidos tales como tumores de mama, colorrectal, de pulmón y de próstata.
El agente anti-IL-6 o anti-IL-8 es un ARN antisentido, ARNhc, ARNip o anticuerpo de IL-6 o IL-8.
Breve descripción de las figuras
La Figura 1 representa los resultados de un ensayo de matriz de citocinas realizado en líneas celulares NCI- H46a y A549.
La Figura 2 representa la cantidad de IL-6 e IL-8 secretada medida procedente de diversas líneas celulares usando ELISA.
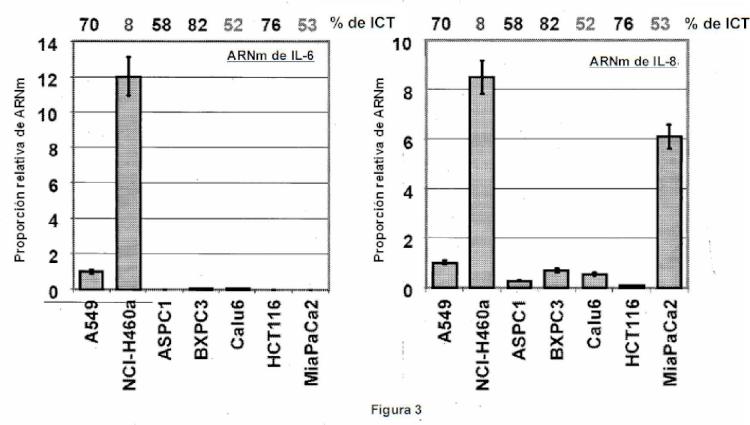
La Figura 3 representa la cantidad de ARNm que codifica IL-6 e IL-8 medida de diversas líneas celulares usando qRT-PCR.
La Figura 4 representa la cantidad de IL-6 e IL-8 secretada medida de células H46a, células A549 parentales, células A549 de control, células A549 que sobreexpresan IL-6 y células A549 que sobreexpresan IL-8 usando ELISA.
La Figura 5 representa el efecto del tratamiento con el Compuesto I y el efecto del tratamiento con Taxol® sobre el crecimiento tumoral en modelos de xenoinjerto que reciben: células H46a, células A549 parentales, células A549 de control, células A549 que sobreexpresan IL-6, células A549 que sobreexpresan IL-8 y una mezcla 1:1 de células A549 que sobreexpresan IL-6 y células A549 que sobreexpresan IL-8.
La Figura 6 representa la cantidad de ARNm que codifica IL-8 y la cantidad de IL-8 secretada medida de células H46a parentales, células H46a que reciben un vector de control y células H46a con la expresión de IL-8 anulada.
La Figura 7 representa el efecto sobre el crecimiento tumoral del tratamiento con Compuesto I medido en modelos de xenoinjerto de H46a y H46a con la expresión de IL-8 anulada.
La Figura 8 representa el efecto sobre el crecimiento tumoral en modelos de xenoinjerto de H46a del tratamiento con el Compuesto I, el tratamiento con anticuerpo anti-IL-8 y la terapia de combinación con el Compuesto I y el anticuerpo anti-IL-8.
La Figura 9 representa el efecto sobre el crecimiento tumoral en modelos de xenoinjerto de H46a del tratamiento con el Compuesto I, el tratamiento con anticuerpo anti-IL-6 y la terapia de combinación con el Compuesto I y el anticuerpo anti-IL-6.
La Figura 1 representa los niveles de ARNm que codifica IL-6 e IL-8 en diversas líneas celulares medidos usando qRT-PCR.
La Figura 11 representa los niveles de IL-6 e IL-8 secretados por diversas líneas celulares medidos usando
ELISA.
La Figura 12 representa la regulación negativa de ARNm de Hesl en células U87MG y LOX tras el tratamiento
con el Compuesto I.
La Figura 13 representa el efecto del tratamiento con Compuesto I sobre el crecimiento tumoral en células U87MG y LOX.
La Figura 14 representa la cantidad de IL-6 e IL-8 secretada medida usando ELISA en células H46a, células H46a tratadas con el Compuesto I, células FI46a con la expresión de IL-8 anulada, células H46a con la expresión de IL-8 anulada tratadas con el Compuesto I, células U87MG y células U87MG tratadas con el Compuesto I.
Descripción detallada de la invención Definiciones
A menos que se indique lo contrario, los siguientes términos y expresiones usados en la presente solicitud, incluyendo la memoria descriptiva y las reivindicaciones, tienen las definiciones que figuran a continuación. Cabe señalar que, como se usan en la memoria descriptiva y en las reivindicaciones adjuntas, las formas en singular "un", uno, "una", "el" y ella incluyen los referentes en plural, a menos que el contexto indique claramente lo contrario.
Como se usa en el presente documento, "Compuesto I" se refiere a 2,2-dimetil-A/-((S)-6-oxo-6,7-dihidro-5H- dibenzo[b,d]azepin-7-il)-A/'-(2,2,3,3,3-pentafluoro-propil)-malonamida que es útil como inhibidor de la secretasa y. El Compuesto I tiene la siguiente estructura:
El Compuesto I se administra en una cantidad que es terapéuticamente eficaz para el tratamiento de un trastorno p rol iterativo. Dicha cantidad puede ser, por ejemplo, de aproximadamente 4 ng.h/ml a aproximadamente 9. ng.h/ml, de aproximadamente 1.1 ng.h/ml a aproximadamente 4.1 ng.h/ml, o de aproximadamente 1.38 ng.h/ml a aproximadamente 2.33 ng.h/ml. Preferentemente, el Compuesto I se puede administrar en una cantidad de aproximadamente 4 ng.h/ml a aproximadamente 9. ng.h/ml administrada en un período de hasta aproximadamente 21 días, de aproximadamente 1.1 ng.h/ml... [Seguir leyendo]
Reivindicaciones:
1. Un método para la determinación de la resistencia de un sujeto a un tratamiento contra un trastorno proliferativo con el compuesto 2,2-dimetil-A/-((S)-6-oxo-6,7-dihidro-5H-dibenzo[b,d]azepin-7-il)-A/,-(2,2,3,3,3-pentafluoro-propil)- malonamida (Compuesto I), que comprende medir el nivel de un biomarcador presente en una muestra biológica obtenida de dicho sujeto, siendo dicho biomarcador IL-6 o IL-8.
2. Un método de acuerdo con la reivindicación 1, en el que dicho sujeto es un mamífero.
3. Un método de acuerdo con la reivindicación 1, en el que dicho sujeto es un ser humano.
4. Un método de acuerdo con la reivindicación 1, en el que dicho biomarcador es IL-6.
5. Un método de acuerdo con la reivindicación 1, en el que dicho biomarcador es IL-8.
6. Un método de acuerdo con la reivindicación 1, en el que se miden los niveles tanto de IL-6 como de IL-8.
7. Un método de acuerdo con la reivindicación 1, en el que dicha muestra biológica es sangre.
8. Un método de acuerdo con la reivindicación 1, en el que dicha muestra biológica es suero.
9. Un método de acuerdo con la reivindicación 1, en el que dicha muestra biológica es orina.
1. Un método de acuerdo con la reivindicación 1, en el que dicho biomarcador se mide mediante la medición de la cantidad de proteína presente en dicha muestra.
11. Un método de acuerdo con la reivindicación 1, en el que dicho biomarcador se mide midiendo el nivel de ARNm que codifica dicho biomarcador.
12. Un método de acuerdo con la reivindicación 1, en el que el nivel de biomarcador presente en dicha muestra se compara con un nivel umbral para dicho biomarcador y, si es superior, se considera que dicho sujeto tiene resistencia in vivo al tratamiento con 2,2-dimetil-A/-((S)-6-oxo-6,7-dihidro-5/-/-dibenzo[b,d]azepin-7-il)-A/-(2,2,3,3,3- pentafluoro-propilj-malonamida.
13. Un método de acuerdo con la reivindicación 12, en el que dicho biomarcador es IL-6 y dicho nivel umbral para IL- 6 es de aproximadamente 5 pg/ml.
14. Un método de acuerdo con la reivindicación 12, en el que dicho biomarcador es IL-8 y dicho nivel umbral para IL- 8 es de aproximadamente 5 pg/ml.
15. Una combinación secuencial o simultánea de (A) Compuesto I; y (B) un agente anti-IL-6 y/o anti-IL-8 para su uso como un medicamento, en la que el agente anti-IL-6 o el agente anti-IL-8 es un ARN antisentido, ARNhc, ARNip o anticuerpo de IL-6 o IL-8.
16. La combinación para su uso de acuerdo con la reivindicación 15, en la que dicha combinación comprende tanto un agente anti-IL-6 como un agente anti-IL-8.
17. La combinación para su uso de acuerdo con la reivindicación 15 o 16, en la que dicho agente anti-IL-6 es un anticuerpo anti-IL-6.
18. La combinación para su uso de acuerdo con la reivindicación 15 o 16, en la que dicho agente anti-IL-8 es un anticuerpo anti-IL-8.
19. La combinación para su uso de acuerdo con una cualquiera de las reivindicaciones 15 a 17, en la que dicho agente anti-IL-6 es un ácido nucleico que interfiere en la expresión de un ácido nucleico que codifica IL-6.
2. La combinación para su uso de acuerdo con la reivindicación 19, en la que dicho ácido nucleico que interfiere en la expresión de un ácido nucleico que codifica IL-6 es un ARN antisentido.
21. La combinación para su uso de acuerdo con la reivindicación 19, en la que dicho ácido nucleico que interfiere en la expresión de un ácido nucleico que codifica IL-6 es un ARNhc o un ARNip.
22. La combinación para su uso de acuerdo con la reivindicación 15, 16 o 18, en la que dicho agente anti-IL-8 es un ácido nucleico que interfiere en la expresión de un ácido nucleico que codifica la IL-8.
23. La combinación para su uso de acuerdo con la reivindicación 22, en la que dicho ácido nucleico que interfiere en la expresión de un ácido nucleico que codifica la IL-8 es un ARN antisentido.
24. La combinación para su uso de acuerdo con la reivindicación 22, en la que dicho ácido nucleico que interfiere en 5 la expresión de un ácido nucleico que codifica la IL-8 es un ARNhc o un ARNip.
25. Un kit que comprende: (A) Compuesto I; y (B) un agente anti-IL-6 y/o anti-IL-8 como se ha definido en la reivindicación 15.
26. El uso de una combinación de (A) Compuesto I; y (B) un agente anti-IL-6 y/o anti-IL-8 como se ha definido en la
reivindicación 15 para la fabricación de un medicamento para el tratamiento de un trastorno p rol iterativo, en particular, de cáncer.
Patentes similares o relacionadas:
Composiciones para la supresión del cáncer por inhibición de TMCC3, del 29 de Julio de 2020, de Development Center For Biotechnology: Un anticuerpo contra la proteína con dominios de superhélice transmembrana 3 (TMCC3), o un fragmento de unión de la misma, en donde el anticuerpo […]
Métodos para detectar distintivos de enfermedades o afecciones en fluidos corporales, del 15 de Julio de 2020, de PRESIDENT AND FELLOWS OF HARVARD COLLEGE: Un método in vitro para diagnosticar la presencia de un agente infeccioso en un individuo que comprende los pasos de: obtener un primer perfil de expresión […]
Biomarcadores de pronóstico y predictivos y aplicaciones biológicas de los mismos, del 1 de Julio de 2020, de INSTITUT GUSTAVE ROUSSY: Un método para evaluar la sensibilidad o la resistencia de un tumor frente a un agente antitumoral, que comprende evaluar la cantidad de complejo eiF4E-eiF4G (complejo Cap-ON) […]
Métodos para clasificar pacientes con un cáncer sólido, del 24 de Junio de 2020, de INSERM (INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE): Un método in vitro para el pronóstico del tiempo de supervivencia de un paciente que padece un cáncer sólido, cuyo método comprende los siguientes […]
Procedimiento de detección del cáncer, del 24 de Junio de 2020, de Sienna Cancer Diagnostics Ltd: La presente invención proporciona un procedimiento para resolver una evaluación citológica no concluyente de células epiteliales de vejiga en […]
Método para el diagnóstico/pronóstico de cáncer colorrectal, del 17 de Junio de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC): La presente invención se refiere a un método de obtención de datos útiles para el diagnóstico, el pronóstico o la monitorización de la evolución de cáncer colorrectal (CCR), […]
Método de deducción de un valor de positividad de biomarcador en porcentaje para células seleccionadas presentes en un campo de visión, del 10 de Junio de 2020, de NOVARTIS AG: Método de deducción de un valor para el % de positividad de biomarcador (PBP) para todas las células u, opcionalmente, uno o más subconjuntos de las […]
Medios y métodos para la predicción de la respuesta a un tratamiento de un paciente con cáncer, del 10 de Junio de 2020, de Grabe, Niels: Un método para predecir si un paciente con cáncer con un tumor sólido responde a un tratamiento con quimioterapia, que comprende las etapas que consisten […]