Sistemas de suministro transdémico que comprenden bupivacaína.
Un sistema de suministro transdérmico (2) que comprende:
- una capa de refuerzo (4);
- un depósito (6) que contiene bupivacaína; y
- un revestimiento de liberación (8);
en el que:
- dicho depósito (6) es una matriz de tipo adhesiva que comprende una mezcla de: (i) un poliisobutileno de altopeso molecular que tiene un peso molecular medio en viscosidad de 450.000 a 2.100.000; y (ii) unpoliisobutileno de bajo peso molecular que tiene un peso molecular medio en viscosidad de 1.000 a 450.000;
- dicho depósito (6) comprende adicionalmente uno o más agentes modificadores de energía de superficie yreología seleccionados de acetato isobutirato de sacarosa, 1,6-hexanodiol lactato glicolato, 1,6-hexanodiollactato caproato, glicerol lactato caproato, glicerol lactato glicolato, glicerol lactato glicolato con anhídridosuccínico, lactato glicolato de ácido glicólico o lactato glicolato de ácido láctico; y
- dicho depósito (6) comprende adicionalmente un plastificante.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2007/022927.
Solicitante: DURECT CORPORATION.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 10260 Bubb Road Cupertino, CA 95014 ESTADOS UNIDOS DE AMERICA.
Inventor/es: YUM, SU II, BROWN, JAMES, E., KWON,SUNG YUN, SONG,XIAO PING.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/445 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Piperidinas no condensadas, p. ej. piperocaína.
- A61K9/70 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Bases para tiras, hojas o filamentos.
- A61L15/58 A61 […] › A61L PROCEDIMIENTOS O APARATOS PARA ESTERILIZAR MATERIALES U OBJECTOS EN GENERAL; DESINFECCION, ESTERILIZACION O DESODORIZACION DEL AIRE; ASPECTOS QUIMICOS DE VENDAS, APOSITOS, COMPRESAS ABSORBENTES O ARTICULOS QUIRURGICOS; MATERIALES PARA VENDAS, APOSITOS, COMPRESAS ABSORBENTES O ARTICULOS QUIRURGICOS (conservación de cuerpos o desinfección caracterizada por los agentes empleados A01N; conservación, p. ej. esterilización de alimentos o productos alimenticios A23; preparaciones de uso medico, dental o para el aseo A61K). › A61L 15/00 Aspectos químicos de vendas, apósitos o compresas absorbentes o utilización de materiales para su fabricación (para vendas líquidas A61L 26/00; apósitos radiactivos A61M 36/14). › Adhesivos (adhesivos conductores de la electricidad que se utilizan en terapia o en examen in vivo A61K 50/00).
PDF original: ES-2388355_T3.pdf
Fragmento de la descripción:
Sistemas de suministro transdérmico que comprenden bupivacaína
5 Campo de la invención
La invención se refiere en general a sistemas de suministro transdérmico y métodos relacionados. Más particularmente la invención se refiere a sistemas de suministro transdérmico y métodos relacionados para suministrar por vía transdérmica bupivacaína a través de la piel.
Antecedentes de la invención
Los trastornos de dolor local comprenden dolor que es específico de un tejido o región particular de un sujeto. Por ejemplo, ciertos tipos de dolor neuropático, tales como neuralgia postherpética, son trastornos de dolor local. De 15 forma similar, ciertos otros tipos de dolor, tales como dolor lumbar bajo, son trastornos de dolor local.
Se usan muchos medicamentos para el tratamiento del dolor, que varían de compuestos bien conocidos sin receta tales como aspirina, acetaminófeno, ibuprofeno y otros compuestos antiinflamatorios no esteroideos hasta entidades químicas más nuevas tales como los compuestos inhibidores de ciclooxigenasa II o narcóticos tales como opioides. Muchos analgésicos tales se usan de forma sistémica para tratar el dolor no localizado.
Lo que se necesita es un sistema de suministro transdérmico que aborde los problemas en la técnica asociados con tratamiento de trastornos de dolor local, junto con métodos relacionados.
25 Sumario de la invención
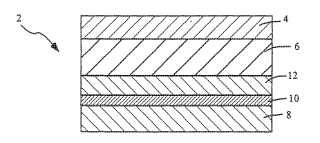
La presente invención proporciona un sistema de suministro transdérmico (2) que comprende:
- una capa de refuerzo (4) ; -un depósito (6) que contiene bupivacaína; y -un revestimiento de liberación (8) ;
en el que:
-dicho depósito (6) es una matriz de tipo adhesivo que comprende una mezcla de: (i) un poliisobutileno de alto peso molecular que tiene un peso molecular medio en viscosidad de 450.000 a 2.100.000; y (ii) un poliisobutileno de bajo peso molecular que tiene un peso molecular medio en viscosidad de 1.000 a 450.000; -dicho depósito (6) comprende adicionalmente uno o más agentes modificadores de energía de superficie y reología seleccionados de acetato isobutirato de sacarosa, 1, 6-hexanodiol lactato glicolato, 1, 6-hexanodiol lactato caproato, glicerol lactato caproato, glicerol lactato glicolato, glicerol lactato glicolato con anhídrido succínico, lactato glicolato de ácido glicólico o lactato glicolato de ácido láctico; y -dicho depósito (6) comprende adicionalmente un plastificante.
La presente invención también proporciona un sistema de suministro transdérmico (2) como se ha definido 45 anteriormente para su uso en un método de tratamiento del cuerpo humano o animal.
La presente invención también proporciona un sistema de suministro transdérmico (2) como se ha definido anteriormente para su uso en un método para tratar dolor localizado.
Breve descripción de los dibujos
La Figura 1 muestra una vista en sección transversal a través de un sistema de suministro transdérmico de acuerdo con la presente invención.
55 La Figura 2 muestra una representación esquemática de un proceso de fabricación para producir un sistema de suministro transdérmico de acuerdo con la presente invención.
La Figura 3 muestra perfil de flujo cutáneo in vivo e in vitro para realizaciones del sistema de suministro transdérmico de la invención que comprende bupivacaína.
La Figura 4 muestra resultados de ensayos de velocidad de disolución para realizaciones del sistema de suministro transdérmico de la invención que comprende bupivacaína.
La Figura 5 muestra una representación de concentración frente a tiempo para la Parte 1 del Ejemplo 11. 65 La Figura 6 muestra una representación de concentración frente a tiempo para la Parte 2 del Ejemplo 11.
La Figura 7 muestra una representación del efecto de la tensión en fuerza de adhesión de acero de 90 grados para diversas realizaciones de la presente invención.
La Figura 8 muestra una representación de Intensidad de Dolor Media por Grupo de Tratamiento. 5 La Figura 9 muestra una representación de puntuaciones de Intensidad de Dolor Cruzado.
La Figura 10 muestra una representación de la Mediana de Intensidad de Dolor por Grupo de Tratamiento.
La Figura 11 muestra un gráfico de barras de la mediana de puntuaciones de Impresión Global de Cambio del Paciente.
Descripción detallada de la invención
Antes de describir la presente invención en detalle, debe entenderse que la presente invención no se limita a materiales o parámetros de proceso particularmente ejemplificados puesto que tales pueden, por supuesto, variar. Debe entenderse que la terminología usada en este documento es para el fin de describir realizaciones particulares de la invención solamente, y no se pretende que sea limitante.
Como se usa en el presente memoria descriptiva y las reivindicaciones adjuntas, las formas singulares “un” y “el” incluyen referentes plurales a no ser que el contenido claramente indique otra cosa. Por ejemplo, la referencia a “un polímero” incluye una mezcla de dos o más de tales moléculas, la referencia a “un disolvente” incluye una mezcla de dos o más de tales composiciones, la referencia a “un adhesivo” incluye mezclas de dos o más de tales materiales, y similares.
A. Introducción
Los inventores se han dado cuenta inesperadamente que es posible proporcionar tratamientos con bupivacaína eficaces para dolor local proporcionando los TDS de la invención y métodos relacionados.
Muchos analgésicos sistémicos crean efectos secundarios sistémicos. Por ejemplo, los opioides sistémicos pueden generar estreñimiento, y pueden hacerse adictivos en ciertos sujetos. Por lo tanto, en ciertas circunstancias, pueden emplearse analgésicos que actúan localmente. Una clase de analgésicos de acción local comprende anestesia local. Se ha planteado la hipótesis de que la anestesia local actúa principalmente inhibiendo la entrada de sodio a través
de canales iónicos específicos de sodio en la membrana de células neuronales, en particular los denominados canales de sodio abiertos por voltaje. Cuando la entrada de sodio se interrumpe, no puede surgir un potencial de acción y se cree que la conducción de la señal se inhibe. Hay varios miembros de la clase de anestesia local, incluyendo bupivacaína.
La bupivacaína es un agente anestésico de acción local, por lo tanto las concentraciones en plasma sistémicas no significan que haya actividad del fármaco. Son, sin embargo, indicativas de efectos secundarios. Estos incluyen convulsiones generalizadas, coma, paro respiratorio, bradicardia y taquiarritmia. En última instancia, tales efectos secundarios pueden conducir a la muerte. La toxicidad de la bupivacaína, especialmente su toxicidad para el SNC y su cardiotoxicidad, es una preocupación cuando se administra bupivacaína de forma convencional (por ejemplo por
45 vía parenteral) , usando vías convencionales de administración y dosificaciones convencionales.
En el documento EP 0 331 392 se describe un dispositivo de suministro transdérmico autoadhesivo, que comprende una capa de refuerzo, poliisobutileno de bajo peso molecular y alto peso molecular y tetracaína. Otros agentes adecuados incluyen benzocaína, etidocaína, procaína, prilocaína, cloroprocaína y bupivacaína.
Adicionalmente, puede desaprobarse convencionalmente la bupivacaína como una elección de anestesia local particularmente para administración crónica. Esto se debe a su potencial para irritación cutánea. La irritación cutánea es un inconveniente principal para el desarrollo exitoso de TDS. T. K. Ghosh et al., "Transdermal and Topical Drug Deliver y Systems", Capítulo 6, Interpharm Press (1997) . Se ha sugerido una correlación entre el Log P
55 de un compuesto y su potencial para irritación cutánea. En N. Mize et al., "Quantitative Structure-Activity Relationship and Cytotoxicity, " Curr. Problems in Dermatology 23: 224-229 (1995) ("Mize et al.") , se desarrolló una correlación a partir de ensayos de 92 compuestos de clase terapéutica y estructura química ampliamente diversa. Esta correlación se expresó como Ecuación 1 posterior:
Log 1/CI50 = 0, 43 (+/-0, 06) log P + 1, 71 (+/-0, 19)... [Seguir leyendo]
Reivindicaciones:
1. Un sistema de suministro transdérmico (2) que comprende:
-una capa de refuerzo (4) ; -un depósito (6) que contiene bupivacaína; y -un revestimiento de liberación (8) ;
en el que:
- dicho depósito (6) es una matriz de tipo adhesiva que comprende una mezcla de: (i) un poliisobutileno de alto peso molecular que tiene un peso molecular medio en viscosidad de 450.000 a 2.100.000; y (ii) un poliisobutileno de bajo peso molecular que tiene un peso molecular medio en viscosidad de 1.000 a 450.000; -dicho depósito (6) comprende adicionalmente uno o más agentes modificadores de energía de superficie y
reología seleccionados de acetato isobutirato de sacarosa, 1, 6-hexanodiol lactato glicolato, 1, 6-hexanodiol lactato caproato, glicerol lactato caproato, glicerol lactato glicolato, glicerol lactato glicolato con anhídrido succínico, lactato glicolato de ácido glicólico o lactato glicolato de ácido láctico; y -dicho depósito (6) comprende adicionalmente un plastificante.
2. El sistema de suministro transdérmico (2) de la reivindicación 1 en el que en dicha mezcla la relación de poliisobutileno de alto peso molecular:poliisobutileno de bajo peso molecular es de 20:80 a 70:30 en peso.
3. El sistema de suministro transdérmico (2) de la reivindicación 2 en el que en dicha mezcla la relación de
poliisobutileno de alto peso molecular:poliisobutileno de bajo peso molecular es de 40:60 a 50:50 en peso. 25
4. El sistema de suministro transdérmico (2) de una cualquiera de las reivindicaciones precedentes en el que dicho poliisobutileno de alto peso molecular tiene un peso molecular medio en viscosidad de aproximadamente 1.100.100 y dicho poliisobutileno de bajo peso molecular tiene un peso molecular medio en viscosidad de aproximadamente 50.000-55.000.
5. El sistema de suministro transdérmico (2) de una cualquiera de las reivindicaciones precedentes en el que dicho uno o más agentes modificadores de energía de superficie y reología es acetato isobutirato de sacarosa.
6. El sistema de suministro transdérmico (2) de una cualquiera de las reivindicaciones precedentes en el que la
cantidad de dichos uno o más agentes modificadores de energía de superficie y reología en dicho sistema de suministro transdérmico es de 0, 01 a 25% en peso.
7. El sistema de suministro transdérmico (2) de una cualquiera de las reivindicaciones precedentes en el que dicho
plastificante se selecciona de polibuteno, aceite mineral, aceite de linaza, octil palmitato, escualeno, aceite de 40 silicona, isobutil estearato, aceite de oliva, isopropil miristato, alcohol isoestearílico y alcohol oleílico.
8. El sistema de suministro transdérmico (2) de la reivindicación 7, en el que dicho plastificante es polibuteno.
9. El sistema de suministro transdérmico (2) de una cualquiera de las reivindicaciones precedentes, en el que dicha 45 capa de refuerzo (4) es un material transpirable que comprende tela tejida o no tejida.
10. El sistema de suministro transdérmico (2) de una cualquiera de las reivindicaciones precedentes, en el que dicha capa de refuerzo (4) comprende una tela de poliéster no tejida.
50 11. El sistema de suministro transdérmico (2) de una cualquiera de las reivindicaciones precedentes, en el que el sistema de suministro transdérmico es estéril.
12. El sistema de suministro transdérmico (2) de una cualquiera de las reivindicaciones precedentes, en el que la
bupivacaína comprende base libre de bupivacaína. 55
13. El sistema de suministro transdérmico (2) de una cualquiera de las reivindicaciones precedentes, en el que el depósito (6) tiene un grosor de 0, 0254 a 0, 254 mm.
14. El sistema de suministro transdérmico (2) como se define en una cualquiera de las reivindicaciones 1 a 13, para 60 su uso en un método de tratamiento del cuerpo humano o animal.
15. El sistema de suministro transdérmico (2) como se define en una cualquiera de las reivindicaciones 1 a 13, para su uso en un método para tratar dolor localizado.
Patentes similares o relacionadas:
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Triple combinación de antagonistas del receptor 5-HT6 puros, inhibidores de la acetilcolinesterasa y antagonista del receptor NMDA, del 15 de Julio de 2020, de SUVEN LIFE SCIENCES LIMITED: Una combinación que comprende un antagonista del receptor 5-HT6 puro, un inhibidor de la acetilcolinesterasa y un antagonista del receptor NMDA, en el que el antagonista […]
Combinación de agonistas inversos del receptor de histamina-3 con inhibidores de acetilcolinesterasa, del 24 de Junio de 2020, de SUVEN LIFE SCIENCES LIMITED: Una combinación que comprende un agonista inverso del receptor de histamina-3 y un inhibidor de acetilcolinesterasa; en donde el agonista inverso del receptor de histamina-3 […]
Compuestos inhibidores de la acetilcolinesterasa y agonistas de los receptores serotoninérgicos 5HT4, con efecto paramnesiante, sus procedimientos de preparación y composiciones farmacéuticas que los contienen, del 10 de Junio de 2020, de Université de Caen: Compuesto de fórmula general (I): **(Ver fórmula)** en la que: X representa un átomo de hidrógeno, o un átomo de halógeno […]
Nuevos derivados de piperazina y piperidina, síntesis y uso de los mismos en la inhibición de la oligomerización de VDAC, la apoptosis y la disfunción mitocondrial, del 3 de Junio de 2020, de The National Institute for Biotechnology in the Negev Ltd: Compuesto de Fórmula general (Id): **(Ver fórmula)** en la que L2 es un grupo de enlace seleccionado del grupo que consiste en un alquilamidileno […]
Compuestos de benzaldehído sustituidos y métodos para su uso en el aumento de la oxigenación tisular, del 27 de Mayo de 2020, de Global Blood Therapeutics, Inc: Un compuesto de Fórmula (I): **(Ver fórmula)** o un tautómero o una sal farmacéuticamente aceptable del mismo, para su uso en el tratamiento […]
Composición farmacéutica en comprimido que comprende bilastina, del 27 de Mayo de 2020, de Alfred E. Tiefenbacher (GmbH & Co. KG): Una composición farmacéutica en forma de comprimido, que comprende a) una forma cristalina de bilastina, en donde la forma cristalina tiene picos característicos a 6,53, […]
Nuevas composiciones para prevenir y/o tratar trastornos degenerativos del sistema nervioso central, del 27 de Mayo de 2020, de AMICUS THERAPEUTICS, INC: Un compuesto de Fórmula III: **(Ver fórmula)** en donde: R1 es C(R2)(R3)(R4); R2 es hidrógeno, -OH o halógeno; R3 es hidrógeno, -OH, halógeno o -CH3; […]