SINTESIS DE (R) Y (S)-AMINOCARNITINA Y DERIVADOS DE LA MISMA A PARTIR DE ACIDO D- Y L- ASPARTICO.
Procedimiento para la preparación de compuestos con la fórmula:
** ver fórmula** en la que W es Q(CH3)3 en el que Q es P Y es hidrógeno o uno de los siguientes grupos: -R1, -COR 1, -CSR1, -COOR 1, -CSOR1, -CONHR1, -CSNHR 1, -SOR1, -SO 2R 1, -SONHR1, -SO 2NHR 1, en los que R 1 es un alquilo saturado o insaturado, lineal o ramificado que contiene desde 1 hasta 20 átomos de carbono, opcionalmente sustituido con un grupo A 1, en el que A 1 se selecciona del grupo que consiste en halógeno, arilo o heteroarilo, ariloxilo o heteroariloxilo C6-C14, que pueden estar opcionalmente sustituidos con alquilo o alcoxilo inferior saturado o insaturado, lineal o ramificado, que contiene desde 1 hasta 20 átomos de carbono, halógenos; comprendiendo dicho procedimiento las siguientes etapas según el esquema a continuación: ** ver fórmulas**
a) conversión de ácido D-aspártico o L-aspártico (1) en ácido D-aspártico o L-aspártico N-Y sustituido (2);
b) conversión del ácido D-aspártico o L-aspártico N-Y sustituido (2) en el respectivo anhídrido (3);
c) reducción del anhídrido (3) obtenido en la etapa b) para dar la correspondiente 3-(NH-Y)-lactona (4);
d) apertura de la lactona (4) obtenida en la etapa c) con un alcohol ROH, en el que R es alquilo de 1 a 14 términos lineal o ramificado, o un aralquilo, para proporcionar el correspondiente éster R del ácido D- o L-3-(NH-Y)-amino-4hidroxibutírico (5a);
e) transformación del grupo 4-hidroxilo del ácido D- o L-3-(NH-Y)-amino-4-hidroxibutírico en un grupo saliente (5b);
f) substitución del grupo saliente en la posición 4 del ácido D- o L-3-(NH-Y)-aminobutírico (5b) por un grupo trimetilfosfonio para proporcionar la correspondiente fosfonioaminocarnitina (6b);
g) hidrólisis del grupo éster; y, si se desea,
h) restauración del grupo amino
Tipo: Resumen de patente/invención. Número de Solicitud: W03000846IT.
Solicitante: SIGMA-TAU INDUSTRIE FARMACEUTICHE RIUNITE S.P.A..
Nacionalidad solicitante: Italia.
Dirección: VIALE SHAKESPEARE, 47,00144 ROMA.
Inventor/es: GIANNESSI,FABIO,C/O SIGMA-TAU INDUSTRIE, TINTI,MARIA,ORNELLA,C/O SIGMA-TAU INDUSTRIE, DELL'UOMO,NATALINA,C/O SIGMA-TAU INDUSTRIE, DE ANGELIS,FRANCESCO C/O SIGMA-TAU INDUSTRIE.
Fecha de Publicación: .
Fecha Concesión Europea: 16 de Septiembre de 2009.
Clasificación PCT:
- C07C227/16 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07C COMPUESTOS ACICLICOS O CARBOCICLICOS (compuestos macromoleculares C08; producción de compuestos orgánicos por electrolisiso electroforesis C25B 3/00, C25B 7/00). › C07C 227/00 Preparación de compuestos que contienen grupos amino y carboxilo unidos a la misma estructura carbonada. › por reacciones que no implican a los grupos amino o carboxilo.
- C07C229/26 C07C […] › C07C 229/00 Compuestos que contienen grupos amino y carboxilo unidos a la misma estructura carbonada. › con más de un grupo amino unido a la estructura carbonada, p. ej. lisina.
- C07F9/54 C07 […] › C07F COMPUESTOS ACICLICOS, CARBOCICLICOS O HETEROCICLICOS QUE CONTIENEN ELEMENTOS DISTINTOS DEL CARBONO, HIDROGENO, HALOGENOS, OXIGENO, NITROGENO, AZUFRE, SELENIO O TELURO (porfirinas que contienen metal C07D 487/22; compuestos macromoleculares C08). › C07F 9/00 Compuestos que contienen elementos de los grupos 5 o 15 del sistema periódico. › Compuestos de fosfonio cuaternario.
Clasificación antigua:
- C07C227/16 C07C 227/00 […] › por reacciones que no implican a los grupos amino o carboxilo.
- C07C229/26 C07C 229/00 […] › con más de un grupo amino unido a la estructura carbonada, p. ej. lisina.
- C07F9/54 C07F 9/00 […] › Compuestos de fosfonio cuaternario.
Fragmento de la descripción:
Síntesis de (R) y (S)-aminocarnitina y derivados de la misma a partir de ácido D- y L-aspártico.
La invención descrita en el presente documento se refiere a un procedimiento para la producción de (R) y (S)-3-aminobutanoato de 4-fosfonio y sus derivados.
La aminocarnitina es una sustancia dotada de propiedades farmacéuticas interesantes y sus N-derivados despiertan un grado similar de interés. Por ejemplo, D.L. Jenkins y W.O. Griffith han descrito los efectos anticetogénicos e hipoglicémicos de los N-acetilatos en forma racémica. La patente estadounidense 4.521.432 (Takeda) describe las posibles aplicaciones de la (-)-N-acetil-aminocarnitina, sal interna, en el tratamiento de las complicaciones de la diabetes. Se ha descrito una actividad similar para el clorhidrato de cloruro de (+)-aminocarnitina. Por tanto sería de interés tener procedimientos para las preparaciones de los enantiomorfos, que estén a la altura de los criterios de conveniencia económica a una escala industrial.
Se obtiene R(+)-aminocarnitina por medio de hidrólisis de R-(-)-N-acetil-carnitina, aislándose esta última mediante el cultivo de microorganismos de los géneros Emericella o Aspergillus, o, alternativamente, por medio de un procedimiento químico complejo descrito en la patente de Takeda citada anteriormente.
Se conocen otros métodos de síntesis química, todos bastante complejos, tales como, por ejemplo, el descrito por Shinagawa, J. Med. Chem., 30; 1458 (1987), que usa diazometano, que se sabe que es peligroso. En cualquier caso, este método no es de interés industrial, porque se concibió con el fin de determinar la configuración absoluta del enantiomorfo individual.
Los enantiomorfos individuales también pueden obtenerse mediante resolución de la mezcla racémica de (±)-N-acetilaminocarnitina, tal como se describe en el documento EP 0 287 523.
Alternativamente, puede obtenerse el cloruro de R(+)- y S(-)-aminocarnitina mediante resolución en cromatografía en gel de sílice o cristalización fraccionada de los respectivos cloruros de éster de bencilo, N-a-metilbencilo, tal como se describe en la patente italiana 1.231.751. Este procedimiento, que implica la desbencilación posterior, es trabajoso y no es muy adecuado para producción a escala industrial.
También se conoce un método que usa carnitina quiral como producto de partida (Journal of Organic Chemistry, 1995, 60, 8318-8319; (Sigma-Tau) documento EP 636603, 1995). Este método usa reactivos tales como anhídrido metanosulfónico y azida de sodio y disolventes tales como dimetilsulfóxido anhidro, e implica una etapa de reducción catalítica.
Se ha encontrado ahora un procedimiento para la preparación de enantiomorfos individuales de (R) y (S) 3-aminobutanoato de 4-fosfonio (a continuación en el presente documento denominado fosfonioaminocarnitina) partiendo de ácido D-aspártico y ácido L-aspártico, respectivamente, con un rendimiento global de al menos el 38% en de 6 a 7 etapas, sin que sea necesario purificar los productos intermedios. En la práctica, el procedimiento según la invención descrito en el presente documento se realiza por medio de hidrólisis directa del éster de fosfonioaminocarnitina quiral en un entorno ácido para proporcionar un sal interna de aminocarnitina quiral sin purificación de los productos intermedios. La pureza enantiomérica de la fosfonioaminocarnitina así obtenida es >99%.
El 3-aminobutanoato de 4-fosfonio es potencialmente útil como inhibidor de CPT con efectos anticetogénicos e hipoglicémicos y como producto intermedio para la síntesis de compuestos farmacológicamente activos.
Por tanto, un objeto de la invención descrita en el presente documento es un procedimiento para la preparación de (R) y (S) fosfonioaminocarnitina y de varios de sus derivados N-sustituidos. En particular, la invención descrita en el presente documento proporciona un procedimiento que también permite obtener fosfonioaminocarnitina que es útil para la preparación de medicamentos para el tratamiento de enfermedades asociadas con hiperactividad de carnitina palmitoiltransferasa.
Se describen estos derivados en la solicitud de patente italiana IT1299266 (documento M198A001075), presentada el 15 de mayo de 1998, y en la solicitud de patente internacional WO99/59957 (documento PCT/IT99/00126), presentada el 11 de mayo de 1999, ambas en nombre del solicitante del documento WO 01/02341 del mismo solicitante que da a conocer un procedimiento para la preparación de aminocarnitina exclusivamente.
El procedimiento según la invención descrita en el presente documento permite la preparación de compuestos con la siguiente fórmula:
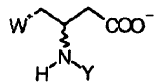
en la que
W es Q(CH3)3 en el que Q es P
Y es hidrógeno o uno de los siguientes grupos:
-R1,
-COR1,
-CSR1,
-COOR1,
-CSOR1,
-CONHR1,
-CSNHR1,
-SOR1,
-SO2R1,
-SONHR1,
-SO2NHR1,
en los que
R1 es un alquilo saturado o insaturado, lineal o ramificado que contiene desde 1 hasta 20 átomos de carbono, opcionalmente sustituido con un grupo A1, en el que A1 se selecciona del grupo que consiste en halógeno, arilo o heteroarilo, ariloxilo o heteroariloxilo C6-C14, que pueden estar opcionalmente sustituidos con alquilo o alcoxilo inferior saturado o insaturado, lineal o ramificado, que contiene desde 1 hasta 20 átomos de carbono, halógenos;
comprendiendo dicho procedimiento las siguientes etapas: a)-h) tal como se definen en la reivindicación 1.
La utilidad de esta nueva ruta de síntesis de fosfonioaminocarnitina ópticamente pura, en comparación con el método que implica el uso de carnitina quiral como producto de partida (Journal of Organic Chemistry, 1995, 60, 8318-8319; documento EP 0 636 603 (Sigma-Tau)), consiste en el hecho de que se evita el uso de reactivos tales como anhídrido metanosulfónico y azida de sodio, de dimetilsulfóxido como disolvente, y de un etapa de reducción catalítica. Es más, los volúmenes implicados son inferiores, permitiendo así un mejor manejo de las reacciones y de cualquier purificación de productos intermedios. De hecho, el procedimiento según la invención presenta la ventaja adicional de que todas las etapas pueden llevarse a cabo evitando la purificación de los productos intermedios, sin que esto ponga en peligro la pureza del producto final. Esta característica ventajosa es obvia para el experto en la técnica; en particular, se apreciará el hecho de que no sean necesarias operaciones de purificación que darían lugar a una carga adicional en el procedimiento de síntesis en cuanto a costes económicos, tiempo, materiales, personal especializado y equipo.
La gran versatilidad de esta nueva ruta permite en su lugar obtener (R)-fosfonioaminocarnitina.
Los procedimientos que son el sujeto de la invención descrita en el presente documento se describen en el esquema, para formas (R). Es absolutamente obvio para el experto en el sector que el caso de las formas S-(-) se describe igualmente mediante el esquema y que no es necesaria ninguna modificación, aparte del hecho de que el compuesto de partida sea de la configuración opuesta, concretamente ácido S-(-)-aspártico.

En el contexto de la invención descrita en el presente documento, ejemplos del grupo alquilo C1-C20 lineal o ramificado son metilo, etilo, propilo, butilo, pentilo, octilo, nonilo, decilo, undecilo, dodecilo, tridecilo, tetradecilo, pentadecilo, hexadecilo, heptadecilo, octadecilo, nonadecilo y eicosilo y sus posibles isómeros, tales como, por ejemplo, isopropilo, isobutilo y terc-butilo.
Ejemplos del grupo arilo (C6-C14), o ariloxilo, heteroarilo o heteroariloxilo (C6-C14), posiblemente sustituido con alquilo o alcoxilo lineal o ramificado con desde 1 hasta 20 átomos de carbono, siendo dicho grupo alquilo tal como se mostró a modo de ejemplo anteriormente, son fenilo, 1- o 2-naftilo, antracenilo,...
Reivindicaciones:
1. Procedimiento para la preparación de compuestos con la fórmula:

en la que
W es Q(CH3)3 en el que Q es P
Y es hidrógeno o uno de los siguientes grupos:
-R1,
-COR1,
-CSR1,
-COOR1,
-CSOR1,
-CONHR1,
-CSNHR1,
-SOR1,
-SO2R1,
-SONHR1,
-SO2NHR1,
en los que
R1 es un alquilo saturado o insaturado, lineal o ramificado que contiene desde 1 hasta 20 átomos de carbono, opcionalmente sustituido con un grupo A1, en el que A1 se selecciona del grupo que consiste en halógeno, arilo o heteroarilo, ariloxilo o heteroariloxilo C6-C14, que pueden estar opcionalmente sustituidos con alquilo o alcoxilo inferior saturado o insaturado, lineal o ramificado, que contiene desde 1 hasta 20 átomos de carbono, halógenos;
comprendiendo dicho procedimiento las siguientes etapas según el esquema a continuación:
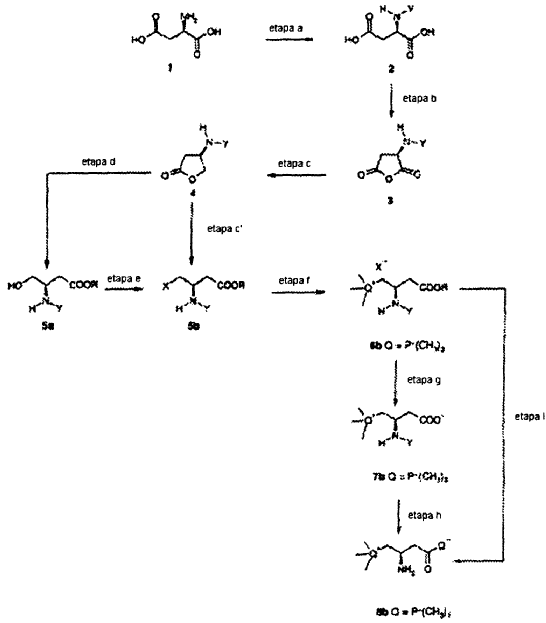
a) conversión de ácido D-aspártico o L-aspártico (1) en ácido D-aspártico o L-aspártico N-Y sustituido (2);
b) conversión del ácido D-aspártico o L-aspártico N-Y sustituido (2) en el respectivo anhídrido (3);
c) reducción del anhídrido (3) obtenido en la etapa b) para dar la correspondiente 3-(NH-Y)-lactona (4);
d) apertura de la lactona (4) obtenida en la etapa c) con un alcohol ROH, en el que R es alquilo de 1 a 14 términos lineal o ramificado, o un aralquilo, para proporcionar el correspondiente éster R del ácido D- o L-3-(NH-Y)-amino-4-hidroxibutírico (5a);
e) transformación del grupo 4-hidroxilo del ácido D- o L-3-(NH-Y)-amino-4-hidroxibutírico en un grupo saliente (5b);
f) substitución del grupo saliente en la posición 4 del ácido D- o L-3-(NH-Y)-aminobutírico (5b) por un grupo trimetilfosfonio para proporcionar la correspondiente fosfonioaminocarnitina (6b);
g) hidrólisis del grupo éster; y, si se desea,
h) restauración del grupo amino.
2. Procedimiento según la reivindicación 1, en el que se eliminan las etapas g) y h) y tras la etapa f) se realiza una hidrólisis en un solo recipiente del éster y el grupo protector en el grupo N en la posición 3.
3. Procedimiento según la reivindicación 1, en el que la etapa c) va seguida directamente por la etapa c') que consiste en la apertura de la lactona para proporcionar el correspondiente ácido D- o L-4-X-3-(N-Y)-aminobutírico, en el que X es un grupo saliente e Y es tal como se definió anteriormente, y en el que la etapa c') va seguida por las etapas f)-h) según la reivindicación 1.
4. Procedimiento según la reivindicación 1, en el que la etapa f) va seguida por la etapa i) que consiste en hidrólisis del éster y desprotección del grupo 3-amino para proporcionar R o S fosfonioaminocarnitina directamente.
5. Procedimiento según la reivindicación 1, en el que el grupo Y es tosilo.
6. Procedimiento según la reivindicación 1 en el que el grupo saliente es yodo.
7. Procedimiento según la reivindicación 1, en el que dicho procedimiento se realiza sin purificación de los productos intermedios.
Patentes similares o relacionadas:
Fenilacetato de L-ornitina y métodos de elaboración del mismo, del 1 de Abril de 2020, de Ocera Therapeutics, Inc: Una composición que comprende una forma cristalina de fenilacetato de L-ornitina, en donde dicha forma cristalina muestra un patrón de difracción de rayos […]
Métodos de fabricación de fenilacetato de L-ornitina, del 13 de Marzo de 2019, de Ocera Therapeutics, Inc: Un proceso de fabricación de sal de fenilacetato de L-ornitina que comprende: preparar una solución de sal de fenilacetato mezclando un ácido fenil acético y una base […]
Reactivos de transfección que contienen amina y métodos para prepararlos y usarlos, del 28 de Febrero de 2019, de LIFE TECHNOLOGIES CORPORATION: Compuesto 87 o sus sales farmacéuticamente aceptables:**Fórmula**
Sal de lisina de ácido 15-hidroxi-8(Z),11(Z),13(E)-eicosatrienoico, del 27 de Febrero de 2019, de DS Biopharma Limited: Una sal de lisina de ácido 15-hidroxi-8(Z),11(Z),13(E)-eicosatrienoico (15-HETrE).
Procedimiento de preparación de una sal de ácido acetilsalicílico y de un aminoácido básico, del 19 de Noviembre de 2018, de Unither Pharmaceuticals: Procedimiento de preparación de una sal de ácido acetilsalicílico y de un aminoácido básico, que comprende la mezcla en un reactor de una solución de […]
Fase cristalina de (3S,3S'') 4,4''-disulfanodiilbis(ácido 3-aminobutano 1-sulfónico) con L-lisina, del 3 de Enero de 2018, de Quantum Genomics: Una forma cristalina de (3S,3S') 4,4'-disulfanodiilbis (ácido 3-aminobutano 1-sulfónico) con L-lisina ABSD.
Fenilacetato de l-ornitina y métodos para elaborar el mismo, del 27 de Septiembre de 2017, de Ocera Therapeutics, Inc: Una composición que comprende una forma cristalina de fenilacetato de L-ornitina, donde dicha forma cristalina exhibe un patrón de difracción en polvo de rayos-X que […]
Derivados deuterados de catecolamina y medicamentos que comprenden dichos compuestos, del 18 de Mayo de 2016, de RATIOPHARM GMBH: Ácido L-2-amino-2,3-dideutero-3-(3,4-dihidroxifenil)propiónico y sus estereoisómeros, enantiómeros o diastereómeros en forma ópticamente pura así como sus […]