Retirada de serina proteasas por tratamiento con dióxido de silicio finamente dividido.
Un procedimiento para reducir la cantidad de una serina proteasa o un zimógeno de serina proteasa en una composición de proteína diana derivada de plasma,
comprendiendo el procedimiento las etapas de:
(a) realizar una primera etapa de enriquecimiento de proteína diana para formar una primera composición enriquecida;
(b) poner en contacto la composición con dióxido de silicio (SiO2) finamente dividido bajo condiciones adecuadas para unir al menos una serina proteasa o zimógeno de serina proteasa; y
(c) separar el SiO2 de la composición para retirar la serina proteasa unida,
en el que la al menos una serina proteasa o zimógeno de serina proteasa es Factor XIa (FXIa), Factor XIIa (FXIIa), Factor XI (FXI), o Factor XII (FXII);
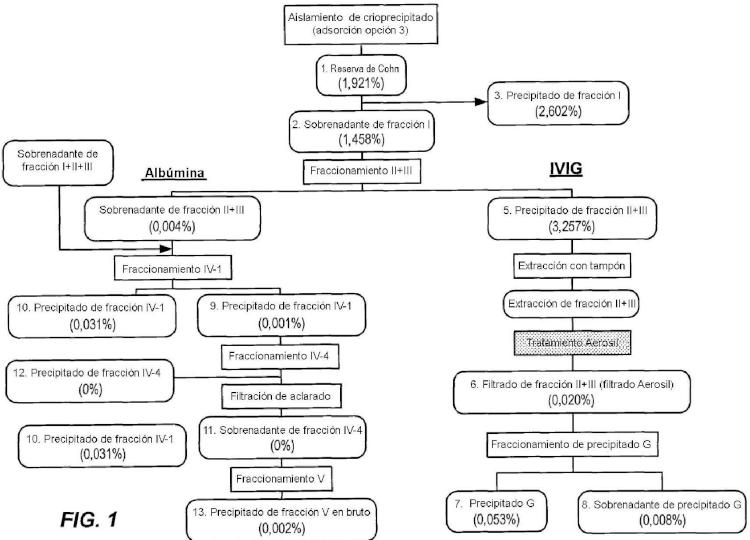
en el que la primera etapa de enriquecimiento de proteína diana es una etapa de precipitación de proteína; en el que la etapa de precipitación de proteína es una etapa de fraccionamiento de alcohol; y
en el que la proteína diana derivada de plasma se selecciona de una inmunoglobulina (Ig), albúmina, alfa-1-antitripsina (A1PI), butirilcolinesterasa, una proteína del sistema del complemento, y un inhibidor inter-alfa-tripsina (Iα
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2011/038247.
Solicitante: BAXTER INTERNATIONAL INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: ONE BAXTER PARKWAY DEERFIELD, IL 60015 ESTADOS UNIDOS DE AMERICA.
Inventor/es: SCHWARZ, HANS-PETER, WEBER, ALFRED, TESCHNER, WOLFGANG, SVATOS, SONJA, MADLENER,RUTH, PLJEVLJAKOVIC,AZRA.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K39/395 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- A61P31/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Antiinfecciosos, es decir antibióticos, antisépticos, quimioterápicos.
- A61P37/00 A61P […] › Medicamentos para el tratamiento de problemas inmunológicos o alérgicos.
PDF original: ES-2505465_T3.pdf
Fragmento de la descripción:
Retirada de serina proteasas por tratamiento con dióxido de silicio finamente dividido Antecedentes de la invención
Se usan productos sanguíneos derivados de plasma no sólo para tratar una variedad de trastornos sanguíneos, sino también enfermedades de otro origen. Por ejemplo, los productos de ¡nmunoglobulina (IgG) de plasma humano se usaron por primera vez en 1952 para tratar una ¡nmunodeficiencia. Desde entonces, las preparaciones de IgG han encontrado un amplio uso en al menos tres categorías principales de afecciones médicas: (1) inmunodeficiencias tales como agammaglobullnemla ligada al cromosoma X, hlpogammaglobullnemla (Inmunodeficiencias primarias), y afecciones de inmunidad deficiente adquirida (inmunodeficiencias secundarias), con niveles de anticuerpos bajos; (2) enfermedades inflamatorias y autoinmunitarias; y (3) infecciones agudas.
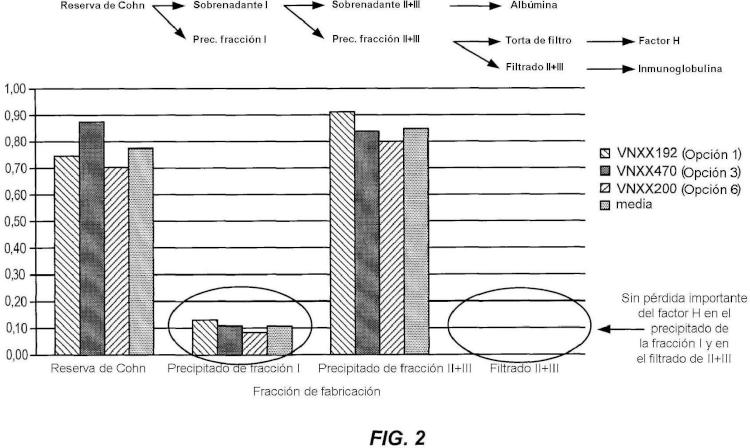
Asimismo, el factor H ha estado implicado como agente terapéutico potencial para varios estados de enfermedades humanas, incluyendo degeneración macular senil (AMD), síndrome urémico hemolítico (aHUS) y glomerulonefritis membranoproliferativa (MPGN). Específicamente, se ha caracterizado una relación causal entre el polimorfismo mononucleotídico (SNP) en el módulo 7 de proteína de control del complemento (CCP) del factor H y la degeneración macular senil (AMD).
Los estudios han demostrado correlaciones entre la disminución de los niveles plasmáticos de las proteínas inter-alfa-inhibidoras (lalp) y la mortalidad en pacientes con septicemia grave (Lim et al., J Infect Dis. (23) Sep 15;188(6):919-26 y Opal et al, Crit Care Med. (27) Feb;35(2):387-92). Además, varios estudios han demostrado que la administración de lalp reduce la mortalidad asociada a septicemia y choque septicémico (Jourdain et al., Am J Respir Crit Care Med. (1997) Dec; 156(6): 1825-33; Yang et al., Crit Care Med. (22) Mar; 3(3):617-22; Lim et al., J Infect Dis. (23) Sep 15; 188(6):919-26; y Wu et al., Crit Care Med. (24) Ag; 32(8): 1747-52; de los que las divulgaciones se incorporan por referencia en el presente documento en su totalidad para todos los propósitos).
Se deben tener en consideración vahas precauciones de seguridad en la fabricación y formulación de los tratamientos biológicos derivados de plasma. Estas Incluyen procedimientos para retirar y/o inactivar patógenos de transmisión hemática (por ejemplo, patógenos víricos y bacterianos), actividad anticomplementaria, y otros contaminantes no deseados que surgen del uso de plasma donado. Los estudios han sugerido que la administración de niveles altos de actividad amidolítica puede dar como resultado acontecimientos tromboembólicos no deseados (Wolberg AS et al, Coagularon factor XI is a contaminant in intravenous immunoglobulin preparations. Am J Hematol 2;65:3-34; y Alvlng BM et al, Contact-activated factors: contaminants of inmunoglobulinas preparations with coagulant and vasoactive properties. J Lab Clin Med 198; 96:334-346; de los que las divulgaciones se incorporan en el presente documento por referencia en su totalidad para todos los propósitos). Destacando esta preocupación fue la reciente retirada voluntaria de octagam® (Octapharma) en los EE. UU. y la suspensión de la autorización de comercialización para octagam® y octagam 1% por la Comisión Europea después del aumento de informes de acontecimientos tromboembólicos. Es probable que el incremento de acontecimientos trombóticos estuviera provocado por niveles altos de actividad amidolítica en el biofármaco, provocado por impurezas de serina proteasas y zimógenos de serina proteasas, tales como factor XI, factor Xla, factor XII y factor Xlla (Notificación de la FDA: Voluntary Market Withdrawal - 23 de septiembre de 21 Octagam [Immune Globulin Intravenous (Human)] 5% Liquid Preparation; Octagam 5 mg/ml, solution pour perfusión -Octapharma France - Mise en quarantaine de tous les lots, publicada en Internet el 9 de septiembre de 21 por AFSSAPS; y Questions and answers on the suspensión of the marketing authorisations for Octagam (human normal immunoglobulin 5 % and 1 %), publicada en Internet el 23 de septiembre de 21 por la Agencia Europea de Medicamentos).
El documento W2785626 divulga un procedimiento para fabricar una composición que contiene un factor purificado para mantener la cicatrización, factor de crecimiento derivado de plaquetas, factor de crecimiento epidérmico, factor de crecimiento transformante alfa, factor de crecimiento transformante beta, factor de crecimiento insulinoide y factor de crecimiento fibroblástico de fuentes, tales como sangre, en el que el procedimiento de fabricación comprende etapas de purificación que se realizan en presencia de antitrombina III.
En el documento US292358, se puede aislar el polipéptido natural de células o fuentes de tejidos por un esquema de purificación apropiado usando técnicas de purificación de proteínas estándar y a continuación se puede reducir notablemente o eliminar la actividad inhibidora de las serina proteasas.
Las serina proteasas dedicadas, conocidas genéricamente como factores de coagulación, son componentes integrales de ambas rutas de activación por contacto y del factor tisular de la cascada de coagulación. Tras un estímulo de las rutas de coagulación, los zimógenos de serina proteasas, que son precursores enzlmátlcos Inactivos, se vuelven proteasas activadas que catalizan la activación del siguiente zimógeno de proteasa, dando como resultado una cascada de activación. Esta cascada de coagulación culmina en la activación de trombina (factor Ha) y factor Xllla, que cumple la función de convertir el fibrinógeno (factor I) en fibrina (factor la) y retícula la fibrina para formar un coágulo de fibrina, respectivamente.
La ruta de activación por contacto, también conocida como la ruta de coagulación intrínseca, comienza con la activación de calicreína y factor XIla (FXIIa) a partir de precalicreína y factor XII, respectivamente. La serina proteasa activada FXIIa escinde el factor XI (FXI), convirtiendo el zimógeno en el factor Xla (FXIa), una serina proteasa activa que participa en la posterior activación del factor Xa (FXa).
Debido al aumento de la preocupación por la presencia de serina proteasa y zimógenos de serina proteasa en composiciones de proteínas derivadas de plasma, aún existe la necesidad en la técnica de obtener procedimientos para reducir los niveles de estos contaminantes, y en particular FXI, FXIa, FXII, y FXIIa. La presente invención cumple estas y otras necesidades proporcionando dichos procedimientos y composiciones de proteínas derivadas de plasma con niveles reducidos de serina proteasa y zimógeno de serina proteasa.
Breve sumario de la invención
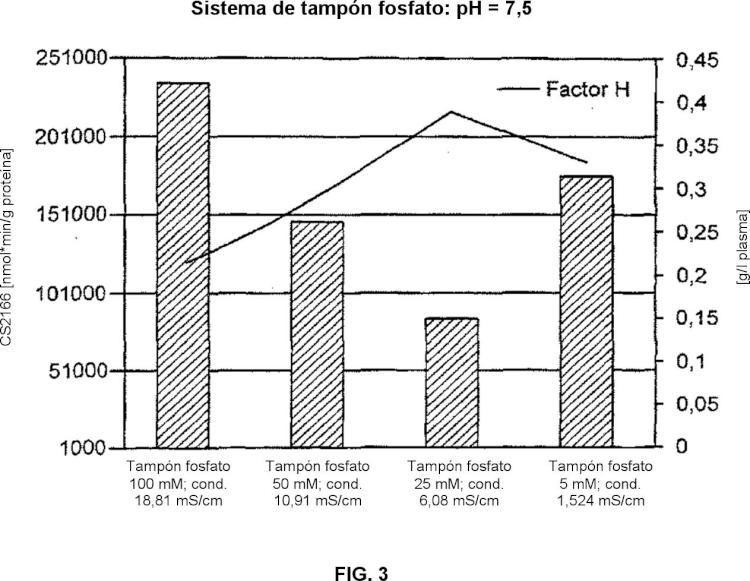
En un aspecto, la presente invención se basa en el sorprendente hallazgo de que las serina proteasas y zimógenos de serina proteasas, y específicamente, FXI, FXIa, FXII, y FXIIa, se pueden retirar de las composiciones de proteínas derivadas de plasma por tratamiento con dióxido de silicio (SÍO2) finamente dividido. De este modo, la presente invención proporciona procedimientos para reducir la actividad de serina proteasa, el contenido en serina proteasa, y el contenido en zimógeno de serina proteasa de las composiciones de proteínas derivadas de plasma. También se proporcionan composiciones de proteínas derivadas de plasma terapéuticas que tienen una actividad de serina proteasa, contenido en serina proteasa y contenido en zimógeno de serina proteasa reducidos, así como procedimientos para tratar o evitar la enfermedad por la administración de las mismas.
En un primer aspecto, la presente invención proporciona un procedimiento para reducir la cantidad de una serina proteasa o un zimógeno de serina proteasa en una composición de proteína diana derivada de plasma, comprendiendo el procedimiento las etapas de: (a) poner en contacto la composición con dióxido de silicio (SÍO2) finamente dividido bajo condiciones adecuadas para unir al menos una serina proteasa o zimógeno de serina proteasa; y (b) separar el S¡2 de la composición para retirar la serina proteasa unida. En un modo de realización preferente, la serina proteasa o zimógeno de serina proteasa es factor Xla (FXIa), factor XIla (FXIIa), factor XI (FXI), o factor XII (FXII), como se especifica en la reivindicación 1.
El procedimiento descrito anteriormente comprende además la etapa de realizar una primera etapa de enriquecimiento de proteína diana para formar una primera composición enriquecida, antes de poner en contacto la composición con el dióxido de silicio (SÍO2) finamente dividido. En un modo de realización, la primera etapa de enriquecimiento de proteína diana es una etapa de precipitación de proteína. En un modo de realización específico, la etapa de precipitación de... [Seguir leyendo]
Reivindicaciones:
1. Un procedimiento para reducir la cantidad de una serina proteasa o un zimógeno de serina proteasa en una composición de proteína diana derivada de plasma, comprendiendo el procedimiento las etapas de:
(a) realizar una primera etapa de enriquecimiento de proteína diana para formar una primera composición enriquecida;
(b) poner en contacto la composición con dióxido de silicio (SÍO2) finamente dividido bajo condiciones adecuadas para unir al menos una serina proteasa o zimógeno de serina proteasa; y
(c) separar el SÍO2 de la composición para retirar la serina proteasa unida,
en el que la al menos una serina proteasa o zimógeno de serina proteasa es Factor Xla (FXIa), Factor XIla (FXIIa), Factor XI (FXI), o Factor XII (FXII);
en el que la primera etapa de enriquecimiento de proteína diana es una etapa de precipitación de proteína;
en el que la etapa de precipitación de proteína es una etapa de fraccionamiento de alcohol; y
en el que la proteína diana derivada de plasma se selecciona de una inmunoglobulina (Ig), albúmina, alfa-1 -antitripsina (A1PI), butirilcolinesterasa, una proteína del sistema del complemento, y un inhibidor inter-alfa-tripsina (lal).
2. El procedimiento de la reivindicación 1, en el que el procedimiento comprende además la etapa de realizar una segunda etapa de enriquecimiento de proteína diana antes de poner en contacto la composición enriquecida con dióxido de silicio (SÍO2) finamente dividido.
3. El procedimiento de la reivindicación 2, en el que la segunda etapa de enriquecimiento de proteína diana es:
(i) una etapa de precipitación de proteína;
(¡i) una etapa de ultrafiltración/diafiltración; o (iii) una etapa de enriquecimiento cromatográfico.
4. El procedimiento de la reivindicación 3, en el que la etapa de precipitación de proteína es una etapa de fraccionamiento de alcohol.
5. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 a 4, en el que el procedimiento comprende además la etapa de realizar una tercera etapa de enriquecimiento de proteína diana después de poner en contacto la composición con dióxido de silicio (SÍO2) finamente dividido.
6. El procedimiento de la reivindicación 5, en el que la tercera etapa de enriquecimiento de proteína diana es:
(i) una etapa de precipitación de proteína;
(ii) una etapa de ultrafiltración/diafiltración; o
(iii) una etapa de enriquecimiento cromatográfico.
7. El procedimiento de la reivindicación 6, en el que la etapa de precipitación de proteína es una etapa de fraccionamiento de alcohol.
8. El procedimiento de la reivindicación 3 o 6, en el que la etapa de enriquecimiento cromatográfico comprende las subetapas de:
(i) poner en contacto la composición de proteína diana derivada de plasma con una resina cromatográfica bajo condiciones adecuadas para unir la proteína diana derivada de plasma; y
(ii) eluir la proteína diana derivada de plasma de la resina cromatográfica.
9. El procedimiento de la reivindicación 3 o 6, en el que la etapa de enriquecimiento cromatográfico comprende las subetapas de:
(i) poner en contacto la primera composición de proteína diana derivada de plasma enriquecida con una resina cromatográfica bajo condiciones adecuadas para unir al menos una impureza; y
(ii) separar la resina de la composición de proteína derivada de plasma,
en el que la proteína diana derivada de plasma no se une a la resina cromatográfica en la subetapa (i).
1. El procedimiento de la reivindicación 8 o 9, en el que la resina cromatográfica se selecciona del grupo que consiste en una resina de intercambio aniónico, una resina de intercambio catiónico, una resina de interacción hidrófoba, una resina de modo mezclado, una resina de hidroxiapatita, una resina de afinidad por ligando, una resina de inmunoafinidad y una resina de exclusión por tamaño.
11. El procedimiento de la reivindicación 3 o 6, en el que la etapa de enriquecimiento cromatográfico comprende separar al menos una impureza de la proteína diana por tamaño y/o forma usando cromatografía de exclusión por tamaño.
12. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 a 11, en el que la proteína derivada de plasma es una proteína del sistema del complemento, y en el que la proteína del sistema del complemento se selecciona del grupo que consiste en Factor H (FH), Factor D, proteína del complemento C3, proteína de unión C4.
13. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 a 12, en el que la composición de proteína diana derivada de plasma es un intermedio de fabricación.
14. El procedimiento de acuerdo con una cualquiera de las reivindicaciones anteriores, en el que la composición se pone en contacto con SÍO2 a una concentración final de:
(i) al menos 1 g SiCVg proteína;
(ii) al menos 2 g SiCVg proteína; o
(iii) al menos 2,5 g Si2/g proteína.
15. El procedimiento de acuerdo con una cualquiera de las reivindicaciones anteriores, en el que la serina proteasa o zimógeno de serina proteasa es:
(i) Factor XI;
(ii) Factor XII;
(iii) Factor Xla; o
(iv) Factor XI la.
Patentes similares o relacionadas:
Formulaciones estabilizadas que contienen anticuerpos anti-receptor de interleucina 4 (IL-4R), del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Una jeringuilla precargada que contiene una formulación farmacéutica líquida estable, en la que la formulación farmacéutica líquida comprende: […]
Anticuerpos anti-PD-L1 y usos de los mismos, del 22 de Julio de 2020, de MERCK PATENT GMBH: Un anticuerpo anti-PD-L1 aislado o su fragmento de union a antigeno que comprende una secuencia de region variable de cadena pesada y de cadena ligera, en donde: […]
Composición para el tratamiento de enfermedades isquémicas o trastornos inflamatorios neurogénicos, que contienen el secretoma de células progenitoras neurales como ingrediente activo, del 22 de Julio de 2020, de S-BIOMEDICS: Una composición para uso en el tratamiento de enfermedad cerebrovascular isquémica, cardiopatía isquémica, infarto de miocardio, enfermedad de Alzheimer, enfermedad […]
Utilización de anticuerpos optimizados en ADCC para tratar a los pacientes con bajo nivel de respuesta, del 22 de Julio de 2020, de LABORATOIRE FRANCAIS DU FRACTIONNEMENT ET DES BIOTECHNOLOGIES: Utilización de una composición de anticuerpo monoclonal quimérico, humanizado o humano de isotipo IgG1 anti- Rhesus del glóbulo rojo humano cuya […]
Composiciones farmacéuticas que contienen una leucocidina E mutada, del 22 de Julio de 2020, de NEW YORK UNIVERSITY: Una composición que comprende: una proteína Leucocidina E (LukE) aislada que comprende la secuencia de aminoácidos de la SEQ ID NO: 4, o un polipéptido […]
Método para producir inmunoconjugados de anticuerpo-SN-38 con un enlazador CL2A, del 22 de Julio de 2020, de IMMUNOMEDICS, INC.: Un método para producir un compuesto, CL2A-SN-38, que presenta la estructura, **(Ver fórmula)** que comprende realizar un esquema de reacción como el que se muestra: **(Ver […]
Composición de anticuerpos monoclonales dirigidos contra BDCA-2, del 22 de Julio de 2020, de LABORATOIRE FRANCAIS DU FRACTIONNEMENT ET DES BIOTECHNOLOGIES: Composición de anticuerpos monoclonales dirigidos contra la proteína BDCA-2, presentando dichos anticuerpos un porcentaje de fucosilación inferior al 60% […]
Métodos de tratamiento y prevención de infecciones por staphylococcus aureus y afecciones asociadas, del 15 de Julio de 2020, de NEW YORK UNIVERSITY: Una composición para uso en un método de inmunización de un sujeto contra la infección por S. aureus, comprendiendo dicha composición: (i) un fragmento de polipéptido […]