Resolución enantiomérica de nucleósidos de 1,3-oxatiolano 2,4-disustituidos.
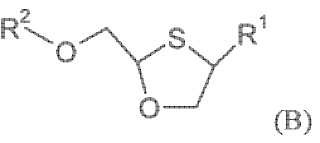
Un procedimiento para la preparación de enantiómeros únicos de un compuesto de fórmula (B),
en cualquiera delas configuraciones cis o trans , o una sal o éster farmacéuticamente aceptable del mismo, comprendiendo dichoprocedimiento:
en donde
R1 es base de pirimidina o un derivado farmacéuticamente aceptable de la misma;
R2 es hidrógeno, -C(O)-R3, o junto con el átomo de oxígeno al que está unido forma un éster derivado de unácido polifuncional; y
R3 es hidrógeno, alquilo de cadena lineal o ramificada, alcoxialquilo, aralquilo, ariloxialquilo, arilo,dihidropiridinilo sustituido, un éster de sulfonato, un éster de sulfato, un éster de aminoácido, ésteres demono, di- o tri-fosfatos; comprendiendo dicho procedimiento formar una sal conglomerado de mezclaracémica o una mezcla enriquecida enantioméricamente de un compuesto de fórmula (B) con un ácido, endonde la sal conglomerado resultante tiene las siguientes características:
el espectro IR de la sal del compuesto racémico, una mezcla 1:1 de cristales (-) y (+), es idéntico alde cada uno de los enantiómeros únicos, y la sal del compuesto racémico tiene un punto de fusiónmás bajo que el de cada enantiómero único; y
resolver dicha mezcla por cristalización.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IB2008/002314.
Solicitante: SHIRE CANADA INC.
Nacionalidad solicitante: Canadá.
Dirección: 2250 Alfred-Nobel Boulevard, Suite 500 Ville Saint-Laurent, QC H4S 2C9 CANADA.
Inventor/es: VIZITIU,DRAGOS, LACOSTE,JEAN-ERIC, SIMION,DAN.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07H19/06 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07H AZUCARES; SUS DERIVADOS; NUCLEOSIDOS; NUCLEOTIDOS; ACIDOS NUCLEICOS (derivados de ácidos aldónicos o sacáricos C07C, C07D; ácidos aldónicos, ácidos sacáricos C07C 59/105, C07C 59/285; cianohidrinas C07C 255/16; glicales C07D; compuestos de constitución indeterminada C07G; polisacáridos, sus derivados C08B; ADN o ARN concerniente a la ingeniería genética, vectores, p. ej. plásmidos o su aislamiento, preparación o purificación C12N 15/00; industria del azúcar C13). › C07H 19/00 Compuestos que contienen un heterociclo que comparten un heteroátomo del ciclo con un radical sacárido; Nucleósidos; Mononucleótidos; Sus anhidro-derivados. › Radicales de pirimidina.
PDF original: ES-2421708_T3.pdf
Fragmento de la descripción:
Resolución enantiomérica de nucleósidos de 1, 3-oxatiolano 2, 4-disustituidos
CAMPO DE LA INVENCIÓN
La presente invención se refiere a un nuevo procedimiento para producir isómeros (-) y (+) de nucleósidos cis o análogos y derivados de nucleósidos de fórmula (A) :
en donde R1 es una base de pirimidina o un derivado farmacéuticamente aceptable de la misma.
ANTECEDENTES DE LA INVENCIÓN
Se ha encontrado que clases de compuestos de fórmula (A) , particularmente los nucleósidos de pirimidina de 1, 3-oxatiolanos 2, 4-disustituidos y derivados de los mismos, tienen potente actividad antiviral. En particular, se ha encontrado que estos compuestos actúan como potentes inhibidores de la replicación del HIV-1 en linfocitos T durante un periodo de tiempo prolongado, con menos efectos secundarios citotóxicos que los compuestos conocidos en la técnica (véase Belleau et al (1993) Bioorg. Med. Chem. Lett. Vol. 3, No. 8, págs. 1723-1728) . Estos compuestos también se han encontrado activos contra cepas de HIV resistentes a 3TC (véase Taylor et al (2000) Antiviral Chem. Chemother. Vol 11, No. 4, págs. 291-301; Stoddart et al (2000) Antimicrob. Agents Chemother. Vol. 44, No. 3, págs. 783-786) . Adicionalmente, los compuestos de fórmula (A) son útiles también en la profilaxis y tratamiento de infecciones por virus de la hepatitis B.
Se han descrito métodos para la preparación de estos compuestos en las publicaciones PCT WO 92/08717, WO 95/29176 y WO 02/102796, así como en las publicaciones de Belleau et al (1993) Bioorg. Med. Chem. Lett. Vol. 3, No. 8, págs. 1723-1728; Wang et al (1994) Tetrahedron Lett. Vol. 35, No.27, págs. 4739-4742; Mansour et al, (1995)
J. of Med. Chem. Vol. 38, No. 1, págs. 1-4 y Caputo et al en Eur. J. Org. Chem. Vol. 6, págs. 1455-1458 (1999) .
Los productos de estos procedimientos son en muchos casos un racemato. Estos racematos requieren un procesamiento adicional para obtener los enantiómeros puros. Un método preferido para la producción de enantiómeros únicos es la resolución de un racemato, tal como por cristalización preferencial directa, cristalización de las sales diastereoméricas, resolución cinética, resolución enzimática, absorción selectiva y síntesis asimétrica. Véanse, p. ej., los documentos EP 0 515 156, EP 0 515 157, EP 0 560 794, EP 0 756 595, EP 0 757 684, EP 1 153 924, EP 1 361 227, EP 1 406 896, EP 1 473 294, EP 1 632 490, US 5.663.320, US 5.693.787, US 6.600.044, US 2006/0199786, WO 92/20669, WO 92/20696, y WO 2006/096954.
Por ejemplo, Cimpoia et al. (documento US 2006/0199786) describe un método para preparar cis-2-hidroximetil-4 (citosina-1'-il) -1, 3-oxatiolano ópticamente activo y derivados del mismo haciendo reaccionar un compuesto de cisoxatiolano con un ácido quiral para formar dos sales diastereoméricas, recuperar una de las sales diastereoméricas, y convertir la sal diastereomérica recuperada de nuevo en un enantiómero del compuesto base.
Si el racemato es un compuesto racémico "verdadero", una fase sólida homogénea de los dos enantiómeros coexiste en la misma unidad de celda. Estos materiales se pueden separar por medio de cristalización de diastereómeros, que generalmente implica hacer reaccionar el racemato con un ácido o base ópticamente puro (es decir, un agente de resolución) para formar una mezcla de sales diastereoméricas. Estas mezclas se pueden separar por cristalización preferencial. Sin embargo, algunos racematos pueden existir en la forma de conglomerados. En un conglomerado, los enantiómeros individuales cristalizan cada uno como una única red cristalina. Por tanto, una sal conglomerado es de hecho una mezcla física de dos tipos cristalinos independientes, uno de cada isómero. Pero, los conglomerados se observan típicamente en menos de 20% de todos los racematos. Véase, p. ej., Lorenz, H., et al., J. of the Univ. of Chem. Tech. and Metallurgy, (2007) , 42 (1) , 5-16 [5 a 10% de racematos pertenecen al grupo formador de conglomerados].
Un conglomerado se puede definir como una mezcla equimolar de dos enantiómeros cristalinos que son, en principio, separables mecánicamente. El diagrama de fases de un conglomerado muestra una temperatura mínima nítidamente definida en una mezcla de 50% y 50% que es el punto eutéctico de la mezcla enantiomérica. El éxito de una cristalización preferencial depende de este hecho.
Se describen métodos para resolver ciertos racematos por formación de sales conglomerado, también conocidos como cristalización preferencial o resolución por arrastre, en, por ejemplo, Tung et al. (documento US 4.994.604) , Manimaran et al. (documento US 5.302.751) y Coquerel et al. (documento US 6.022.409) .
Un compuesto conglomerado cristaliza como un único enantiómero en la red cristalina, es decir, cada red cristalina está constituida por un único enantiómero. Por lo tanto, para ser un conglomerado, el espectro IR de la sal conglomerado racémica, una mezcla 1:1 de cristales (-) y (+) , debe ser idéntico al del enantiómero único. Otra característica del comportamiento del conglomerado es que la sal conglomerado racémica tiene normalmente un punto de fusión más bajo que el de cada enantiómero único.
Si se obtiene un conglomerado, éste se puede usar para un aumento del exceso enantiomérico, debido a que la composición más soluble es racémica. Generalmente, si el conglomerado tiene un exceso de un enantiómero, ese exceso puede ser recuperado, es decir, el conglomerado de X% de exceso enantiomérico proporcionará un rendimiento de X% de enantiómero único, dejando atrás líquidos racémicos.
Un conglomerado en forma racémica también se puede usar en un procedimiento de arrastre en el que una disolución racémica es sembrada con un enantiómero único, conduciendo a la precipitación cinética preferencial de ese enantiómero. Véase, p. ej., Lorenz, H., et al., J. of the Univ. of Chem. Tech. and Metallurgy, (2007) , 42 (1) , 5-16.
Compendio de la invención Aunque los procedimientos como los descritos anteriormente ofrecen medios eficaces para obtener isómeros únicos del nucleósido cis o análogos y derivados de nucleósidos de fórmula (A) :
en donde R1 es una base de pirimidina o un derivado farmacéuticamente aceptable del mismo, hay una necesidad de un procedimiento más sencillo y más económico. La presente invención se basa en el descubrimiento de un procedimiento que permite que los enantiómeros sean separados directa y eficazmente por una técnica de cristalización directa usando sales conglomerado específicas.
El documento US 2006/199786 enseña la preparación de derivados de 3'-oxatiolano ópticamente activos, usando un 20 ácido aquiral.
El documento EP 1 153 924 describe la síntesis de enantiómeros únicos de 1, 3-oxatiolanos cis-sustituidos.
Así, según un aspecto del procedimiento de la presente invención, se proporciona un método para la preparación de enantiómeros únicos de compuestos de fórmula (B) en la configuración cis, y sales y ésteres farmacéuticamente aceptables de los mismos,
en donde R1 es base de pirimidina o un derivado farmacéuticamente aceptable de la misma,
R2 es hidrógeno, una función carboxilo -C (O) -R3, o junto con el átomo de oxígeno al que está unido, forma un derivado éster de un ácido polifuncional (tal como ácidos fosfóricos o ácidos carboxílicos que contienen más 30 de un grupo carboxilo, p. ej. ácidos dicarboxílicos de la fórmula HO2C (CH2) 1-10CO2H) ; y
R3 se selecciona de hidrógeno, alquilo de cadena lineal o ramificada (p. ej. metilo, etilo, n-propilo, t-butilo, n-butilo) o cíclico que tiene 1 a 30 átomos de carbono que es no sustituido o sustituido, alcoxialquilo (p. ej. metoximetilo) que tiene 2 a 30 átomos de carbono que es no sustituido o sustituido, aralquilo (p. ej. bencilo) que tiene 7 a 18 átomos de carbono que es no sustituido o sustituido, ariloxialquilo (p. ej. fenoximetilo) que tiene 7 a 18 átomos de carbono que es no sustituido o sustituido, arilo que tiene 6 a 14 átomos de carbono que es no sustituido o sustituido (p. ej. fenilo opcionalmente sustituido con halógeno, alquilo C1-4 o alcoxi C1-4) , dihidropiridinilo sustituido (p. ej. N-metildihidropiridinilo) , ésteres de sulfonatos tales como alquil-C1-6- o aralquil-C7-8-sulfonilo (p. ej. metanosulfonilo) , ésteres de sulfatos, ésteres de aminoácidos (p. ej. L-valilo o L-isoleucilo) y ésteres de mono-, di- o tri-fosfato,
comprendiendo el procedimiento:
formar una sal conglomerado de una mezcla racémica o una mezcla enriquecida enantioméricamente de un compuesto de fórmula (B) con un ácido, en donde la sal conglomerado resultante tiene las siguientes características:
... [Seguir leyendo]
Reivindicaciones:
1. Un procedimiento para la preparación de enantiómeros únicos de un compuesto de fórmula (B) , en cualquiera de las configuraciones cis o trans , o una sal o éster farmacéuticamente aceptable del mismo, comprendiendo dicho procedimiento:
en donde R1 es base de pirimidina o un derivado farmacéuticamente aceptable de la misma;
R2 es hidrógeno, -C (O) -R3, o junto con el átomo de oxígeno al que está unido forma un éster derivado de un ácido polifuncional; y
R3 es hidrógeno, alquilo de cadena lineal o ramificada, alcoxialquilo, aralquilo, ariloxialquilo, arilo, dihidropiridinilo sustituido, un éster de sulfonato, un éster de sulfato, un éster de aminoácido, ésteres de mono, di- o tri-fosfatos; comprendiendo dicho procedimiento formar una sal conglomerado de mezcla racémica o una mezcla enriquecida enantioméricamente de un compuesto de fórmula (B) con un ácido, en donde la sal conglomerado resultante tiene las siguientes características:
el espectro IR de la sal del compuesto racémico, una mezcla 1:1 de cristales (-) y (+) , es idéntico al de cada uno de los enantiómeros únicos, y la sal del compuesto racémico tiene un punto de fusión más bajo que el de cada enantiómero único; y
resolver dicha mezcla por cristalización.
2. Un procedimiento según la reivindicación 1, en el que el procedimiento de cristalización es cristalización preferencial, arrastre o arrastre cíclico.
3. Un procedimiento según la reivindicación 1 o 2, en el que R1 se selecciona de las siguientes fórmulas:
R4 y R5 son independientemente en cada caso H, alquilo C1-6 lineal, ramificado o cíclico, alquenilo C2-6 lineal, ramificado o cíclico, arilo C6-14, o anillo heteroaromático de 5-10 miembros que contiene 1-3 heteroátomos seleccionados de O, N, y S; y R6 es hidrógeno, hidroximetilo, trifluorometilo, alquilo C1-6 lineal, ramificado o cíclico, alquenilo C2-6 lineal, ramificado o cíclico, bromo, cloro, flúor o yodo.
4. Un procedimiento según una cualquiera de las reivindicaciones 1 a 3, en el que R3 es hidrógeno, alquilo de cadena lineal o ramificada, alcoxialquilo, aralquilo, ariloxialquilo, arilo, dihidropiridinilo sustituido, alquilsulfonilo, aralquilsulfonilo, un éster de sulfato, un éster de aminoácido, y ésteres de mono, di- o tri-fosfatos, y sales y ésteres farmacéuticamente aceptables de los mismos, preferiblemente en donde R3 es hidrógeno, metilo, etilo, n-propilo, t-butilo, n-butilo, metoximetilo, bencilo, fenoximetilo, fenilo, fenilo sustituido con halógeno, alquilo C1-4 o alcoxi C1-4, N-metildihidropiridinilo, metanosulfonilo, L-valilo o L-isoleucilo,
más preferiblemente, en el que R3 es metilo, etilo, n-propilo, t-butilo, n-butilo, metoximetilo, bencilo, fenoximetilo, fenilo, o fenilo sustituido con halógeno, alquilo C1-4 o alcoxi C1-4.
5. Un procedimiento según una cualquiera de las reivindicaciones 1 a 4, en el que R2 es un éster derivado de un ácido dicarboxílico de la fórmula HO2C (CH2) nCO2H, en donde n es un número entero de 1 a 10.
6. Un procedimiento según una cualquiera de las reivindicaciones 1 a 5, en el que se preparan enantiómeros únicos de fórmula (B) en la configuración trans o en donde se preparan enantiómeros únicos de fórmula (B) en la configuración cis.
7. Un procedimiento según una cualquiera de las reivindicaciones 1 a 6, en el que los enantiómeros únicos de la sal conglomerado muestran una solubilidad mucho más baja que el racemato de la sal conglomerado en disolventes polares.
8. Un procedimiento según una cualquiera de las reivindicaciones 1 a 7, en el que la separación de enantiómeros de
la mezcla enantiomérica se realiza sembrando una disolución sobresaturada de la sal conglomerado con el enantiómero único deseado.
9. Un procedimiento según una cualquiera de las reivindicaciones 1 a 8, en el que R1 es citosina o 5-fluorocitosina, preferiblemente en el que R1 es citosina, más preferiblemente en el que R1 es 5-fluorocitosina.
10. Un procedimiento según una cualquiera de las reivindicaciones 1 a 9, en el que dicho ácido es ácido clorhídrico,
ácido bromhídrico, ácido sulfúrico, ácido tetrafluorobórico, ácido metanosulfónico, ácido bencenosulfónico, ácido para-toluenosulfónico, ácido p-aminobencenosulfónico, ácido p-clorobencenosulfónico, ácido phidroxibencenosulfónico, ácido cloroacético, ácido dicloroacético, ácido tricloroacético, ácido glicólico, ácido pirúvico, ácido succínico, ácido adípico, ácido maleico, ácido fumárico, ácido cítrico, o una mezcla de los mismos, en el que dicho ácido es ácido para-toluenosulfónico, ácido maleico o una mezcla de los mismos.
11. Un procedimiento según la reivindicación 1, en el que la sal conglomerado formada es ci.
2. desoxi-3'-oxa-4'tiocitidina, preferiblemente en el que se forma una sal conglomerado de cis-2'-desoxi-3'-oxa-4'-tiocitidina en la que los enantiómeros únicos muestran una solubilidad más baja que el racemato en disolventes polares, más preferiblemente en el que dicha sal conglomerado de cis -2'-desoxi-3'-oxa-4'-tiocitidina es la sal de ácido paratoluenosulfónico d.
2. desoxi-3'-oxa-4'-tiocitidina que tiene un punto eutéctico entre aproximadamente 185ºC y
187ºC o en el que dicha sal conglomerado de ci.
2. desoxi-3'-oxa-4'-tiocitidina es la sal málica d.
2. desoxi-3'-oxa-4'tiocitidina que tiene un punto eutéctico entre aproximadamente 171ºC y 173ºC.
12. Un procedimiento según una cualquiera de las reivindicaciones 1 a 11, en el que el enantiómero único comprende, además, un segundo isómero de un compuesto de fórmula (B) en una cantidad igual a o menor que 1%.
13. Un procedimiento para resolver cis-2-hidroximetil-4- (citosin-1'-il) -1, 3-oxatiolano o derivados o sales del mismo, 25 que comprende:
a) hacer reaccionar dicho cis-2-hidroximetil-4- (citosin-1'-il) -1, 3-oxatiolano con un ácido aquiral para producir cis-2-hidroximetil-4- (citosin-1'-il) -1, 3-oxatiolano·sal de ácido aquiral;
b) preparar una disolución de cis-2-hidroximetil-4- (citosin-1'-il) -1, 3-oxatiolano·sal de ácido aquiral que tiene un exceso enantiomérico mayor que cero;
c) añadir a dicha disolución una cantidad de (+) o (-) -cis-2-hidroximetil-4- (citosin-1'-il) -1, 3-oxatiolano·sal de ácido aquiral suficiente para iniciar la cristalización;
d) recuperar sustancialmente una de dicha (+) o (-) -cis-2-hidroximetil-4- (citosin-1'-il) -1, 3-oxatiolano·sal de ácido aquiral; y
e) convertir dicha (+) -o (-) -cis-2-hidroximetil-4- (citosin-1'-il) -1, 3-oxatiolano·sal de ácido aquiral en dicho (+)
o (-) -cis-2-hidroximetil-4- (citosin-1'-il) -1, 3-oxatiolano o sales, preferiblemente en donde dicho ácido aquiral es ácido clorhídrico, ácido bromhídrico, ácido sulfúrico, ácido tetrafluorobórico, ácido metanosulfónico, ácido bencenosulfónico, ácido para-toluenosulfónico, ácido p-aminobencenosulfónico, ácido p-clorobencenosulfónico, ácido p-hidroxibencenosulfónico, ácido cloroacético, ácido dicloroacético, ácido tricloroacético, ácido glicólico, ácido pirúvico, ácido succínico, ácido adípico, ácido maleico, ácido fumárico,
ácido cítrico, o una mezcla de los mismos,
más preferiblemente en donde dicho ácido es ácido para-toluenosulfónico.
14. Una sal conglomerado de ci.
2. desoxi-3'-oxa-4'-tiocitidina que es la sal de ácido para-toluenosulfónico de .
2. desoxi-3'-oxa-4'-tiocitidina, que tiene un punto eutéctico entre aproximadamente 185ºC y 187ºC, o la sal maleica d.
2. desoxi-3'-oxa-4'-tiocitidina, que tiene un punto eutéctico entre aproximadamente 171ºC y 173ºC.
15. Un procedimiento para la preparación de un enantiómero único, preferiblemente la configuración cis, de un compuesto de fórmula (B) o una sal o éster farmacéuticamente aceptable del mismo, en el que el enantiómero comprende tosilato de metilo en una cantidad igual a o menor que 2 ppm, comprendiendo el procedimiento las etapas de:
(a) formar una sal conglomerado de una mezcla racémica o una mezcla enriquecida enantioméricamente de 50 un compuesto de fórmula (B) con un ácido tósico, preferiblemente ácido para-toluenosulfónico,
(b) obtener una mezcla enriquecida enantioméricamente de las sales de los enantiómeros por cristalización; y
(c) obtener la base libre de la mezcla enriquecida enantioméricamente, preferiblemente en donde el compuesto de fórmula (B) e.
2. desoxi-3'-oxa-4'-tiocitidina, y en donde el enantiómero comprende opcionalmente, además, un segundo isómero de un compuesto de fórmula (B) en una cantidad igual a o menor que 1%.
Patentes similares o relacionadas:
Derivados de 5-fluorouridina, del 1 de Julio de 2020, de B. BRAUN MELSUNGEN AG: Compuesto representado por la fórmula (I) **(Ver fórmula)** en donde X es un grupo de fórmula (III) **(Ver fórmula)** en donde R1 se selecciona entre H, **(Ver […]
Nucleótidos modificados para secuenciación de polinucleótidos, del 8 de Abril de 2020, de ILLUMINA CAMBRIDGE LIMITED: Una molécula de nucleótido que tiene una unidad estructural de azúcar ribosa o desoxirribosa y una base enlazada a un marcador detectable a través de […]
Nucleósidos sustituidos en 2',4' como agentes antivirales, del 25 de Marzo de 2020, de Gilead Pharmasset LLC: Un compuesto de la siguiente fórmula: **(Ver fórmula)** o una de sus sales farmacéuticamente aceptables, en donde: (a) R2 es F; (b) R es H, […]
Intermedios de D-ribonolactona con sustitución de 2-fluoro-2-alquilo, del 6 de Noviembre de 2019, de Gilead Pharmasset LLC: 2-desoxi-2-fluoro-2-C-metilo-D-ribono-g-lactona de la siguiente fórmula general (49B) y su L-isómero (49B-L): **Fórmula** en donde R3 y R5 pueden ser independientemente […]
Oligómeros polinucleotídicos de citosina modificados y métodos, del 23 de Octubre de 2019, de CEPHEID: Un oligómero polinucleotídico que comprende al menos una base modificada, en el que la al menos una base modificada se representa mediante la fórmula: **(Ver […]
Análogos de N-nucleósido de pirimidina 1-sustituidos para un tratamiento antiviral, del 12 de Junio de 2019, de GILEAD SCIENCES, INC.: Un Compuesto seleccionado de:**Fórmula** o una sal farmacéuticamente aceptable de los mismos.
Ruta sintética de 2-desoxi-2,2-difluorotetrahidrouridinas, del 16 de Mayo de 2019, de OTSUKA PHARMACEUTICAL CO., LTD.: Método de producción de compuesto 1:**Fórmula** o una sal del mismo, que comprende precipitar o cristalizar el compuesto 1 a partir de una solución de compuesto […]
Nucleósidos sustituidos, nucleótidos y sus análogos, del 25 de Abril de 2019, de Alios Biopharma, Inc: Un compuesto de Fórmula (I), o una de sus sales farmacéuticamente aceptable, para su uso en la mejora o el tratamiento de una infección vírica causada por un virus seleccionado […]