REACTIVOS Y UN METODO PARA EL MARCAJE POR SATURACION DE PROTEINAS.
Un conjunto concordante de colorantes fluorescentes que comprende al menos dos colorantes fluorescentes diferentes de fórmula (I):
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB2002/003142.
Solicitante: GE HEALTHCARE UK LIMITED.
Nacionalidad solicitante: Reino Unido.
Dirección: AMERSHAM PLACE,LITTLE CHALFONT BUCKINGHAMSHIR.
Inventor/es: WILLIAMS,K.,AMERSHAM BIOSCIENCES UK LTD, STONE,T.,AMERSHAM BIOSCIENCES UK LTD, SIMMONDS,A. C.,AMERSHAM BIOSCIENCES UK LTD, SWEET,A. C.,AMERSHAM BIOSCIENCES UK LTD, FOWLER,S. J.,AMERSHAM BIOSCIENCES UK LTD.
Fecha de Publicación: .
Fecha Concesión Europea: 10 de Marzo de 2010.
Clasificación Internacional de Patentes:
- C07K1/13 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 1/00 Procedimientos generales de preparación de péptidos. › Marcaje de péptidos.
- C09B23/02 C […] › C09 COLORANTES; PINTURAS; PULIMENTOS; RESINAS NATURALES; ADHESIVOS; COMPOSICIONES NO PREVISTAS EN OTRO LUGAR; APLICACIONES DE LOS MATERIALES NO PREVISTAS EN OTRO LUGAR. › C09B COLORANTES ORGANICOS O COMPUESTOS ESTRECHAMENTE RELACIONADOS PARA PRODUCIR COLORANTES; MORDIENTES; LACAS (procesos de fermentación o procesos que utilizan enzimas para la síntesis de un compuesto dado C12P). › C09B 23/00 Colorantes de metina o polimetina, p. ej. de tipo cianina. › que contiene un número impar de grupos CH.
- C09B67/00M1
Clasificación PCT:
- C07K1/13 C07K 1/00 […] › Marcaje de péptidos.
- C09B23/02 C09B 23/00 […] › que contiene un número impar de grupos CH.
- C09B67/22 C09B […] › C09B 67/00 Propiedades de las materias colorantes que influyen en el aspecto físico, p. ej. tinte o impresión, sin reacción química, p. ej. por tratamiento con solventes; Características de los procesos de fabricación de las preparaciones de materias colorantes; Preparaciones de materia colorante de una especial naturaleza física, p. ej. tabletas, películas. › Mezclas de pigmentos o colorantes diferentes, o de soluciones sólidas de pigmentos o colorantes.
- G01N33/68 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › en los que intervienen proteínas, péptidos o aminoácidos.
Clasificación antigua:
- C07K1/13 C07K 1/00 […] › Marcaje de péptidos.
- C09B23/02 C09B 23/00 […] › que contiene un número impar de grupos CH.
- C09B67/22 C09B 67/00 […] › Mezclas de pigmentos o colorantes diferentes, o de soluciones sólidas de pigmentos o colorantes.
- G01N33/68 G01N 33/00 […] › en los que intervienen proteínas, péptidos o aminoácidos.
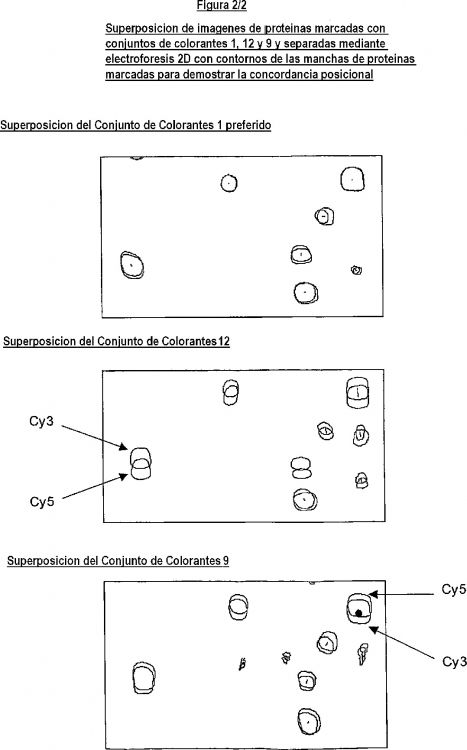
Fragmento de la descripción:
Reactivos y un método para el marcaje por saturación de proteínas.
La presente invención se refiere a colorantes fluorescentes y a un método para marcar muestras de proteínas complejas para permitir el análisis diferencial de proteínas.
La Electroforesis Diferencial en Gel 2D (bidimensional) (Difference Gel Electrophoresis: DIGE) usa colorantes fluorescentes concordantes, resueltos espectralmente, para marcar muestras de proteína antes de la separación electroforética bidimensional (2D) (Minden, J. et al, Electrophoresis, (1997), 18, 2071). Este método multiplexor fluorescente supera muchos de los inconvenientes de la electroforesis 2D tradicional. El premarcaje fluorescente de muestras de proteína permite que muestras múltiples sean analizadas sobre el mismo gel, lo que hace que se identifiquen fácilmente diferencias cuantitativas entre las muestras por superposición de las imágenes fluorescentes. Para permitir la multiplexación fluorescente, las muestras de proteína han de ser marcadas por igual con los colorantes, y la migración de las proteínas marcadas en el gel ha de ser concordante posicionalmente, para que sea posible detectar diferencias cuantitativas.
El documento WO 96/33406 (Minden, J. et al) describe un método para detectar diferencias entre distintas muestras de células usando colorantes concordantes, resueltos espectralmente, para marcar proteínas en las muestras antes de la electroforesis 2D. Se describen colorantes que son concordantes para el peso molecular y la carga para dar una migración equivalente. El método emplea colorantes de cianina que tienen un grupo reactivo éster de N-hidroxisucinimidilo (NHS) para marcar aminas. El grupo éster de NHS está diseccionado en el
La publicación de Ernst L. A. et al., Cyanine dye labeling reagents for sulphydryl groups cytometry, Alan Liss, Nueva York, EE.UU., vol. 10, nº 1, 1989, páginas 3-10, XP000071370 ISSN: 0196-4743, describe reactivos que comprenden colorantes fluorescentes de merocianina y cianina, para el marcaje covalente de proteínas y otras biomoléculas. Los colorantes se describen como poseedores de unas propiedades ventajosas para la citoquímica. Los colorantes usados en este artículo no son concordantes entre sí con respecto a la estructura molecular y a la carga.
Los restos de lisina son muy abundantes en las proteínas, asegurando que esta estrategia de marcaje representará a todas la proteínas presentes en una muestra compleja. Sin embargo, el contenido de lisina típico de una proteína es 7% y, si cada lisina de una proteína fuese marcada, esto tendría por resultado un gran desplazamiento de la masa debido al colorante. Así, la estrategia empleada es marcar "mínimamente" la proteína para asegurar que solamente son marcadas de aproximadamente 1 a 5 moléculas de proteína, dando así una probabilidad estadística de que cada molécula marcada tiene solamente un colorante unido. Esto crea un patrón de manchas en 2D que es muy similar a las imágenes teñidas con plata, pero que da una mayor sensibilidad y margen dinámico, y la facultad de multi- plexar.
Un análisis en gel en 2D típico implica "picar" manchas de la proteína de interés a partir del gel para su identificación por MALDI-MS (Matrix Assisted Laser Desorption/Ionization-Mass Spectrometry). El método de marcaje mínimo tiene por resultado 2 manchas por proteína (es decir, marcada y no marcada), con la mayor parte de la proteína en la mancha no marcada. La mancha no marcada ha de estar situada para recuperar proteína suficiente para permitir la identificación por MALDI-MS. Esto requiere una etapa de tinción adicional antes de picar la mancha. Con el fin de facilitar el picado de la mancha de proteína directamente a partir de geles fluorescentes, se requiere una estrategia de marcaje que dé una sola mancha por proteína.
La estrategia de marcaje empleada en la presente invención procura saturar la proteína con colorante con el fin de marcar el mayor número posible de restos diana y producir una sola mancha marcada por isoforma de proteína. Así, una molécula de colorante de cianina es acoplada a todos los restos diana de aminoácido disponible en una proteína, dando así una población única de moléculas de proteína marcadas, con un número similar de moléculas de colorante unidas. De acuerdo con la presente invención, el marcaje de saturación se consigue usando conjuntos de colorantes direccionados en los restos de cisteína, que contienen un grupo tiol. Los restos de cisteína están presentes en el 95% de la proteínas, pero en cada proteína hay menos restos de cisteína que de lisina. Esto quiere decir que pueden ser marcadas todas las moléculas de proteína, pero cada molécula de proteína tendrá menos restos marcados que si los restos de lisina fuesen marcados a saturación. Esto tiene por resultado el aumento de la sensibilidad de detección ya que la proporción de proteína marcada es más alta que con el marcaje mínimo, pero asegura que las proteínas siguen siendo solubles.
El aumento de la masa debido a la adición de colorante (el desplazamiento de masa) con el marcaje de saturación de los restos de cisteína será mayor que el aumento empleando una estrategia de marcaje mínimo de los restos de lisina. Sin embargo, el aumento de la masa es menor que el que se observaría si se emplease un método de marcaje de saturación sobre restos de lisina. La cuantía del desplazamiento de masa debido a la adición de colorante variará para cada proteína dependiendo del contenido de cisteína en la proteína individual (típicamente aproximadamente 2%) y la disponibilidad de los restos de cisteína para el colorante bajo las condiciones de marcaje. Esto tiene por resultado un patrón 2D de manchas que es muy diferente de los mapas de proteína 2D teñidos con plata publicados.
La presente invención por consiguiente proporciona reactivos fluorescentes y un método para el marcaje reproducible de todos los restos de cisteína disponibles que son accesibles en una mezcla de proteínas que contienen cisteína. Los derivados de colorante de cianina de acuerdo con la presente invención proporcionan valiosos conjuntos de marcadores fluorescentes, cada uno de los cuales tiene una estructura de núcleo común, y que son particularmente útiles para análisis multiplexión.
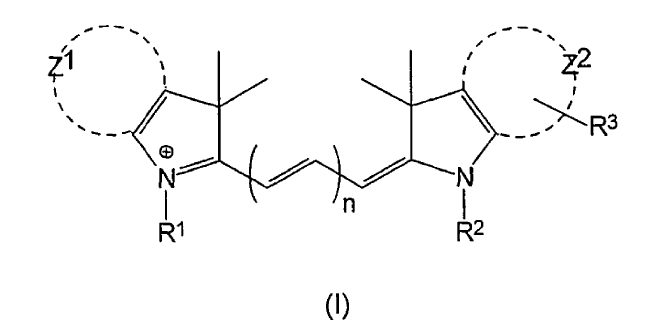
En consecuencia, en un primer aspecto, la presente invención proporciona un conjunto concordante de colorantes fluorescentes que comprende al menos dos colorantes fluorescentes diferentes que tienen la fórmula (I):
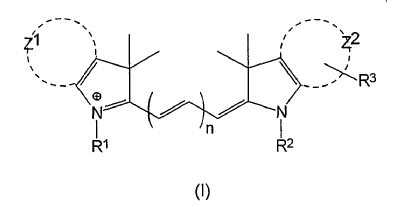
en la que n es diferente para cada uno de dichos colorantes y es 1, 2 ó 3;
Z1 y Z2 representan independientemente los átomos de carbono necesarios para completar un sistema de anillo fenilo o naftilo;
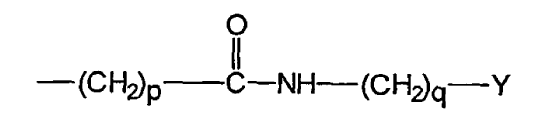
uno de los grupos R1 y R2 es el grupo:

en el que Y es un grupo de unión diana;
el grupo restante R1...
Reivindicaciones:
1. Un conjunto concordante de colorantes fluorescentes que comprende al menos dos colorantes fluorescentes diferentes de fórmula (I):
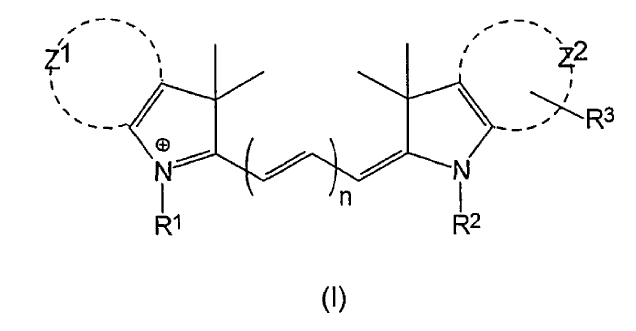
en la que n es diferente para cada uno de dichos colorantes y es 1, 2 ó 3;
Z1 y Z2 representan independientemente los átomos de carbono necesarios para completar un sistema de anillo fenilo o naftilo;
uno de los grupos R1 y R2 es el grupo:
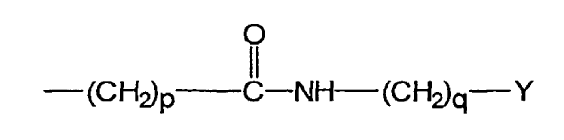
en el que Y es un grupo de unión diana;
el grupo restante R1 o R2 se elige entre los grupos
el grupo R3 es hidrógeno, excepto cuando o bien R1 o bien R2 es
p es un número entero de 3 a 6;
q se elige para que sea 2 ó 3; y
r es un número entero de 1 a 5;
y sus sales;
caracterizado porque cuando n de dos de dichos colorantes difiere en +1, uno de los números p, q y r de dichos dos colorantes difiere en
2. Un conjunto concordante de colorantes fluorescentes de acuerdo con la reivindicación 1ª, que comprende al menos dos diferentes colorantes fluorescentes de fórmula (II):
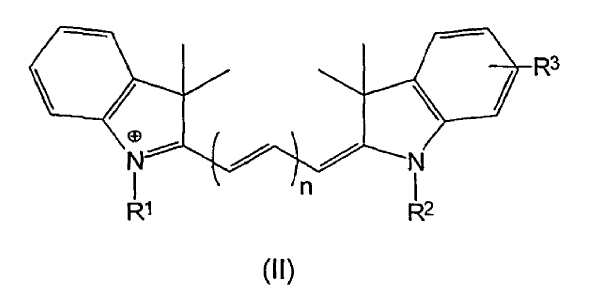
en la que n es diferente para cada uno de dichos colorantes y es 1, 2 ó 3;
uno de los grupos R1 y R2 es el grupo:
en el que Y es un grupo de unión diana;
el grupo restante R1 o R2 se elige entre
el grupo R3 es hidrógeno, excepto cuando o bien R1 o bien R2 es
p es un número entero entre 3 y 6;
q se elige para que sea 2 ó 3;
y r es un número entero de 1 a 5;
y sus sales;
caracterizado porque cuando n de dos de dichos colorantes difiere en +1, uno de los números p, q y r de dichos dos colorantes difiere en
3. Un conjunto concordante según las reivindicaciones 1ª o 2ª, que comprende al menos dos colorantes fluorescentes diferentes de acuerdo con la fórmula (I) o (II) en la cual:
n se elige para que sea 1 ó 2;
p se elige para que sea 4 ó 5;
q se elige para que sea 2 ó 3; y
r se elige para que sea 1, 2 ó 3.
4. Un conjunto concordante según cualquiera de las reivindicaciones 1ª a 3ª, en el que dicho grupo de unión diana Y en cada colorante del conjunto de colorantes es el mismo, y se elige entre un grupo maleimido y un grupo yodoacetamido.
5. Un conjunto concordante según la reivindicación 4ª, en el que dicho colorante Y es un grupo maleimido.
6. Un conjunto concordante según cualquiera de las reivindicaciones 1ª a 5ª, en el que dichas sales se eligen entre K+, Na+, NH4+, R3NH+ y R4N+ en donde R es alquilo C1 a C4.
7. Un conjunto concordante según cualquiera de las reivindicaciones 1ª a 6ª, elegidos entre:
Conjunto 1
1-(6-{[2-(2,5-dioxo-2,5-dihidro-1H-pirrol-1-il)etil]amino}-6-oxohexil)-2-[(1E,3E)-3-(1-etil-3,3-dimetil-5-sulfo-1,3-dihidro-2H-indol-2-iliden)-prop-1-enil]-3,3-dimetil-3H-indolio (Compuesto I); y
1-(6-{[2-(2,5-dioxo-2,5-dihidro-1H-pirrol-1-il)etil]amino}-6-oxohexil)-3,3-dimetil-2-[(1E,3E,5E)-5-(1,3,3-trimetil-5-sulfo-1,3-dihidro-2H-indol-2-iliden)penta-1,3-dienil]-3H-indolio (Compuesto II);
Conjunto 2
1-(6-{[2-(2,5-dioxo-2,5-dihidro-1H-pirrol-1-il)etil]amino}-6-oxohexil)-2-[(1E,3E)-3-(1-propil-3,3-dimetil-5-sulfo-1,3-dihidro-2H-indol-2-iliden)prop-1-enil]-3,3-dimetil-3H-indolio (Compuesto III); y
1-(6-{[2-(2,5-dioxo-2,5-dihidro-1H-pirrol-1-il)etil]amino}-6-oxohexil)-3,3-dimetil-2-[(1E,3E,5E)-5-(1-etil-3,3-trimetil-5-sulfo-1,3-dihidro-2H-indol-2-iliden)penta-1,3-dienil]-3H-indolio (Compuesto IV);
Conjunto 3
1-(6-{[2-(2,5-dioxo-2,5-dihidro-1H-pirrol-1-il)etil]amino}-6-oxohexil)-2-[(1E,3E)-3-(1-etil-3,3-dimetil-5-sulfo-1,3-dihidro-2H-indol-2-iliden)prop-1-enil]-3,3-dimetil-3H-indolio (Compuesto I); y
1-(5-{[2-(2,5-dioxo-2,5-dihidro-1H-pirrol-1-il)etil]amino}-6-oxopentil)-3,3-dimetil-2-[(1E,3E,5E)-5-(1-etil-3,3-trimetil-5-sulfo-1,3-dihidro-2H-indol-2-iliden)penta-1,3-dienil]-3H-indolio (Compuesto V);
Conjunto 4
1-(6-{[2-(2,5-dioxo-2,5-dihidro-1H-pirrol-1-il)etil]amino}-6-oxohexil)-2-[(1E,3E)-3-(3,3-dimetil(1-sulfo-butil)-1,3-dihidro-2H-indol-2-iliden)prop-1-enil]-3,3-dimetil-3H-indolio (Compuesto VI); y
1-(5-{[2-(2,5-dioxo-2,5-dihidro-1H-pirrol-1-il)etil]amino}-6-oxopentil)-3,3-dimetil-2-[(1E,3E,5E)-5-(3,3-dimetil-(1-sulfo-butil)-1,3-dihidro-2H-indol-2-iliden)penta-1,3-dienil]-3H-indolio (Compuesto VII).
Conjunto 5
1-(6-{[3-(2,5-dioxo-2,5-dihidro-1H-pirrol-1-il)propil]amino}-6-oxohexil)-2-[(1E,3E)-3-(1-etil-3,3-dimetil-5-sulfo-1,3-dihidro-2H-indol-2-iliden)prop-1-enil]-3,3-dimetil-3H-indolio (Compuesto VIII); y
1-(6-{[2-(2,5-dioxo-2,5-dihidro-1H-pirrol-1-il)etil]amino}-6-oxohexil)-3,3-dimetil-2-[(1E,3E,5E)-5-(1-etil-3,3-trimetil-5-sulfo-1,3-dihidro-2H-indol-2-iliden)penta-1,3-dienil]-3H-indolio (Compuesto IV); y
Conjunto 6
1-(6-{[3-(2,5-dioxo-2,5-dihidro-1H-pirrol-1-il)propil]amino}-6-oxohexil)-2-[(1E,3E)-3-(3,3-dimetil(1-sulfo-butil)-1,3-dihidro-2H-indol-2-iliden)-prop-1-enil]-3,3-dimetil-3H-indolio (Compuesto IX); y
1-(6-{[2-(2,5-dioxo-2,5-dihidro-1H-pirrol-1-il)etil]amino}-6-oxohexil)-3,3-dimetil-2-[(1E,3E,5E)-5-(3,3-dimetil-(1-sulfo-butil)-1,3-dihidro-2H-indol-2-iliden)penta-1,3-dienil]-3H-indolio (Compuesto X).
8. Un método para marcar una mezcla de proteínas de una muestra en la que cada una de dichas proteínas contiene uno o más restos de cisteína, comprendiendo dicho método:
i) añadir a un líquido acuoso que contiene dicha muestra un colorante fluorescente elegido entre un conjunto concordante de colorantes fluorescentes según las reivindicaciones 1ª o 2ª, en donde dicho colorante contiene un grupo de unión diana que es reactivo de forma covalente con dichos uno o más restos de cisteína de dichas proteínas; y
ii) hacer reaccionar dicho colorante con dichas proteínas de forma que dicho colorante marque dichas proteínas;
con lo que todos los restos de cisteína disponibles en dichas proteínas son marcados con dicho colorante.
9. Un método según la reivindicación 8ª, en el que dicho grupo de unión diana se elige entre un grupo maleimido y un grupo yodoacetamido.
10. Un método según la reivindicación 8ª, que comprende además, antes de la etapa i), la etapa de tratar la proteína con un reductor.
11. Un método según la reivindicación 8ª, en el que dicho colorante se usa en un intervalo de 5 a 200 nmoles de colorante por 50 µg de proteína.
12. Un método según la reivindicación 8ª, en el que dicho marcaje se lleva a cabo a un pH en el intervalo de 6,0 a 9,0.
13. Un método para marcar una o más proteínas de una muestra, comprendiendo el método:
i) añadir a una muestra líquida que contiene dichas una o más proteínas un colorante fluorescente elegido entre un conjunto concordante de colorantes fluorescentes, teniendo cada colorante de dicho conjunto la fórmula (I):

en la que n es diferente para cada colorante y es 1, 2 ó 3;
Z1 y Z2 representan independientemente los átomos de carbono necesarios para completar un sistema de anillo fenilo o naftilo;
uno de los grupos R1 y R2 es el grupo:
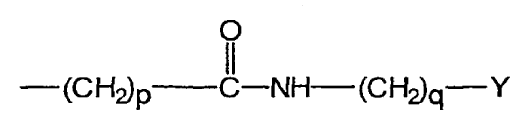
en el que Y es un grupo de unión diana;
el grupo restante R1 o R2 se elige entre los grupos
el grupo R3 es hidrógeno, excepto cuando o bien R1 o bien R2 es
p es un número entero de 3 a 6;
q se elige para que sea 2 ó 3; y
r es un número entero de 1 a 5;
y sus sales;
caracterizado porque cuando n de dos de dichos colorantes difiere en +1, uno de los números p, q y r de dichos dos colorantes difiere en
ii) incubar dicho colorante con dicha muestra bajo condiciones adecuadas para marcar dichas una o más proteínas.
14. Un método según la reivindicación 13ª, en el que cada uno de los grupos Z1 y Z2 representa los átomos de carbono necesarios para completar un sistema de anillo de fenilo.
15. Un método según la reivindicación 13ª o la reivindicación 14ª, en el que
n se elige para que sea 1 ó 2;
p se elige para que sea 4 ó 5;
q se elige para que sea 2 ó 3; y
r se elige para que sea 1, 2 ó 3.
16. Un método según cualquiera de las reivindicaciones 13ª a 15ª, en el que el grupo de unión Y se elige entre un grupo maleimido y un grupo yodoacetamido.
17. Un kit que comprende un conjunto concordante de colorantes fluorescentes que comprende al menos dos colorantes fluorescentes diferentes que tiene la fórmula (I):
en la que n es diferente para cada uno de dichos colorantes y es 1, 2 ó 3;
Z1 y Z2 representan independientemente los átomos de carbono necesarios para completar un sistema de anillo fenilo o naftilo;
uno de los grupos R1 y R2 es el grupo:

en el que Y es un grupo de unión diana;
el grupo restante R1 o R2 se elige entre los grupos
el grupo R3 es hidrógeno, excepto cuando o bien R1 o bien R2 es
p es un número entero de 3 a 6;
q se elige para que sea 2 ó 3; y
r es un número entero de 1 a 5;
y sus sales;
caracterizado porque cuando n de dos de dichos colorantes difiere en +1, uno de los números p, q y r de dichos dos colorantes difiere en
Patentes similares o relacionadas:
Método de radiomarcaje, del 2 de Octubre de 2019, de GE HEALTHCARE LIMITED: Un método de preparación de una composición liofilizada de molécula de direccionamiento biológico funcionalizada con aminooxi que comprende: (i) purificación cromatográfica […]
Modificaciones de proteínas quimioenzimáticas específicas para lisina utilizando transglutaminasa microbiana, del 21 de Agosto de 2019, de NOVARTIS AG: Un método para modificar una proteína, que comprende: proporcionar una proteína diana que tiene al menos un residuo de lisina; poner […]
Método de purificación y composiciones, del 7 de Agosto de 2019, de GE HEALTHCARE LIMITED: Un método de purificación de un radiotrazador que comprende las siguientes etapas: (a) proporcionar un radiotrazador que comprende un resto de reconocimiento biológico […]
Nuevos compuestos sulfonados reactivos con nucleófilos para el (radio)marcado de (bio)moléculas; precursores y conjugados de los mismos, del 10 de Julio de 2019, de Advanced Accelerator Applications: Un compuesto de fórmula (I) o una sal farmacéuticamente aceptable del mismo:**Fórmula** en la que • el grupo bifuncional R0 es un espaciador elegido entre […]
Compuestos de 3-arilpropiolonitrilo para marcar con tiol, del 9 de Mayo de 2019, de UNIVERSITE DE STRASBOURG: Procedimiento para la preparación de un compuesto marcado que comprende un resto tiol, que comprende poner en contacto un compuesto que comprende […]
Método de radioconjugación, del 30 de Mayo de 2018, de GE HEALTHCARE UK LIMITED: Un método de radiomarcaje de una molécula directora biológica que comprende: (i) la provisión de un compuesto protegido de fórmula (IA) [BTM]-X1 (IA) (ii) la desprotección […]
Derivados de compuestos a base de sultonas sustituidos por nucleófilos, en particular radionúclidos, y su uso para el marcado de macromoléculas, del 18 de Abril de 2018, de Advanced Accelerator Applications: Uso de un compuesto para el marcado de macromoléculas con un radionúclido nucleofílico, caracterizado por que dicho compuesto es de fórmula general 1 o 2: **Fórmula** […]
Reactivos con funcionalidad tiol y sus usos, del 4 de Abril de 2018, de Glythera Limited: Un método para modificar un polipéptido que al menos tiene un grupo tiol reactivo, método que comprende poner en contacto el polipéptido con un reactivo […]