PROTEÍNA RECOMBINANTE DEL RECEPTOR DE LA FERRI-PISCIBACTINA Y SU APLICACIÓN PARA LA PRODUCCIÓN DE UNA COMPOSICIÓN INMUNOGÉNICA FRENTE A LA PASTEURELOSIS.
Proteína recombinante del receptor de la ferri-piscibactina y su aplicación para la producción de una composición inmunogénica frente a la pasteurelosis.
La invención describe el uso de la proteína recombinante rFrpA como antígeno capaz de servir como vacuna eficaz frente a Ptiotobacterium damselae subespecie piscicida, agente causal de la pasteurelosis en peces. La vacuna es capaz de inducir una potente respuesta inmunitaria y confiere una elevada protección frente a la patología, cuando es suministrada vía parenteral.
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P201531020.
Solicitante: UNIVERSIDADE DE SANTIAGO DE COMPOSTELA.
Nacionalidad solicitante: España.
Inventor/es: RODRIGUEZ GONZALEZ,JAIME, JIMENEZ GONZALEZ,CARLOS, LEMOS RAMOS,Manuel Luis, BALADO DACOSTA,Miguel, VILA SANJURJO,Antón, VALDERRAMA PEREIRA,Andrea Katherine.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K39/102 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Pasteurella; Haemophilus.
- C07K14/285 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › de Pasteurellaceae (F), p. ej. Haemophilus influenza.
- C12N15/31 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Genes que codifican proteínas microbianas, p. ej. enterotoxinas.
Fragmento de la descripción:
Proteína recombinante del receptor de la ferri-piscibactina y su aplicación para la producción de una composición inmunogénica frente a la pasteurelosis
SECTOR TECNICO DE LA INVENCION
La presente invención se encuentra dentro de la biología y de la biología molecular, y se refiere a la elaboración de composiciones inmunogénicas que comprenden la proteína del receptor de la ferri- piscibactina (FrpA) de Photobacterium damselae subsp. piscicida para el desarrollo de una vacuna frente a la pasteurelosis que afecta a especies de peces de interés comercial de la industria acuícola.
ESTADO DE LA TÉCNICA
Photobacterium damselae subsp. piscicida (PhDP) es una bacteria gram-negativa conocida previamente como Pasteurella piscicida. PhDP es el agente causal de la pasteurelosis, fotobacteriosis o pseudotuberculosis, una enfermedad devastadora en la acuicultura marina que provoca elevadas mortalidades, posee un amplio rango de hospedadores, afectando a más de 20 especies de peces de interés acuícola, y tiene una amplia distribución global (Romalde, 2002., Int. Microbio!. 5 (1): 3-9; Thyssen et al., 1998. Int. J. Syst. Bacterio!. 48: 1145-1151; Toranzo et al., 2005. Aquaculture. 246 (1-4): 37-61; Barnes et al. 2005., Dev. Biol. (Basei)A2V. 75-84).
PhDP es un patógeno facultativo intracelular capaz de promover su internalización en las células del hospedador (Acosta et al. 2009., J. Fish Dis. 32(6): 535-541). El hecho de que PhDP sea un parásito intracelular capaz de resistir a la fagocitosis hace que sea un patógeno difícil de detectar por el sistema inmune del hospedador a la vez que dificulta los tratamientos quimioterápicos (Do Vale et al., 2005. Mol.
Microbio!. 58(4): 1025-1038).
La pasteurelosis puede cursar de forma aguda, provocando grandes mortalidades, o de modo crónico asintomático. Las infecciones asintomáticas afectan tanto a peces cultivados como a animales salvajes, siendo las poblaciones naturales de peces y moluscos el reservorio natural del patógeno (Serraca et al., 2011. Can. J. Microbio!. 57(5): 437-40). Los peces enfermos suelen perder peso, presentar un oscurecimiento de la piel, necrosis en las branquias y en las visceras suelen apreciarse granulomas blancos. Los brotes de pasteurelosis se producen en los meses de primavera y verano y se asocian a condiciones de estrés de los peces y a la baja calidad del agua: temperatura alta (> 18°C) y baja salinidad (Magariños et ai., 1996. Annu. Rev. Fish Dis. 6(0): 41-64). La enfermedad aparece mayoritariamente durante el estado larvario, provocando mortalidades de hasta el 90%, pero también afecta a peces juveniles en los que ocasiona pérdidas del 50%. Tras los brotes agudos, los animales aslntomáticos se convierten en portadores y pueden desarrollar la enfermedad cuando las condiciones ambientales vuelven a ser favorables para el patógeno. Además, se ha detectado la presencia de PhDP en fluidos ováricos y huevos provenientes de reproductores sanos, lo que indica una probable transmisión vertical (Romalde et al., 1999. J. Microbio!. Methods. 38 (1-2): 147-154) Todo ello hace que los brotes de pasteurelosis sean un problema recurrente en las plantas de acuicultura debido a su difícil erradicación y control.
Inicialmente, los brotes de pasteurelosis aparecieron mayoritariamente en Japón; sin embargo, en la década de 1990 empezaron a detectarse los primeros brotes en Europa. Aunque las cepas de PhDP muestran características bioquímicas y serológicas muy homogéneas, se sabe que pueden agruparse en dos líneas clónales: una formada por los aislados de origen japonés y la otra formada por los aislados de origen europeo y americano (Magariños et al., 2000. Epidemiol. Infect. 125 (1): 213-219). Las bacterias patógenas tienen una serie de herramientas, denominadas factores de virulencia, que les permiten colonizar y persistir dentro de un hospedador. Los principales factores de virulencia descritos en PhDP son la presencia de una cápsula de polisacáridos y actividades enzimáticas como proteasas, fosfolipasas, lipasas y hemolisinas (Thyssen et al., 2000. Int. J. Syst. Evol. Microbio!. 50 (3): 1013-1019; Magariños et al., 1996. Microb. Pathog. 21 (4): 289-297). De todos los factores de virulencia descritos en esta bacteria los más importantes son la producción de la toxina apoptótica AIP56, que le permite resistir la fagocitosis, y la producción y utilización de piscibactina, un potente sideróforo que le permite captar hierro del hospedador (Souto et al., 2012. Eur. J. Org. Chem. 29: 5693-5700; Osorio et al., 2006. Microbiology. 152 (11): 3327-3341). El sistema de la piscibactina está codificado en el plásmido pPHDP70 cuya presencia es una característica común a todos los aislados europeos y además se sabe que constituye un factor de virulencia clave (Osorio et al., 2015. Appl. Environ. Microbio!. Jun19, 19. pii: AEM.01580-15). Dentro de este plásmido el gen más importante a la hora de captar la piscibactina es frpA, ya que codifica el receptor de membrana externa FrpA que permite la internalización del complejo hierro-piscibactina.
La primera estrategia utilizada para combatir la enfermedad se basó en el uso de antibióticos, pero la aparición de cepas resistentes y multiresistentes provocó que esta estrategia fuese rápidamente
ineficiente. Además, la persistencia de estas sustancias en el pez y el impacto que provocan al medloamblente hace que su utilización sea cada vez más restrictiva. En las últimas décadas los esfuerzos para controlar la enfermedad se han centrado en el desarrollo de vacunas efectivas. Son numerosas las vacunas desarrolladas frente a PhDP y entre ellas podemos encontrar de diversos tipos y formulaciones. Sin embargo, los niveles de protección en el pez no suelen ser satisfactorios. Las vacunas convencionales, llamadas bacterinas, están compuestas por cultivos de la bacteria inactivados por calor, formol u otros métodos. Además este tipo de vacunas pueden ser enriquecidas con antígenos solubles como lipopolisacándos (LPS), proteínas de membrana externa (OMP), componentes de la cápsula (CPS) o productos extracelulares (ECPs). De las numerosas vacunas disponibles la ICTHIOVAC-PD (vacuna D121) comercializada por Hipra (España), es la que ha mostrado mayores grados de protección (protección en lubina > 60%) (Magariños et al., 1994. Bull. Eur. Assoc. Fish Pathol. 14 (4): 120-122). Se trata de una bacterina enriquecida con ECPs que se viene utilizando desde mediados de los años noventa.
El desarrollo de las técnicas de biología molecular ha permitido utilizar nuevas estrategias para la formulación de vacunas. En los últimos años se han publicado trabajos en los que se opta por la utilización como antígeno de proteínas recombinantes purificadas a partir de cultivos de E. coli que, formuladas junto a otros componentes como sustancias adyuvantes o nano y microsistemas de vectorización, están obteniendo resultados prometedores, postulándose como candidatos potenciales para desarrollar nuevas vacunas para distintas especies de peces (Andreoni et al., 2013. Vaccine. 31 (5): 820-826; Ho L-P et al., 2011. Fish Shellfish Immunol. 30 (1): 412-419; Ho L-P et al., 2014. J. Fish Dis. 37 (1): 51-56; Zhao et al. 2014. Vaccine 32: 327-337).
DESCRIPCIÓN DE LA INVENCIÓN
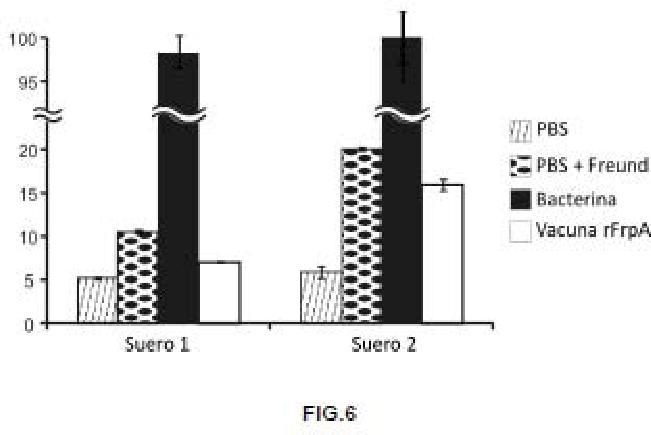
La estrategia basada en el uso de antibióticos a gran escala para el tratamiento de la pasteurelosis ha dado lugar a la aparición de cepas resistentes y multiresistentes que han hecho que su uso sea ineficiente. Además, la persistencia de los quimioterápicos en el pez y el impacto que provocan al medioambiente hace que su utilización sea cada vez más restrictiva. El desarrollo de la biología molecular ha permitido, en los últimos años, la formulación de vacunas basadas en el uso de proteínas recombinantes en el papel de antígeno. En la presente invención se describe por primera vez el uso de la proteína recombinante rFrpA de PhDP para el control de la pasteurelosis en peces.
Dado que las proteínas más ¡nmunogénicas son las que forman parte de su superficie celular (Scarselli et al., 2005. Trends Biotechnol. 23(2): 84-91), creemos que la utilización del receptor de membrana externa FrpA, necesario para la internalización de piscibactina, actuará como un antígeno eficaz capaz de activar el sistema inmune específico del pez. Para ello, en la presente invención se ha clonado el gen frpA de PhDP en E. coli permitiendo la producción y purificación de la proteína recombinante FrpA (rFrpA). La presente invención muestra la formulación de un preparado inmunogénico a base de rFrpA y un adyuvante oleoso como el de Freund para obtener una vacuna frente a la pasteurelosis. La optimización de un protocolo de vacunación y los experimentos de infección experimental en lenguado (Solea senegalensis...
Reivindicaciones:
1. Molécula aislada de ácidos nucleicos, caracterizada por una secuencia nucleotídica SEC ID NO:1
o con, al menos, un 70% de identidad con SEQ ID NO:1, que comprende la secuencia de nucleótidos que codifica la proteína FrpA de Photobacterium damselae subsp. piscicida caracterizada por SEQ ID NO:2, o un polipéptido con, al menos, un 80% de identidad con SEQ ID NO:2 que mantiene las propiedades antigénicas de FrpA o un fragmento inmunogénico que mantiene las propiedades antigénicas de FrpA.
2. Molécula aminoacídica aislada que comprende la secuencia aminoacídica de FrpA de
Photobacterium damselae subsp. piscicida, caracterizada por la SEC ID NO:2, o la proteína recombinante rFrpA, o una secuencia con, al menos, un 80% de identidad con SEQ ID NO:2 que mantiene las propiedades antigénicas de FrpA o un fragmento inmunogénico que mantiene las propiedades antigénicas de FrpA.
3. Vector recombinante caracterizado porque comprende la secuencia de nucleótidos según la
reivindicación 1.
4. Célula o microorganismo que comprende un vector recombinante según reivindicación 3.
5. Organismo transgénico no humano que comprende, insertado en su genoma, una secuencia
nucleotídica según reivindicación 1 o un vector según reivindicación 3.
6. Composición inmunogénica caracterizada porque comprende un elemento seleccionado de la
lista que consiste en:
a. Molécula aislada de ácidos nucleicos según reivindicación 1
b. Molécula aminoacídica aislada según reivindicación 2;
c. Vector recombinante según reivindicación 3 ;
d. Célula o microorganismo hospedador según reivindicación 4;
e. Organismo transgénico no humano según reivindicación 5;
o cualquiera de sus combinaciones y un vehículo farmacéuticamente aceptable.
7. Composición inmunogénica según la reivindicación 6 donde el vehículo farmacéuticamente
aceptable es un adyuvante.
8. Composición inmunogénica según la reivindicación 7 en dónde el adyuvante se selecciona de la
lista que consiste en: aceite mineral, adyuvante de Freund completo (FCA), adyuvante de Freund incompleto (FIA), alginatos, beta-glucanos, CpG, flagelina, fosfito de aluminio y potasio, hidroxido de aluminio, interleuquinas, levamisol, liposomas, microesferas biodegradables, Montanide ISA, Mycobacterium bovis, Mycobacterium butyricum, Mycobacterium chenolae, nanopartículas PLGA, paredes celulares de micobacteria, polisacáridos bacterianos (LPS), quimiocinas, quitosano, saponinas, sorbitan sesquioleato, vitamina C, vitamina E, o cualquier combinación de los mismos.
9. Composición inmunogénica según reivindicación 8 en la que el adyuvante es el adyuvante de
Freund.
10. Composición inmunogénica según cualquiera de las reivindicaciones 6 a 9, que comprende un
nanosistema como sistema de vectorización.
11. Composición inmunogénica según cualquiera de las reivindicaciones 6 a 9, que comprende un
microsistema como sistema de vectorización
12. Anticuerpo obtenible tras la inmunización de un animal con la composición inmunogénica según
reivindicaciones 6 a 11.
13. Anticuerpos según la reivindicación 14, donde el animal empleado para la inmunización es un
pez.
14. Uso como medicamento de los anticuerpos según cualquiera de las reivindicaciones 14 o 15.
15. Uso de la composición inmunogénica, según cualquiera de las reivindicaciones 6 a 11, en la
elaboración de un medicamento.
16. Uso según la reivindicación 15, donde le medicamento es una vacuna
17. Uso según la reivindicación 16, donde la vacuna es para peces.
18. Uso de la composición inmunogénica, según reivindicación 17, donde los peces se seleccionan
de la lista que consiste en: Dicentrarchus labrax, Epinephelus akaara, Macropodus opercularis, Morone americanus, Morone saxatilis, Mullus spp., Pagrus pagrus, Pictiblennius yatabei, Rachycentron canadum, Serióla quinqueradiata, Solea senegalensi, Solea solea, Sparus aurata.
19. Uso de la composición inmunogénica, según reivindicación 18, donde los peces son Solea
senegalensis y Solea solea.
20. Procedimiento para la producción de una molécula aminoacídica, según reivindicación 2,
caracterizado porque comprende el cultivo de una célula o microorganismo hospedador, según reivindicación 4, y la recuperación de la molécula aminoacídica del extracto celular o del sobrenadante.
21. Procedimiento para la producción de una molécula aminoacídica, según reivindicación 2,
caracterizado porque comprende el cultivo de un organismo transgénlco no humano, según reivindicación 5, y la recuperación de la molécula aminoacídica.
22. Procedimiento para la producción de una molécula nucleotídica, según reivindicación 1,
caracterizado porque comprende el cultivo de una célula o microorganismo hospedador, según reivindicación 4, y la recuperación de la molécula nucleotídica a partir del extracto celular o del sobrenadante.
23. Procedimiento para la producción de una molécula nucleotídica, según reivindicación 1,
caracterizado porque comprende el cultivo de un organismo transgénico no humano, según reivindicación 5, y la recuperación de la molécula nucleotídica.
24. Procedimiento para la elaboración de una composición inmunogénica según reivindicaciones 6 a
11, que comprende un procedimiento según reivindicaciones 20 o 23, y la adición de un vehículo farmacéuticamente aceptable.
25. Un kit para uso en la inducción de una respuesta inmune en peces, que comprende una
composición inmunogénica o vacunal según cualquiera de las reivindicaciones 6 a 11 y opcionalmente instrucciones relacionadas con la administración.
Patentes similares o relacionadas:
Vacuna subunitaria contra Mycoplasma spp., del 1 de Julio de 2020, de Agricultural Technology Research Institute: Una composición para prevenir una infección por Mycoplasma spp., que comprende: un principio activo, que comprende una proteína de PdhA; y un adyuvante […]
Proteína mutante, del 19 de Febrero de 2020, de Cytiva BioProcess R&D AB: Una proteína de unión a inmunoglobulina que se une a regiones de una molécula de inmunoglobulina distintas de las regiones determinantes de […]
Nanoporos MSP y procedimientos relacionados, del 8 de Enero de 2020, de UNIVERSITY OF WASHINGTON: Porina de Mycobacterium Smegmatis (Msp) que tiene un vestíbulo y una zona de constricción que definen un túnel, en la que la Msp comprende una MspA mutante, […]
Complejos génicos sintéticos, del 28 de Agosto de 2019, de THE REGENTS OF THE UNIVERSITY OF CALIFORNIA: Un método para reemplazar la regulación nativa de un conjunto de genes asociados colectivamente con una función con regulación sintética, comprendiendo […]
Métodos de despliegue de proteínas que contienen dominios Fc no covalentes sobre la superficie de células y métodos de selección de las mismas, del 10 de Julio de 2019, de MERCK PATENT GMBH: Método para el despliegue de proteínas sobre la superficie de una célula huésped, comprendiendo el método: (a) introducir en una célula huésped al menos uno o más polinucleótidos […]
Polipéptidos efectores desinmunizados de subunidad A de toxina Shiga para aplicaciones en mamíferos, del 19 de Junio de 2019, de MOLECULAR TEMPLATES, INC: Polipéptido que comprende una región efectora de la toxina Shiga, en el que: (i) la región efectora de la toxina Shiga tiene al menos un 95% de identidad de secuencia […]
Proteína de exportación de O-fosfoserina novedosa y procedimiento para producir O-fosfoserina usando la misma, del 5 de Junio de 2019, de CJ CHEILJEDANG CORPORATION: Un procedimiento para producir O-fosfoserina (OPS), que comprende cultivar un microorganismo que produce Ofosfoserina que se ha modificado para potenciar […]
Bacterias lácticas texturizantes, del 16 de Abril de 2019, de Dupont Nutrition Biosciences ApS: Cepa bacteriana láctica que comprende al menos una secuencia seleccionada entre el grupo constituido por las secuencias de nucleótidos SEC ID Nº 1, SEC ID Nº […]