Productos terapéuticos de aptámeros útiles en el tratamiento de trastornos relacionados con el complemento.
Un conjugado de aptámero/polietilenglicol (PEG) o una sal del mismo,
en donde el conjugado de aptámero/PEGtiene la estructura expuesta a continuación:**Fórmula**
donde indica un adaptador,
donde Aptámero ≥**Fórmula**
en la que fC y fU ≥ nucleótidos 2'-fluoro y mG y mA ≥ nucleótidos 2'-OMe y todos los otros nucleótidos son 2'-OH y3T indica una desoxitimidina invertida.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2006/005215.
Solicitante: Archemix LLC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 601 Montgomery Street, Suite 2020 San Francisco, CA 94111 ESTADOS UNIDOS DE AMERICA.
Inventor/es: WILSON, CHARLES, KURZ,MARKUS, EPSTEIN,David, BENEDICT,CLAUDE, GRATE,DILARA, KURZ,JEFFREY, MCCAULEY,THOMAS GREEN, ROTTMAN,JAMES.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K48/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen material genético que se introduce en las células del cuerpo vivo para tratar enfermedades genéticas; Terapia génica.
- C12N15/115 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Aptámeros, p.ej. ácidos nucleicos que unen una molécula diana específicamente y con alta afinidad sin hibridar entre ellos.
- C12Q1/68 C12 […] › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › en los que intervienen ácidos nucleicos.
PDF original: ES-2449047_T3.pdf
Fragmento de la descripción:
Productos terapéuticos de aptámeros útiles en el tratamiento de trastornos relacionados con el complemento Campo de la invención La invención se refiere en general al campo de los ácidos nucleicos y más particularmente a aptámeros capaces de unirse con la proteína C5 del sistema del complemento, útiles como productos terapéuticos en y diagnóstico de trastornos relacionados con el complemento cardiacos, inflamatorios y autoinmunitarios, lesión de reperfusión por isquemia y/u otras enfermedades o trastornos en los que está implicada activación del complemento mediada por C5. La invención se refiere además a materiales y métodos para la administración de aptámeros capaces de unirse con la proteína del sistema del complemento C5.
Antecedentes de la invención Los aptámeros son moléculas de ácido nucleico que tienen afinidad de unión específica por moléculas mediante interacciones distintas de la formación de pares de bases de Watson-Crick clásica.
Los aptámeros, como péptidos generados por presentación de fagos o anticuerpos monoclonales (“Mab”) , son capaces de unirse específicamente con dianas seleccionadas y modular la actividad de la diana, por ejemplo, mediante unión los aptámeros pueden bloquear la capacidad de actuación de su diana. Creados por un procedimiento de selección in vitro de grupos de oligonucleótidos de secuencia aleatoria, se han generado aptámeros para más de 100 proteínas incluyendo factores de crecimiento, factores de transcripción, enzimas, inmunoglobulinas y receptores. Un aptámero típico es de 10-15 kDa (30-45 nucleótidos) de tamaño, se une con su diana con afinidad subnanomolar, y diferencia frente a dianas estrechamente relacionadas (por ejemplo, los aptámeros normalmente no se unirán a otras proteínas de la misma familia génica) . Varios estudios estructurales han mostrado que los aptámeros son capaces de usar los mismos tipos de interacciones de unión (por ejemplo, enlaces de hidrógeno, complementariedad electrostática, contactos hidrófobos, exclusión estérica) que conducen la afinidad y especificidad en complejos de anticuerpo-antígeno.
Los aptámeros tienen varias características deseables para su uso como productos terapéuticos y de diagnóstico incluyendo alta especificidad y afinidad, eficacia biológica, y excelentes propiedades farmacocinéticas. Además, ofrecen ventajas competitivas específicas sobre anticuerpos y otros productos biológicos proteicos, por ejemplo:
1) Velocidad y control. Se producen aptámeros por un procedimiento completamente in vitro, permitiendo la rápida generación de candidatos iniciales, incluyendo candidatos terapéuticos. La selección in vitro permite que la especificidad y afinidad del aptámero estén estrechamente controladas y permite la generación de candidatos, incluyendo candidatos contra dianas tanto tóxicas como no inmunogénicas.
2) Toxicidad e inmunogenicidad. Los aptámeros como una clase han demostrado poca o ninguna toxicidad o inmunogenicidad. En la dosificación crónica de ratas o marmotas con altos niveles de aptámero (10 mg/kg diariamente durante 90 días) , no se observa toxicidad por ninguna medida clínica, celular o bioquímica. Aunque la eficacia de muchos anticuerpos monoclonales puede limitarse gravemente por la respuesta inmunitaria a los anticuerpos en sí mismos, es extremadamente difícil inducir anticuerpos para aptámeros más probablemente debido a que los aptámeros no pueden presentarse por linfocitos T mediante el MHC y la respuesta inmunitaria generalmente se entrena para no reconocer fragmentos de ácidos nucleicos.
3) Administración. Aunque la mayoría de los productos terapéuticos de anticuerpo aprobados en la actualidad se administran por infusión intravenosa (normalmente durante 2-4 horas) , pueden administrarse aptámeros por inyección subcutánea (la biodisponibilidad de aptámero mediante administración subcutánea es >80 % en estudios de monos (Tucker et al., J. Chromatography B. 732: 203-212, 1999) ) . Esta diferencia se debe principalmente a la solubilidad comparativamente baja y por lo tanto graves volúmenes necesarios para la mayoría de los MAb terapéuticos. Con buena solubilidad (>150 mg/ml) y peso molecular comparativamente bajo (aptámero: 10-50 kDa; anticuerpo: 150 kDa) , puede suministrarse una dosis semanal de aptámero por inyección en un volumen de menos de 0, 5 ml. Además, el tamaño pequeño de los aptámeros les permite penetrar en áreas de restricciones conformacionales que no permiten que penetren anticuerpos o fragmentos de anticuerpo, presentando otra ventaja más de productos terapéuticos o profilaxis basados en aptámeros.
4) Capacidad de cambio de escala y coste. Los aptámeros terapéuticos se sintetizan químicamente y en consecuencia pueden cambiarse de escala fácilmente según se necesite para cumplir las demandas de la producción. Aunque las dificultades del cambio de escala de la producción limitan en la actualidad la disponibilidad de algunos productos biológicos y el coste capital de una planta de producción de proteínas a gran escala es enorme, un único sintetizador de oligonucleótidos a gran escala puede producir más de 100 kg/año y requiere una inversión inicial relativamente modesta. El coste actual de los productos para la síntesis de aptámeros en la escala de kilogramos se estima en 500$/g, comparable al de anticuerpos altamente optimizados. Se espera que las mejoras continuas en el desarrollo del procedimiento reduzcan el coste de los productos a menos de 100$/g en cinco años.
5) Estabilidad. Los aptámeros terapéuticos son químicamente robustos. Están adaptados de forma intrínseca para reanudar la actividad tras su exposición a factores tales como calor y desnaturalizantes y pueden almacenarse durante periodos prolongados (>1 año) a temperatura ambiente como polvos liofilizados.
El sistema del complemento El sistema del complemento comprende un conjunto de al menos 20 proteínas de plasma y de membrana que actúan juntas en un sistema de cascada regulado para atacar formas extracelulares de patógenos (por ejemplo, bacterias) . El sistema del complemento incluye dos cascadas de activación enzimática distintas, las rutas clásica y alternativa (Figura 1) , y una ruta no enzimática conocida como ruta de ataque de membrana.
La primera cascada activada enzimáticamente, conocida como la ruta clásica, comprende varios componentes, C1, C4, C2, C3 y C5 (enumerados por orden en la ruta) . El inicio de la ruta clásica del sistema del complemento se produce después de unión y activación del primer componente de complemento (C1) por activadores tanto inmunitarios como no inmunitarios. C1 comprende un complejo dependiente de calcio de componentes C1q, C1r y C1s, y se activa mediante la unión del componente C1q. C1q contiene seis subunidades idénticas y cada subunidad comprende tres cadenas (las cadenas A, B y C) . Cada cadena tiene una región de cabeza globular que está conectada con una cola de tipo colágeno. La unión y activación de C1q por complejos de anticuerpo-antígeno se realiza mediante la región de grupos de cabeza C1q. Numerosos activadores de C1q no anticuerpos, incluyendo proteínas, lípidos y ácidos nucleicos, se unen a y activan C1q mediante un sitio distinto de la región de tallo de tipo colágeno. El complejo de Clqrs cataliza después la activación de los componentes del complemento C4 y C2, formando el complejo C4bC2a que actúa como una C3 convertasa.
La segunda cascada activada enzimáticamente, conocida como la ruta alternativa, es una ruta rápida, independiente de anticuerpo, para la activación y amplificación del sistema del complemento. La ruta alternativa comprende varios componentes, C3, Factor B y Factor D (enumerados por orden en la ruta) . Se produce activación de la ruta alternativa cuando C3b, una forma de escisión proteolítica de C3, se une con un agente de superficie activador tal como una bacteria. El Factor B se une después con C3b, y se escinde por el Factor D para producir la enzima activa, Ba. La enzima Ba escinde después más C3 para generar más C3b, produciendo deposición extensiva de complejos C3b-Ba en la superficie de activación.
Por lo tanto, las rutas del complemento tanto clásica como alternativa producen C3 convertasas que dividen el factor C3 en C3a y C3b. En este punto, ambas C3 convertasas se ensamblan además en C5 convertasas (C4b2a3b y C3b3bBb) . Estos complejos escinden posteriormente el componente del complemento C5 en dos componentes: el polipéptido C5a (9 kDa) y el polipéptido C5b (170 kDa) . El polipéptido C5a se une a un receptor acoplado a proteína G de 7 transmembranas, que se asoció originalmente con leucocitos y se sabe ahora que se expresa en diversos tejidos incluyendo... [Seguir leyendo]
Reivindicaciones:
1. Un conjugado de aptámero/polietilenglicol (PEG) o una sal del mismo, en donde el conjugado de aptámero/PEG tiene la estructura expuesta a continuación:
donde indica un adaptador, donde Aptámero =
en la que fC y fU = nucleótidos 2’-fluoro y mG y mA = nucleótidos 2’-OMe y todos los otros nucleótidos son 2’-OH y 3T indica una desoxitimidina invertida.
2. El conjugado de aptámero/PEG de la reivindicación 1, en donde el conjugado de aptámero/PEG tiene la estructura expuesta a continuación:
donde Aptámero =
en la que fC y fU = nucleótidos 2’-fluoro, y mG y mA = nucleótidos 2’-OMe y todos los otros nucleótidos son 2’-OH y 3T indica una desoxitimidina invertida.
3. El conjugado de aptámero/PEG de la reivindicación 1, en el que el adaptador es un adaptador de alquilo que comprende 6 grupos CH2 consecutivos, un adaptador de alquilo que comprende entre 2 y 18 grupos CH2
consecutivos, un adaptador de alquilo que comprende entre 2 y 12 grupos CH2 consecutivos o un adaptador de alquilo que comprende entre 3 y 6 grupos CH2 consecutivos.
4. Una composición que comprende una cantidad terapéuticamente eficaz del conjugado de aptámero/PEG de una cualquiera de las reivindicaciones 1 a 3 o una sal del mismo y un vehículo o diluyente farmacéuticamente 35 aceptables.
5. El conjugado de aptámero/PEG de una cualquiera de las reivindicaciones 1-3, para uso en un método para tratar, prevenir o aliviar una enfermedad mediada por la proteína del complemento C5, C5a y/o C5b-9 en un mamífero.
6. Uso del conjugado de aptámero/PEG de una cualquiera de las reivindicaciones 1-3 en la fabricación de un medicamento para tratar, prevenir o aliviar una enfermedad mediada por la proteína del complemento de C5, C5a y/o C5b-9 en un mamífero.
7. El conjugado de aptámero/PEG de la reivindicación 5 o uso de la reivindicación 6, en el que el mamífero es un ser 45 humano.
8. El conjugado de aptámero/PEG de la reivindicación 5 o uso de la reivindicación 6, en el que el trastorno es infarto de miocardio, ictus, lesión de reperfusión/isquemia, enfermedad infecciosa, septicemia, choque, alergia, asma, artritis reumatoide y otras enfermedades reumatológicas, esclerosis múltiple y otras enfermedades neurológicas,
psoriasis y otras enfermedades dermatológicas, miastenia grave, lupus eritematoso sistémico (LES) , glomerulonefritis y otras enfermedades renales, lesión miocárdica relacionada con cirugía de derivación de arteria coronaria (CABG) , lesión miocárdica relacionada con angioplastia de globo, lesión miocárdica relacionada con reestenosis, complicaciones mediadas por proteína del complemento relacionadas con cirugía de CABG, complicaciones mediadas por proteína del complemento relacionadas con intervención coronaria percutánea, hemoglobinuria nocturna paroxística, rechazo de trasplante agudo, rechazo de trasplante hiperagudo, rechazo de trasplante subagudo o rechazo de trasplante crónico.
9. El conjugado de aptámero/PEG de la reivindicación 5 o uso de la reivindicación 6, en el que el trastorno para tratar es una enfermedad isquémica aguda, enfermedad inflamatoria aguda, enfermedad inflamatoria crónica o enfermedad mediada por el sistema inmunitario.
10. El conjugado de aptámero/PEG de la reivindicación 5 o uso de la reivindicación 6, en el que el conjugado de aptámero/PEG se administra antes de la cirugía y continuando la administración al menos 24 horas.
11. El conjugado de aptámero/PEG de la reivindicación 5 o uso de la reivindicación 6, en el que el conjugado de aptámero/PEG se administra por vía intravenosa.
12. Un método de diagnóstico in vitro que comprende poner en contacto el conjugado de aptámero/PEG de una cualquiera de las reivindicaciones 1 a 4 con una composición que se sospecha que comprende la proteína del complemento C5 o una variante de la misma y detectar la presencia o ausencia de la proteína del complemento C5
o una variante de la misma.
13. El método de diagnóstico in vitro de la reivindicación 12, en el que la proteína del complemento C5 o variante de la misma es una proteína del complemento C5 o variante de la misma.
14. Uso del conjugado de aptámero/PEG de acuerdo con una cualquiera de las reivindicaciones 1 a 3 como un diagnóstico in vitro.
15. Un conjugado de aptámero/PEG de acuerdo con una cualquiera de las reivindicaciones 1 a 3, para uso como un diagnóstico in vivo.
16. Un conjugado de aptámero/PEG de acuerdo con una cualquiera de las reivindicaciones 1 a 3, para uso en el tratamiento, la prevención o el alivio de enfermedad in vivo.
GRUPO Nº DE RATONES ARTÍCULO DE ENSAYO DOSIS MEDICIONES
CONC (nM) VELOCIDAD DE PERFUSIÓN ml/min
1 5 SIN APTÁMERO 0 3 FRECUENCIA CARDIACA, RITMO, PRESIÓN VENTRICULAR IZQUIERDA
3 3 APTÁMERO IRRELEVANTE A RELACIÓN MOLAR 50X 1500 3 FRECUENCIA CARDIACA, RITMO, PRESIÓN VENTRICULAR IZQUIERDA
4 3 ARC186 A EQUIVALENCIA MOLAR 30 3 FRECUENCIA CARDIACA, RITMO, PRESIÓN VENTRICULAR IZQUIERDA
5 5 ARC186 A RELACIÓN MOLAR 10X 300 3 FRECUENCIA CARDIACA, RITMO, PRESIÓN VENTRICULAR IZQUIERDA
6 4 ARC186 A RELACIÓN MOLAR 50X 1500 3 FRECUENCIA CARDIACA, RITMO, PRESIÓN VENTRICULAR IZQUIERDA
Fig. 23
ANIMAL TRATAMIENTO IRRELEVANTE C3b C5b-9
1-001 (1/26) NINGUNO NEG POS POS
1-002 (1-26) NINGUNO NEG POS POS
1-001 NINGUNO NEG POS POS
1-002 NINGUNO NEG POS POS
1-003 NINGUNO NEG POS POS
3-001 APTÁMERO IRRELEVANTE 50 X MOLAR NEG POS POS
3-002 APTÁMERO IRRELEVANTE 50X MOLAR NEG POS POS
3-003 APTÁMERO IRRELEVANTE 50X MOLAR NEG POS POS
4-001 APTÁMERO C5 EQUIVALENCIA MOLAR NEG POS POS
4-002 APTÁMERO C5 EQUIVALENCIA MOLAR NEG POS POS
4-003 APTÁMERO C5 EQUIVALENCIA MOLAR NEG POS POS
5-001 APTÁMERO C5 EQUIVALENCIA MOLAR 10X NEG POS NEG
5-002 APTÁMERO C5 EQUIVALENCIA MOLAR 10X NEG POS NEG
5-003 APTÁMERO C5 EQUIVALENCIA MOLAR 10X NEG POS NEG
5-004 APTÁMERO C5 EQUIVALENCIA MOLAR 10X NEG POS NEG
5-005 APTÁMERO C5 EQUIVALENCIA MOLAR 10X NEG POS NEG
6-001 APTÁMERO C5 EQUIVALENCIA MOLAR 50X NEG POS NEG
6-002 APTÁMERO C5 EQUIVALENCIA MOLAR 50X NEG POS NEG
6-003 APTÁMERO C5 EQUIVALENCIA MOLAR 50X NEG POS NEG
6-004 APTÁMERO C5 EQUIVALENCIA MOLAR 50X NEG POS NEG
Fig. 31
ANIMAL COMPUESTO SUERO RELACIÓN MOLAR EDP AUMENTADO FALLO (SÍ o NO) TIEMPO HASTA EL FALLO
1-001 ARC658 HUMANO 0 S S 4 MIN 30S
1-002 ARC658 HUMANO 0 S S 4 MIN 38S
1-003 ARC658 HUMANO 0 S S 3 MIN 20 S
1-004 ARC658 HUMANO 0 S S 12 MIN 24S
1-005 ARC658 HUMANO 0 S N ND
1-006 ARC658 HUMANO 0 S S 8 MIN 30 S
1a-001 ARC658 HUMANO 0, 5 S S 7 MIN 22 S
1a-002 ARC658 HUMANO 0, 5 S S 7 MIN 30 S
1a-003 ARC658 HUMANO 0, 5 S S 8 MIN 13 S
2-001 ARC658 HUMANO 1 N N ND
2-002 ARC658 HUMANO 1 N N ND
2-003 ARC658 HUMANO 1 N N ND
2-004 ARC658 HUMANO 1 N N ND
3-001 ARC658 HUMANO 3 N N ND
3-002 ARC658 HUMANO 3 N N ND
3-003 ARC658 HUMANO 3 N N ND
6-001 ARC658 PRIMATE 0 S S 2 MIN 30 S
6-002 ARC658 PRIMATE 0 S S 2 MIN 47 S
6-003 ARC658 PRIMATE 0 S S 3 MIN 30 S
6-004 ARC658 PRIMATE 0 S S 1 MIN 28 S
6a-001 ARC658 PRIMATE 3 S S 5 MIN 2 S
6a-002 ARC658 PRIMATE 3 S S 4 MIN 30 S
6a-003 ARC658 PRIMATE 3 S S 3 MIN 43 S
6a-004 ARC658 PRIMATE 3 S S 8 MIN 0 S
7-001 ARC658 PRIMATE 10 S N ND
7-002 ARC658 PRIMATE 10 S N ND
7-003 ARC658 PRIMATE 10 S S 9 MIN 15 S
7-004 ARC658 PRIMATE 10 S N ND
9-001 ARC658 PRIMATE 20 S S 12 MIN 50 S
11-001 ARC658 PRIMATE 30 S N ND
11-002 ARC658 PRIMATE 30 S S 10 MIN 0 S
11-003 ARC658 PRIMATE 30 S N ND
13-001 ARC658 PRIMATE 50 N N ND
13-002 ARC658 PRIMATE 50 N N ND
13-003 ARC658 PRIMATE 50 N N ND
Fig. 32
NÚMERO NÚMERO ARTÍCULO NIVEL DE VOLUMEN DE REGIMEN DE RECOGIDA DE
DE GRUPO DE ANIMAL DE ENSAYO DOSIFICACIÓN DOSIFICACIÓN DOSIFICACIÓN MUESTRAS
(mg/kg) (ml/kg)
1 3 ARC657 10 1 EMBOLADA t=PRE-DOSIS,
PEG 20 kDa INTRAVENOSA 0, 5, 1, 2, 4, 8,
EL DÍA 1 16, 24, 32, 48 h
2 3 ARC658 PEG 30 kDa 10 1 EMBOLADA INTRAVENOSA EL DÍA 1 t=PRE-DOSIS, 0, 5, 1, 2, 4, 8, 16, 24, 32, 48 h
3 3 ARC187 10 1 EMBOLADA t=PRE-DOSIS,
PEG 40 kDa INTRAVENOSA 0, 5, 1, 2, 4, 8,
EL DÍA 1 16, 24, 32, 48 h
Fig. 34
PK DE CONJUGADOS DE APTÁMERO ANTI-C5 PEG EN RATA SPRAGUE-DAWLEY
APTÁMERO ARC6S7 ARC658 ARC187
GRUPO DE PEG 20 kDa 30 kDa 40 kDa
MEDIA DT MEDIA DT MEDIA DT
TIEMPO (h) Cp ( M) Cp ( M) Cp ( M) Cp ( M) Cp ( M) Cp ( M)
0 0, 00 0, 00 0, 00 0, 00 0, 00 0, 00
0, 5 12, 77 2, 67 2, 97 0, 62 6, 52 1, 77
1 13, 38 2, 08 4, 09 1, 44 7, 94 1, 08
2 6, 63 1, 87 3, 40 0, 66 6, 57 1, 56
4 2, 38 0, 87 2, 22 0, 39 4, 56 0, 54
8 0, 72 0, 18 2, 87 1, 84 1, 53 0, 57
12 0, 31 0, 03 0, 60 0, 09 1, 45 0, 17
24 <LLOQ <LLOQ 0, 47 0, 17 0, 73 0, 03
32 <LLOQ <LLOQ <LLOQ <LLOQ 0, 49 0, 01
48 <LLOQ <LLOQ <LLOQ <LLOQ 0, 27 0, 02
Fig. 35
ESPECIE DOSIS (mg/kg) VÍA DE ADMINIS. GRUPO DE PEG Cmáx ( g/ml) AUC0-_ (μg_h/ml) T1/2 (a) (h) T1/2 ( ) (h) Cl (ml/min_kg) Vss (ml/kg)
RATA 10 IV 20 kD 169, 97 458 - 2, 05 0, 36 65
RATA 10 IV 30 kD 52, 00 497 - 7, 40 0, 34 220
RATA 10 IV 40 kD 100, 85 886 - 15, 00 0, 19 188
Fig. 37
Nº DE GRUPO Nº DE ANIMALES ARTÍCULO DE ENSAYO DOSIS VÍA DE DOSIS RECOGIDA DE MUESTRAS
(mg/kg) (ml/kg)
1 33F ARC187 10 4 IV t=PRE-DOSIS, 0, 5, 1, 2, 4, 8, 16, 24, 32, 48, 72 h
2 33F ARC1905 10 4 IV t=PRE-DOSIS, 0, 5, 1, 2, 4, 8, 16, 24, 32, 48, 72 h
Fig. 38A
ANÁLISIS DE PK NO COMPARTIMENTAL (NCA)
ATRIBUTO UNIDAD ARC1905 ARC187
Cmáx μM 12 10
AUC0-_ μM-h 88 89
MRT0-_ h 11 11
CL ml/min.kg 0, 15 0, 15
Vss ml/kg 95 96
K10 1/h 0, 151 0, 121
t1/2 (K10) h 5 6
Fig. 38C
APTÁMERO PRE 1 h 3 h 6 h
ARC657 NO SÍ SÍ SÍ
ARC658 NO SÍ SÍ SÍ
ARC187 NO SÍ SÍ SÍ
Fig. 39
NÚMERO NÚMERO ARTÍCULO NIVEL VOLUMEN REGIMEN RECOGIDA
DE DE DE ENSAYO DE DE DE DE MUESTRAS
GRUPO ANIMALES DOSIFICACIÓN DOSIFICACIÓN DOSIFICACIÓN
(mg/kg) (ml/kg)
1 1 ARC657 PEG 20 kDa 30 3 EMBOLADA INTRAVENOSA EL DÍA 1 t=PRE-DOSIS, 1, 5, 10, 15, Y 30 MINUTOS Y A 1, 2, 4, 6, 8, 12, 24, 48, 72, 96, Y 192 H
2 1 ARC658 PEG 30 3 EMBOLADA t=PRE-DOSIS, 1,
30 kDa INTRAVENOSA EL DÍA 1 5, 10, 15, Y 30 MINUTOS Y AT1,
2, 4, 6, 8, 12, 24,
48, 72, 96, Y 192 H
3 1 ARC187 30 3 EMBOLADA t=PRE-DOSIS, 1,
PEG 40 kDa INTRAVENOSA EL DÍA 1 5, 10, 15, Y 30 MINUTOS Y A 1,
2, 4, 6, 8, 12, 24,
48, 72, 96, Y 192 H
Fig. 40
PK DE CONJUGADOS DE APTÁMERO ANTI-C5 -PEG EN MACACO CYNOMOLGUS
APTÁMERO ARC657 ARC658 ARC187
GRUPO DE PEG 20 kDa 30 kDa 40 kDa
MEDIA MEDIA MEDIA
TIEMPO (HORAS) Cp ( M) Cp ( M) Cp ( M)
0 0, 00 0, 00 0, 00
0, 08 16, 41 21, 99 18, 00
0, 25 16, 64 22, 67 17, 26
0, 5 19, 38 26, 16 24, 17
1 19, 36 27, 08 21, 79
4 7, 73 14, 16 21, 69
8 2, 03 6, 02 16, 68
12 1, 10 3, 04 13, 11
24 0, 36 0, 95 7, 24
48 0, 15 0, 42 2, 30
72 0, 07 0, 25 0, 96
96 0, 03 0, 23 0, 54
192 0, 01 0, 04 0, 14
Fig. 41
ESPECIE DOSIS (mg/kg) VIA DE ADMIN. GRUPO DE PEG Cmáx ( g/ml) AUC0-_ (μg_h/ml) T1/2 (a) (h) T1/2 ( ) (h) Cl (ml/min_kg) Vss (ml/kg)
PRIMATE 30 IV 20 kD 293 1191 2, 35 31, 80 0, 41 273
PRIMATE 30 IV 30 kD 385 2484 3, 33 40, 08 0, 20 233
PRIMATE 30 IV 40 kD 316 6752 12, 38 60, 11 0, 07 141
Fig. 42
NÚMERO NÚMERO ARTÍCULO DE NIVEL VOLUMEN RÉGIMEN RECOGIDA
DE GRUPO DE ENSAYO DE DE DE DE
ANIMALES DOSIFICACIÓN DOSIFICACIÓN DOSIFICACIÓN MUESTRAS
(mg/kg) (ml/kg)
1 4 ARC658 30 3 EMBOLADA t=PRE-DOSIS,
PEG 30 kDa INTRAVENOSA EL DÍA 1 5, 10, 15, Y 30 MINUTOS Y A
1, 2, 4, 6, 8, 12,
24, 48, 72, 96,
144 Y 192 H
2 4 ARC187 30 3 EMBOLADA t=PRE-DOSIS,
PEG 40 kDa INTRAVENOSA EL DÍA 1 5, 10, 15, Y 30 MINUTOS Y A
1, 2, 4, 6, 8, 12,
24, 48, 72, 96,
144 Y 192 H
Fig. 44
ESPECIE DOSIS (mg/kg) VÍA DE ADMINIST. GRUPO DE PEG Cmáx ( g/ml) AUC0-_ (μg_h/ml) T1/2 (a) (h) T1/2 ( ) (h) Cl (ml/min_kg) Vss (ml/kg)
PRIMATE 30 IV 30 kD 519 3059 2, 35 30, 45 0, 16 213
PRIMATE 30 IV 40 kD 609 8061 4, 48 53, 13 0, 06 168
Fig. 46
NÚMERO DE GRUPO NÚMERO DE ANIMALES ARTÍCULO DE ENSAYO NIVEL DE DOSIFICACIÓN (mg/kg) CONCENTRACIÓN DE DOSIS (ml/kg) VOLUMEN DE DOSIS REGIMEN DE DOSIFICACIÓN ÚLTIMO DÍA DE ENSAYO
1 3 ARC187 EMBOLADA IV 1 mg/kg E INFUSIÓN IV 0, 0013 mg/kg/min 10 EMBOLADA IV 0, 1 ml/kg E INFUSIÓN IV 0, 1872 ml/kg/día EMBOLADA IV E INFUSIÓN DE 48 HORAS EL DÍA 1 DÍA 8
Fig. 49
ESPECIE DOSIS (mg/kg) VÍA DE ADMINIST. GRUPO DE PEG Cmáx ( g/ml) AUC0-_ (μg_h/ml) T1/2 (a) (h) T1/2 ( ) (h) Cl (ml/min_kg) Vss (ml/kg)
PRIMATE 30 IV 40 kD 610 8061 4, 48 53, 13 0, 06 168
Fig. 50
APTÁMERO GRUPO DE PEG PESO MOLECULAR (OLIGO) PESO MOLECULAR (TOTAL) t1/2 ( ) (h) t1/2 ( ) (h) DOSIS TOTAL (OLIGO) PARA 1, 5 M (g)
ARC187 40 kDa 12.703 52.703 4, 48 53, 13 0, 40
Fig. 53
TRATAMIENTO ACT (SEGUNDOS)
DONANTE 1a DONANTE 2b DONANTE 3b
LÍNEA BASAL 133 ± 30 145 ± 12 138 ± 1
+ HEPARINA 842 ± 95 519 + 16 450 ± 15
+ HEPARINA Y ARC187 Nd 618 + 55 492 ± 28
+ HEPARINA Y PROTAMINA 160 ± 11 155 ± 6 159 ± 9
+ HEPARINA, PROTAMINA Y ARC187 200 ± 5 172 ± 1 169 ± 8
a HEPARINA 5 U/ml; b HEPARINA 4 U/ml; nd; NO DETERMINADO
Fig. 55
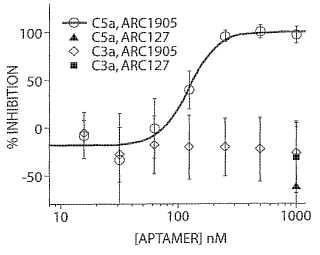
Especie del suero CI50 de ARC1905 (nM) CI50 de ARC127 (nM)
Humano 0, 349 ±0, 0898 > 10.000 ND
Mono Cynomolgus 3, 69 ±0, 603 > 10.000 ND
Rata 2700 ±470 ∼10.000 ND
Fig. 59B
Aptámero CI50 (nM) CI90 (nM) CI99 (nM)
Ser humano 196 ±13, 9 442 ±23, 2 1090 ±198, 0
Macaco Cynomolgus 536 ±54, 7 1810 ±405, 8 6900 ±2600
Relación cyno/ser humano 2, 73 ±0, 339 4, 1 ±0, 94 6, 4 ±2, 65
Fig. 63
Donante CI50 (nM) CI90 (nM) CI99 (nM)
Media de 5 119 268 694
donantes
DT 28, 6 39, 2 240, 9
Fig. 66
Patentes similares o relacionadas:
Composiciones útiles en el tratamiento de la deficiencia de ornitina transcarbamilasa (OTC), del 8 de Julio de 2020, de THE TRUSTEES OF THE UNIVERSITY OF PENNSYLVANIA: Un vector vírico recombinante que comprende una secuencia de ácido nucleico que codifica la proteína ornitina transcarbamilasa humana (hOTC) y secuencias […]
Terapia génica para la diabetes, del 8 de Julio de 2020, de UCL Business Ltd: Una molécula de ácido nucleico que comprende una secuencia de nucleótidos que codifica una proteína preproinsulina funcional en donde la secuencia de nucleótidos tiene al menos […]
Vacuna de ADN que contiene un epítopo específico de VEGF y/o un epítopo específico de angiopoyetina-2, del 1 de Julio de 2020, de OSAKA UNIVERSITY: Un vector de expresión que codifica un polipéptido del antígeno del núcleo del virus de la hepatitis B quimérico con una inserción para uso en el tratamiento o la profilaxis […]
Composiciones para modular la expresión de SOD-1, del 24 de Junio de 2020, de Biogen MA Inc: Un compuesto antisentido según la siguiente fórmula: mCes Aeo Ges Geo Aes Tds Ads mCds Ads Tds Tds Tds mCds Tds Ads mCeo Aes Geo mCes Te (secuencia […]
Ácido nucleico antisentido, del 24 de Junio de 2020, de NIPPON SHINYAKU CO., LTD.: Un oligómero antisentido de 14 a 32 bases de longitud, que comprende dos unidades de oligómeros conectadas seleccionadas del grupo que consiste […]
Plekhg5 como diana farmacéutica para trastornos neurológicos, del 15 de Junio de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC): Plekhg5 como diana farmacéutica para trastornos neurológicos. La invención hace referencia al uso del gen Plekhg5 como diana farmacológica para el cribado, […]
Vectores de AAV dirigidos a oligodendrocitos, del 10 de Junio de 2020, de THE UNIVERSITY OF NORTH CAROLINA AT CHAPEL HILL: Un ácido nucleico que codifica una cápside de AAV, comprendiendo el ácido nucleico una secuencia codificante de la cápside de AAV que es al menos el 96 % idéntica […]
Método para activar células T auxiliares, del 10 de Junio de 2020, de OTSUKA PHARMACEUTICAL CO., LTD.: Una composición para su uso en el tratamiento o prevención del cáncer mediante la activación de células T auxiliares en un sujeto, en donde dicha composición […]