PRODUCTOS RESISTENTES A LA MANIPULACION INDEBIDA PARA EL APORTE DE OPIOIDES.
Producto farmacéutico que comprende:
a)una pluralidad de partículas extrusionadas,
comprendiendo cada una de las partículas un antagonista opioide dispersado en una matriz;
b)una capa que cubre al menos una parte de las partículas extrusionadas; secuestrando la matriz y la capa al antagonista opioide en una forma posológica intacta, y
una segunda pluralidad de partículas farmacéuticamente aceptables, comprendiendo cada una de las de la segunda pluralidad de partículas un agonista opioide dispersado en una matriz, donde la matriz de la primera pluralidad de partículas comprende un primer material hidrofóbico, donde la capa comprende un segundo material hidrofóbico en una cantidad de aproximadamente un 5 a aproximadamente un 30%, de aproximadamente un 16 a aproximadamente un 30%, de aproximadamente un 20% a aproximadamente un 29% o de aproximadamente un 22% a aproximadamente un 28% del peso de las partículas extrusionadas, y donde la matriz de la segunda pluralidad de partículas comprende un tercer material hidrofóbico, siendo las partículas con agonista opioide preferiblemente formadas por extrusión
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2004/011933.
Solicitante: EURO-CELTIQUE S.A..
Nacionalidad solicitante: Luxemburgo.
Dirección: 2, AVENUE CHARLES DE GAULLE,1653 LUXEMBOURG.
Inventor/es: OSHLACK, BENJAMIN, CHASIN, MARK, HUANG, HUA-PIN, VAN BUSKIRK,GLENN, VASHI,VIJAY.
Fecha de Publicación: .
Fecha Concesión Europea: 24 de Febrero de 2010.
Clasificación Internacional de Patentes:
- A61K31/485 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Derivados del morfinano, p. ej. morfina, codeína.
- A61K45/06 A61K […] › A61K 45/00 Preparaciones medicinales que contienen ingredientes activos no previstos en los grupos A61K 31/00 - A61K 41/00. › Mezclas de ingredientes activos sin caracterización química, p. ej. compuestos antiflojísticos y para el corazón.
- A61K9/20K2B
- A61K9/50M
Clasificación PCT:
- A61K31/485 A61K 31/00 […] › Derivados del morfinano, p. ej. morfina, codeína.
- A61K9/14 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › en estado especial, p. ej. polvos (microcápsulas A61K 9/50).
- A61P25/04 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 25/00 Medicamentos para el tratamiento de trastornos del sistema nervioso. › Analgésicos que actúan sobre el sistema nervioso central, p.ej. opioides.
Clasificación antigua:
- A61K6/00 A61K […] › Preparaciones para técnica dental.
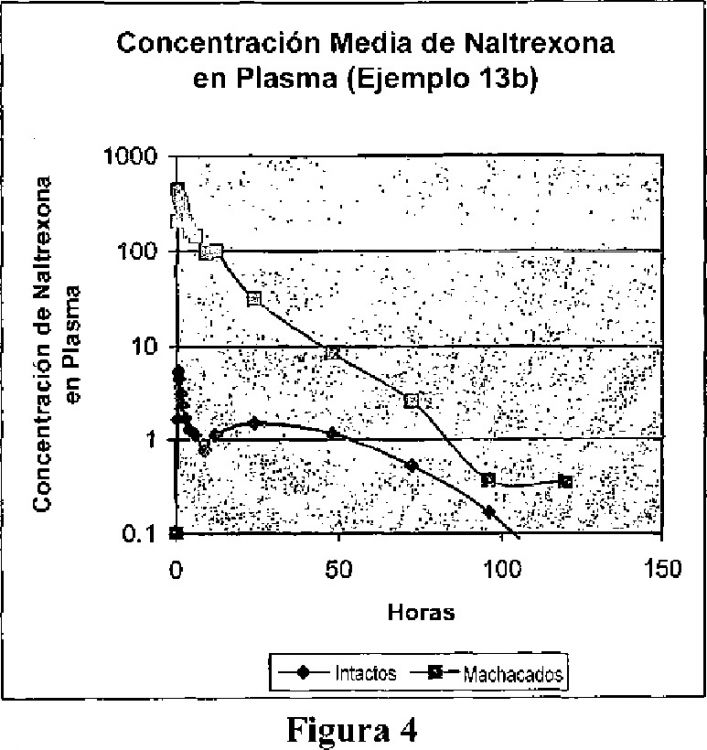
Fragmento de la descripción:
Productos resistentes a la manipulación indebida para el aporte de opioides.
Antecedentes de la invención
Los productos farmacéuticos son a veces objeto de abuso. Por ejemplo, una determinada dosis de agonista opioide puede ser más potente al ser administrada parenteralmente en comparación con la misma dosis administrada oralmente. Algunas formulaciones pueden ser objeto de manipulación indebida, proporcionando así el agonista opioide contenido en las mismas, que puede ser entonces objeto de un uso ilícito. Las formulaciones de agonistas opioides para liberación controlada son a veces machacadas por los abusadores de drogas para así obtener el opioide contenido en las mismas, que queda entonces disponible para una liberación inmediata al procederse a una administración oral o parenteral.
Se han combinado antagonistas opioides con ciertos agonistas opioides para disuadir del abuso parenteral de los agonistas opioides. En la técnica anterior, la combinación de naloxona y pentazocina de liberación inmediata ha sido utilizada en tabletas que están disponibles en los Estados Unidos y están disponibles comercialmente como Talwin®Nx de la Sanofi-Winthrop. El Talwin®Nx contiene pentazocina clorhidrato de liberación inmediata equivalente a 50 mg de base y naloxona clorhidrato equivalente a 0,5 mg de base. Una terapia de combinación fija que comprende tilidina (50 mg) y naloxona (4 mg) ha estado disponible en Alemania para el manejo del dolor desde 1978 (Valoron®N, Goedecke). Una combinación de buprenorfina y naloxona fue introducida en 1991 en Nueva Zelanda (Temgesic®Nx, Reckitt & Colman) para el tratamiento del dolor.
Purdue Pharma L.P. actualmente comercializa oxicodona de liberación sostenida en formas posológicas que contienen 10, 20, 40 y 80 mg de oxicodona clorhidrato bajo el nombre comercial de OxyContin.
Las Patentes U.S. Núms. 5.266.331, 5.508.042, 5.549.912 y 5.656.295 dan a conocer formulaciones de oxicodona de liberación sostenida.
La Patente U.S. Nº 5.472.943 a nombre de Crain et al. describe métodos para acrecentar la potencia analgésica de agonistas opioides de actuación bimodal administrando el agonista con un antagonista opioide.
Las Patentes U.S. Núms. 6.277.384, 6.475.494 y 6.375.957 a nombre de Kaiko et al. y 6.228.863 a nombre de Colucci et al. están dirigidas a reducir el potencial de abuso asociado a las formas posológicas de analgésicos opioides.
La Publicación PCT Nº WO 01/58451 titulada "Formulaciones de Agonistas Opioides Orales Resistentes a la Manipulación Indebida" está dirigida a reducir el potencial de abuso asociado a las formas posológicas de analgésicos opioides mediante la inclusión de un antagonista opioide secuestrado en una forma posológica de agonista opioide.
Sigue habiendo necesidad en la técnica de una forma posológica oral que comprenda un agonista opioide y tenga un reducido potencial de abuso.
Objetos y breve descripción de la invención
Es un objeto de la presente invención aportar un producto farmacéutico que comprenda:
una segunda pluralidad de partículas farmacéuticamente aceptables, comprendiendo cada una de las de la segunda pluralidad de partículas un agonista opioide dispersado en una matriz, donde la matriz de la primera pluralidad de partículas comprende un primer material hidrofóbico, donde la capa comprende un segundo material hidrofóbico en una cantidad de aproximadamente un 5% a aproximadamente un 30%, de aproximadamente un 16% a aproximadamente un 30%, de aproximadamente un 20% a aproximadamente un 29% o de aproximadamente un 22% a aproximadamente un 28% del peso de las partículas extrusionadas y donde la matriz de la segunda pluralidad de partículas comprende un tercer material hidrofóbico, siendo las partículas con agonista opioide preferiblemente formadas por extrusión.
También se describe aquí una forma posológica oral que comprende un antagonista opioide e impide considerablemente la liberación del antagonista opioide.
Es un objeto de ciertos ítems que aquí se describen aportar una forma posológica oral que comprenda una formulación de antagonista opioide que sea útil para reducir el potencial de abuso de un agonista opioide.
Es un objeto de ciertos ítems que aquí se describen aportar una forma posológica oral que comprenda una formulación de antagonista opioide que sea útil para reducir el abuso potencial de un agonista opioide sin afectar a los efectos analgésicos del agonista opioide o incurrir en la posibilidad de precipitar el abandono.
Es un objeto de ciertos ítems que aquí se describen aportar una forma posológica oral que contenga una dosis eficaz de un agonista opioide y una dosis de antagonista opioide que no cambie o no cambie considerablemente la eficacia analgésica del agonista opioide cuando la forma posológica sea administrada oralmente estando intacta. Sin embargo, si la forma posológica es manipulada indebidamente, el antagonista opioide es liberado considerablemente y puede impedir el abuso interfiriendo en el efecto del agonista opioide.
Es un objeto de ciertos ítems que aquí se describen aportar una forma posológica oral que contenga una dosis eficaz de un agonista opioide en una forma de liberación controlada que no libere todo el agonista que quedaría disponible para una liberación inmediata al ser la forma posológica objeto de una manipulación indebida.
Es un objeto de ciertos ítems que aquí se describen aportar una forma posológica oral que contenga partículas con agonista opioide y partículas con antagonista secuestrado donde las partículas con agonista y las partículas con antagonista sean similares, p. ej. en cuanto al aspecto, a la textura, al olor, al sabor, a la dureza, a la forma, al tamaño y/o a una combinación de dichas propiedades, o sean virtualmente indistinguibles unas de otras sobre la base de una o varias de estas propiedades.
Es un objeto de ciertos ítems que aquí se describen aportar un método para impedir el abuso de una forma posológica oral que comprenda un agonista opioide a base de incluir en la forma posológica un antagonista opioide que está secuestrado, o sea que p. ej. no está biodisponible cuando la dosis es administrada estando intacta, pero queda biodisponible cuando se hace una manipulación indebida de la forma posológica (p. ej. en un intento de usar indebidamente la dosis de agonista opioide).
Es un objeto de ciertos ítems que aquí se describen aportar un método para tratar el dolor en los pacientes humanos, comprendiendo dicho método la administración de una forma posológica oral de un agonista opioide que tiene un reducido potencial de uso indebido por la ruta oral, parenteral, intranasal y/o sublingual.
Es un objeto de ciertas realizaciones de la invención aportar un método para preparar un producto farmacéutico según cualquiera de las realizaciones de la invención, comprendiendo dicho método los pasos de preparar una pluralidad de partículas que comprendan un agonista opioide; preparar una pluralidad de partículas que comprendan un antagonista opioide; y aplicar una capa a las partículas con agonista opioide y a las partículas con antagonista opioide de forma tal que las partículas con agonista opioide y las partículas con antagonista opioide sean similares o virtualmente indistinguibles en cuanto al aspecto.
Es un objeto de ciertas realizaciones de la invención aportar un método para preparar un producto farmacéutico según cualquiera de las realizaciones de la invención, comprendiendo dicho método los pasos de:
Reivindicaciones:
1. Producto farmacéutico que comprende:
una segunda pluralidad de partículas farmacéuticamente aceptables, comprendiendo cada una de las de la segunda pluralidad de partículas un agonista opioide dispersado en una matriz, donde la matriz de la primera pluralidad de partículas comprende un primer material hidrofóbico, donde la capa comprende un segundo material hidrofóbico en una cantidad de aproximadamente un 5 a aproximadamente un 30%, de aproximadamente un 16 a aproximadamente un 30%, de aproximadamente un 20% a aproximadamente un 29% o de aproximadamente un 22% a aproximadamente un 28% del peso de las partículas extrusionadas, y donde la matriz de la segunda pluralidad de partículas comprende un tercer material hidrofóbico, siendo las partículas con agonista opioide preferiblemente formadas por extrusión.
2. El producto farmacéutico de la reivindicación 1, donde los materiales hidrofóbicos primero, segundo y tercero son seleccionados de entre los miembros del grupo que consta de un polímero celulósico, polímero y copolímero acrílico, polímero y copolímero de ácido metacrílico, goma laca, ceína, aceite de ricino hidrogenado, aceite vegetal hidrogenado y mezclas de cualesquiera de los materiales anteriormente mencionados, siendo el primer material hidrofóbico y el segundo material hidrofóbico preferiblemente los mismos, siendo el primer material hidrofóbico, el segundo material hidrofóbico y el tercer material hidrofóbico preferiblemente los mismos, o siendo el primer material hidrofóbico y el tercer material hidrofóbico preferiblemente los mismos, o siendo el segundo material hidrofóbico y el tercer material hidrofóbico preferiblemente los mismos.
3. El producto farmacéutico de la reivindicación 1 o la reivindicación 2, que comprende adicionalmente una cápsula que contiene la pluralidad de partículas con agonista opioide y la pluralidad de partículas extrusionadas de antagonista opioide, donde el agonista opioide es seleccionado de entre los miembros del grupo que consta de alfentanilo, alilprodina, alfaprodina, anileridina, bencilmorfina, becitramida, buprenorfina, butorfanol, clonitaceno, codeína, desomorfina, dextromoramida, dezocina, diampromida, diamorfona, dihidrocodeína, dihidromorfina, dimenoxadol, dimefeptanol, demitiltiambuteno, butirato de dioxafetilo, dipipanona, eptazocina, etoheptacina, etilmetiltiambuteno, etilmorfina, etonitaceno, etorfina, dihidroetorfina, fentanilo y derivados, heroína, hidrocodona, hidromorfona, hidroxipetidina, isometadona, cetobemidona, levorfanol, levofenacilmorfano, lofentanilo, meperidina, meptacinol, metazocina, metadona, metopon, morfina, mirofina, narceína, nicomorfina, norlevorfanol, normetadona, nalorfina, nalbufeno, normorfina, norpipanona, opio, oxicodona, oximorfona, papaveretum, pentazocina, fenadoxona, fenomorfán, fenazocina, fenoperidina, piminodina, piritramida, proheptacina, promedol, properidina, propoxifeno, sufentanilo, tilidina, tramadol, sales farmacéuticamente aceptables de los mismos y mezclas de cualesquiera de los agonistas anteriormente mencionados, siendo el agonista preferiblemente seleccionado de entre los miembros del grupo que consta de oxicodona, hidromorfona, hidrocodona, oximorfona o morfina y sales farmacéuticamente aceptables de las mismas, y/o donde el antagonista opioide es seleccionado de entre los miembros del grupo que consta de naltrexona, naloxona, nalmefeno, ciclazacina, levalorfán y sales farmacéuticamente aceptables de los mismos.
4. El producto farmacéutico de cualquiera de las reivindicaciones 1 a 3, donde la matriz es capaz de secuestrar al antagonista sin la capa y la capa aumenta el secuestro, o donde la capa es capaz de secuestrar al antagonista sin la matriz y la matriz aumenta el secuestro, o donde la matriz es incapaz de secuestrar al antagonista sin la capa, la capa es incapaz de secuestrar al antagonista sin la matriz y la matriz y la capa juntamente son capaces de secuestrar al antagonista.
5. Producto farmacéutico de cualquiera de las reivindicaciones 1 a 4 que comprende la matriz y la capa que secuestran al antagonista opioide en la forma posológica de forma tal que la relación de la cantidad de antagonista liberada desde la forma posológica tras manipulación indebida a la cantidad de antagonista liberada desde la forma posológica intacta en virtud de la disolución al cabo de 1, 2, 4, 12, 24 o 36 horas de la forma posológica en 700 ml de SGF usando un aparato USP Tipo II (de paletas) a 50 rpm a 37 grados C, pasándose tras 1 hora a 900 ml de SIF, es de aproximadamente 20:1 o más, aproximadamente 50:1 o más, aproximadamente 100:1 o más, aproximadamente 150:1 o más o aproximadamente 1000:1 o más, y/o
la matriz y la capa que secuestran al antagonista opioide en la forma posológica de forma tal que
el porcentaje en peso de antagonista liberado desde la forma posológica intacta en virtud de la disolución al cabo de 1 hora de la forma posológica en 700 ml de SGF usando un aparato USP Tipo II (de paletas) a 50 rpm a 37 grados C es de menos de un 1,0% en peso, menos de un 0,5% en peso, menos de un 0,2% en peso o menos de un 0,1% en peso y/o de forma tal que
el porcentaje en peso de antagonista liberado desde la forma posológica intacta en virtud de la disolución al cabo de 2 horas de la forma posológica en 700 ml de SGF usando un aparato USP Tipo II (de paletas) a 50 rpm a 37 grados C, pasándose al cabo de 1 hora a 900 ml de SIF, es de menos de un 2,0% en peso, menos de un 1,0% en peso, menos de un 0,5% en peso o menos de un 0,25% en peso y/o de forma tal que
el porcentaje en peso de antagonista liberado desde la forma posológica intacta en virtud de la disolución al cabo de 4 horas de la forma posológica en 700 ml de SGF usando un aparato USP Tipo II (de paletas) a 50 rpm a 37 grados C, pasándose al cabo de 1 hora a 900 ml de SIF, es de menos de un 2,2% en peso, menos de un 1,5% en peso, menos de un 1,0% en peso o menos de un 0,75% en peso y/o de forma tal que
el porcentaje en peso de antagonista liberado desde la forma posológica intacta en virtud de la disolución al cabo de 12 horas de la forma posológica en 700 ml de SGF usando un aparato USP Tipo II (de paletas) a 50 rpm a 37 grados C, pasándose al cabo de 12 horas a 900 ml de SIF, es de menos de un 3,0% en peso, menos de un 1,8% en peso, menos de un 1,25% en peso o menos de un 0,3% en peso y/o de forma tal que
el porcentaje en peso de antagonista liberado desde la forma posológica intacta en virtud de la disolución al cabo de 24 horas de la forma posológica en 700 ml de SGF usando un aparato USP Tipo II (de paletas) a 50 rpm a 37 grados C, pasándose al cabo de 1 hora a 900 ml de SIF, es de menos de un 4,8% en peso, menos de un 2,5% en peso, menos de un 1,8% en peso o menos de un 0,4% en peso, y/o de forma tal que
el porcentaje en peso de antagonista liberado desde la forma posológica intacta en virtud de la disolución al cabo de 36 horas de la forma posológica en 700 ml de SGF usando un aparato USP Tipo II (de paletas) a 50 rpm a 37 grados C, pasándose al cabo de 1 hora a 900 ml de SIF, es de menos de un 7,0% en peso, menos de un 6,5% en peso, menos de un 3,0% en peso o menos de un 1,5% en peso y/o
la matriz y la capa que secuestran al antagonista opioide en la forma posológica de forma tal que
la forma posológica intacta libera un 1,0% o menos de antagonista al cabo de 1 hora, un 2,0% en o menos de antagonista al cabo de 2 horas, un 2,2% o menos de antagonista al cabo de 4 horas, un 3,0% o menos de antagonista al cabo de 12 horas, un 4,8% o menos de antagonista al cabo de 24 horas, y un 7,0% o menos de antagonista al cabo de 36 horas, en virtud de la disolución de la forma posológica en 700 ml de SGF usando un aparato USP Tipo II (de paletas) a 50 rpm a 37 grados C por espacio de la primera hora, pasándose a continuación de ello a 900 ml de SIF, y/o de forma tal que la forma posológica intacta libera un 0,5% o menos de antagonista al cabo de 1 hora, un 1,0% o menos de antagonista al cabo de 2 horas, un 1,5% o menos de antagonista al cabo de 4 horas, un 1,8% o menos de antagonista al cabo de 12 horas, un 2,5% o menos de antagonista al cabo 24 horas y un 6,5% o menos de antagonista al cabo de 36 horas en virtud de la disolución de la forma posológica en 700 ml de SGF usando un aparato USP Tipo II (de paletas) a 50 rpm a 37 grados C por espacio de la primera hora, pasándose a continuación de ello a 900 ml de SIF, y/o de forma tal que la forma posológica intacta libera un 0,2% o menos de antagonista al cabo de 1 hora, un 0,5% o menos de antagonista al cabo 2 horas, un 1,0% o menos de antagonista al cabo de 4 horas, un 1,25% o menos de antagonista al cabo de 12 horas, un 1,8% o menos de antagonista al cabo de 24 horas, y un 3,0% o menos de antagonista al cabo de 36 horas en virtud de la disolución de la forma posológica en 700 ml de SGF usando un aparato USP Tipo II (de paletas) a 50 rpm a 37 grados C por espacio de la primera hora, pasándose a continuación de ello a 900 ml de SIF, y/o de forma tal que la forma posológica intacta libera un 0,1% o menos de antagonista al cabo 1 hora, un 0,25% o menos de antagonista al cabo 2 horas, un 0,75% o menos de antagonista al cabo de 4 horas, un 0,3% o menos de antagonista al cabo de 12 horas, un 0,4% o menos de antagonista al cabo de 24 horas, y un 1,5% o menos de antagonista al cabo de 36 horas en virtud de la disolución de la forma posológica en 700 ml de SGF usando un aparato USP Tipo II (de paletas) a 50 rpm a 37 grados C por espacio de la primera hora, pasándose a continuación de ello a 900 ml de SIF, y/o
donde el porcentaje en peso de agonista liberado desde la forma posológica tras manipulación indebida en virtud de la disolución al cabo de 1 hora de la forma posológica en 700 ml de SGF usando un aparato USP Tipo II (de paletas) a 50 rpm a 37 grados C es de menos de un 50% en peso, menos de un 40% en peso, o menos de un 35% en peso y/o
donde la relación de la Cmáx media de antagonista que se tiene tras la administración de una sola dosis de una forma posológica manipulada indebidamente a una población de pacientes a la Cmáx media de antagonista que se tiene tras la administración de una sola dosis de una forma posológica intacta a una población de pacientes es de aproximadamente 20:1, aproximadamente 100:1, aproximadamente 125:1, aproximadamente 150:1 o más, y/o
donde la relación del AUC media de antagonista que se tiene tras la administración de una sola dosis de una forma posológica manipulada indebidamente a una población de pacientes al AUC media de antagonista que se tiene tras la administración de una sola dosis de una forma posológica intacta a una población de pacientes es de aproximadamente 5:1 o aproximadamente 25:1 o aproximadamente 75:1 o aproximadamente 200:1 o más.
6. El producto farmacéutico de cualquiera de las reivindicaciones precedentes, donde las partículas con antagonista opioide tienen un diámetro medio de aproximadamente 0,1 a aproximadamente 6,0 mm, teniendo las de la pluralidad de partículas preferiblemente un diámetro medio de aproximadamente 0,1 a aproximadamente 3 mm y/o donde la cantidad de antagonista opioide que es liberada tras la ingestión de una forma posológica manipulada indebidamente es eficaz para bloquear el efecto euforizante del agonista opioide.
7. Producto farmacéutico de cualquiera de las reivindicaciones precedentes, donde las partículas con agonista y las partículas con antagonista son similares o virtualmente indistinguibles en cuanto a una propiedad seleccionada de entre los miembros del grupo que consta del aspecto, la textura, el olor, el sabor, la dureza, la forma, el tamaño o una combinación de las mismas.
8. Producto farmacéutico según cualquiera de las reivindicaciones precedentes, que comprende
una pluralidad de partículas extrusionadas que comprenden aproximadamente 2 mg de naltrexona o una sal farmacéuticamente aceptable dispersada en una matriz; y una capa que cubre al menos una parte de las partículas; secuestrando la matriz y la capa a la naltrexona o sal de la misma en la forma posológica de forma tal que la forma posológica intacta libera 0,065 mg o preferiblemente 0,04 mg o menos de antagonista al cabo de 36 horas, en virtud de la disolución de la forma posológica en 700 ml de SGF por espacio de una hora y luego en 900 ml de SIF a continuación de ello usando un aparato USP Tipo II (de paletas) a 50 rpm a 37 grados C o una pluralidad de partículas extrusionadas que comprenden aproximadamente 8 mg de naltrexona o una sal farmacéuticamente aceptable dispersada en una matriz; y una capa que cubre al menos una parte de las partículas; secuestrando la matriz y la capa a la naltrexona o sal de la misma en la forma posológica de forma tal que la forma posológica intacta libera 0,08 mg o menos de antagonista al cabo 36 horas, en virtud de la disolución de la forma posológica en 700 ml de SGF por espacio de una hora y luego en 900 ml de SIF a continuación de ello usando un aparato USP Tipo II (de paletas) a 50 rpm a 37 grados C.
9. Producto farmacéutico según cualquiera de las reivindicaciones precedentes, que comprende
10. El producto farmacéutico de la reivindicación 9, donde el naltrexona clorhidrato está en una cantidad de aproximadamente 2 mg a aproximadamente 12 mg o de aproximadamente 2 mg a aproximadamente 8 mg y/o donde las partículas con naltrexona clorhidrato comprenden más de un 90%, y preferiblemente más de un 95% de material hidrofóbico.
11. El producto farmacéutico de cualquiera de las reivindicaciones precedentes, donde la capa está prácticamente desprovista de antagonista y/o donde la forma posológica está desprovista de antagonista de liberación inmediata y/o donde las partículas con antagonista opioide tienen un diámetro medio de aproximadamente 0,1 a aproximadamente 6,0 mm.
12. Producto farmacéutico según cualquiera de las reivindicaciones precedentes: donde la capa comprende un polímero acrílico y un polímero celulósico en disposición bilaminar.
13. El producto farmacéutico de cualquiera de las reivindicaciones precedentes, donde las partículas con antagonista opioide se forman a base de
14. Método de preparación de un producto farmacéutico según cualquiera de las reivindicaciones precedentes, comprendiendo dicho método los pasos de:
15. Método de preparación de un producto farmacéutico según cualquiera de las reivindicaciones 1 a 13, comprendiendo dicho método los pasos de:
16. Uso de un producto farmacéutico según cualquiera de las reivindicaciones 1 a 13 para fabricar un medicamento para administración oral para tratar el dolor.
Patentes similares o relacionadas:
Regímenes de dosificación de buprenorfina, del 1 de Julio de 2020, de Indivior UK Limited: Buprenorfina para su uso en un método para tratar el trastorno por uso de opioides en un ser humano que lo necesite, que comprende las etapas […]
 Forma de dosificación llena de líquido, disuasoria del abuso y de liberación inmediata, del 24 de Junio de 2020, de Pharmaceutical Manufacturing Research Services, Inc: Una cápsula disuasoria del abuso de liberación inmediata, que comprende:
(a) un principio activo susceptible de abuso;
(b) un primer polietilenglicol (PEG) […]
Forma de dosificación llena de líquido, disuasoria del abuso y de liberación inmediata, del 24 de Junio de 2020, de Pharmaceutical Manufacturing Research Services, Inc: Una cápsula disuasoria del abuso de liberación inmediata, que comprende:
(a) un principio activo susceptible de abuso;
(b) un primer polietilenglicol (PEG) […]
Gránulos de dispersión rápida, comprimidos de desintegración oral y métodos, del 3 de Junio de 2020, de Adare Pharmaceuticals, Inc: Microgránulos de dispersión rápida, farmacéuticamente aceptables, que tienen una mediana del tamaño de partícula en el rango de 100 μm a 300 […]
Pulverizador de buprenorfina sublingual, del 22 de Abril de 2020, de Fresh Cut Development, LLC: Una formulación de pulverización sublingual que comprende una cantidad efectiva de buprenorfina, o una sal farmacéuticamente aceptable de la misma, […]
Dispositivos de administración transdérmica resistentes al abuso y composiciones que comprenden un agonista de opioides y un derivado N-óxido no administrado por vía transdérmica de un antagonista de opioide para el tratamiento del dolor, del 22 de Abril de 2020, de EURO-CELTIQUE S.A.: Un dispositivo de administración transdérmica que comprende una composición farmacéutica, en el que dicha composición comprende un derivado […]
Formulación farmacéutica a base de ibuprofeno y codeína que tiene estabilidad mejorada, del 15 de Abril de 2020, de FARMASIERRA MANUFACTURING S.L: Formulación farmacéutica a base de ibuprofeno y codeínade estabilidad mejorada. La invención consiste en una nueva formulación farmacéuticaen forma […]
Parche transdérmico de oximorfona, del 8 de Abril de 2020, de Buzzz Pharmaceuticals Limited: Un parche transdérmico que tiene una capa que contiene el fármaco que comprende oximorfona o una sal farmacéuticamente aceptable de la misma, […]
Composiciones de buprenorfina y antagonistas del receptor de opioides mu, del 1 de Abril de 2020, de Alkermes Pharma Ireland Limited: Una composición que comprende buprenorfina y un antagonista del receptor opioide μ, en donde la composición está caracterizada por un Índice […]