Proceso para la producción de 3-oxo-pregn-4-en-21,17-carbolactonas por la oxidación sin metales de 17-(3-hidroxipropil)-3,17-dihidroxiandrostanos.
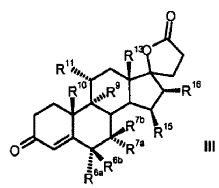
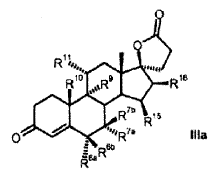
Proceso para la producción de 3-oxo-17alfa-pregn-4-en-21,17-carbolactonas de la fórmula III (Ver fórmula) en donde son:
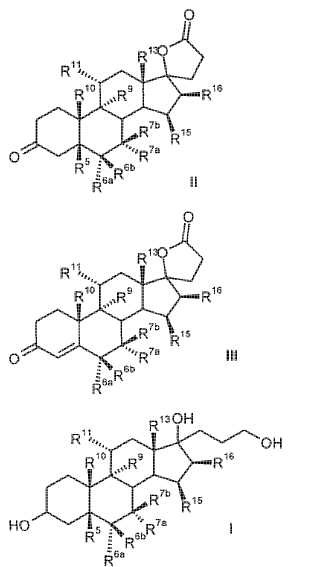
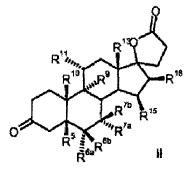
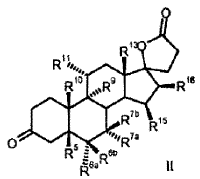
R 6a hidrógeno, o junto con R 7a un grupo -CH2-; R 6b hidrógeno, junto con R 7b un grupo -CH2- o un enlace doble; R 7a hidrógeno, alquilo C1-C4, alcoxicarbonilo C1-C4, tio-acilo C1-C4 o junto con R 6a un grupo -CH2-; R 7b hidrógeno, o junto con R 6b un grupo -CH2-; R 9 hidrógeno, junto con R 11 un enlace doble o junto con R 11 un grupo epoxi -O-; R 10 hidrógeno, metilo, etilo; R 11 hidrógeno, junto con R 9 un enlace doble o junto con R 9 un grupo epoxi -O-; R 13 hidrógeno, metilo, etilo; R 15 hidrógeno, alquilo C1-C4, junto con R 16 un grupo -CH2- o un enlace doble; R 16 hidrógeno, junto con R 15 un grupo -CH2- o un enlace doble; que comprende los pasos siguientes: a) la transformación de compuestos de la fórmula general I (Ver fórmula) en donde R 5 es hidroxi; y los restos R 6a , R 6b , R 7a , R 7b , R 10 , R 11 , R 13 , R 15 , R 16 tienen el mismo significado que en la fórmula III, con al menos 3 equivalentes molares de un hipoclorito orgánico o inorgánico como agente oxidante en presencia de 1-5% molar de un derivado de N-óxido de 2,2,6,6-tetrametilpiperidina a un valor de pH de al menos 8,0 y a una temperatura de 0-15ºC en una mezcla bifásica diclorometano-agua, para dar los compuestos de la fórmula II (Ver fórmula) b) eliminación subsiguiente del agua a pH< 5, opcionalmente en presencia de un ácido.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E05090214.
Solicitante: Bayer Pharma Aktiengesellschaft.
Nacionalidad solicitante: Alemania.
Dirección: MULLERSTRASSE 178 13353 BERLIN ALEMANIA.
Inventor/es: SEILZ, CARSTEN, SEBA,HARTMUT.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07J53/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07J ESTEROIDES (seco-steroides C07C). › Esteroides teniendo la estructura del ciclopenta [a] hidrofenantreno modificada por condensación con ciclos carbocíclicos o por formación de un ciclo adicional por un enlace directo entre dos átomos de carbono cíclicos.
PDF original: ES-2311927_T3.pdf
Fragmento de la descripción:
Proceso para la producción de 3-oxo-pregn-4-en-21, 17-carbolactonas por la oxidación sin metales de 17- (3-hidroxipropil) -3, 17-dihidroxiandrostanos.
La presente invención se refiere a un proceso para la producción de 3-oxo-pregn-4-en-21, 17-carbolactonas, particularmente un proceso para la producción de 3-oxo-17α-pregn-4-en-21, 17-carbolactonas. Adicionalmente, la invención se refiere al hemisolvato con diclorometano de 6β, 7β;15β, 16β-dimetilen-3-oxo-17α-pregnan-5β-ol-21, 17-carbolactona.
Ejemplos de esteroide-21, 17-carbolactonas farmacológicamente activas son eplerenona (9α, 11α-epoxi-7α-metoxicarbonil-3-oxo-17α-pregn-4-en-21, 17-carbolactona) , drospirenona (6β, 7β;15β, 16β-dimetilen-3-oxo-17α-pregn-4-en-21, 17-carbolactona) , espironolactona (7α-acetiltio-3-oxo-17α-preg-4-en-21, 17-carbolactona) , canrenona (3-oxo-17α-pregna-4, 6-dien-21, 17-carbolactona) , y prorrenona (6β, 7β-metilen-3-oxo-17α-pregna-4, 6-dien-21, 17-carbolactona) .
La síntesis de la esteroide-21, 17-espirolactona puede realizarse por oxidación del 17-hidroxi-17- (3-hidroxipropil) esteroide correspondiente

con agentes de oxidación apropiados como ácido crómico (Sam et al. J. Med. Chem. 1995, 38, 4518-4528) , clorocromato de piridinio (EP 075189) , dicromato de piridinio (Bittler et al; Angew. Chem. 1982, 94, 718-719; Nickisch et al. Liebigs Ann. Chem. 1988, 579-584) , o bromato de potasio en presencia de un catalizador de rutenio (EP 918 791) . Un inconveniente en los procesos de oxidación de la técnica anterior con derivados de cromo (VI) es la formación muy acusada de subproductos por una multiplicidad de reacciones secundarias, con lo cual se dificulta el aislamiento del producto puro, y se reduce el rendimiento. El perfil de subproductos se mejora de hecho por la oxidación catalizada con rutenio (EP 918 791) y con ello aumenta también el rendimiento. Sin embargo, el empleo de metales de transición en la producción de agentes activos farmacéuticos adolece por regla general del inconveniente de que la separación de las trazas de metales pesados va ligada siempre a un coste elevado. Adicionalmente, se forman durante la producción grandes cantidades de residuos que contienen metales pesados, que solo pueden eliminarse por medios complejos y caros.
El objeto de la presente invención radica en proporcionar un proceso alternativo para la producción de 3-oxo-pregn-4-en-21, 17-carbolactonas a partir de los correspondientes 17- (3-hidroxipropil) -3, 17-dihidroxi-androstanos, que permite producir los compuestos objetivo con rendimiento y pureza elevados. Este objeto se ha resuelto de acuerdo con la invención por un proceso que comprende los pasos siguientes:
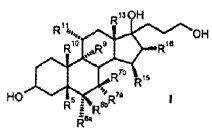
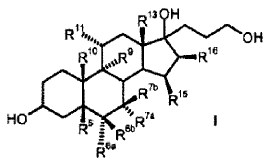
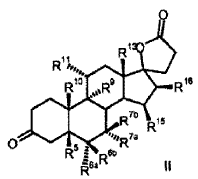
a) la transformación de los compuestos de la fórmula general I

en donde son
R5 R6a R6b R7a R7b R9 R10 R11 R13 R15 R16 con al menos 3 equivalentes molares de un hipoclorito orgánico o inorgánico como agente de oxidación en presencia de 1-5% molar de un derivado de 2, 2, 6, 6-tetrametilpiperidin-N-óxido a un valor de pH de al menos 8, 0 y a una temperatura de 0-15ºC en una mezcla bifásica diclorometano-agua, para dar los compuestos de la fórmula II b) eliminación subsiguiente del agua a pH < 5, opcionalmente en presencia de un ácido. El objetivo se ha resuelto de acuerdo con la invención alternativamente por un proceso que comprende los pasos siguientes: a) la transformación de compuestos de la fórmula general I en donde son R5 R6a R6b R7a R7b R9 R10 R11 R13 R15 R16 con al menos 3 equivalentes molares de un hipoclorito orgánico o inorgánico como agente de oxidación en presencia de cantidades catalíticas de un derivado de 2, 2, 6, 6-tetrametilpiperidin-N-óxido a un valor de pH de al menos 8, 0 en una mezcla bifásica diclorometano-agua, para dar los compuestos de la fórmula II b) aislamiento del compuesto de fórmula II, c) eliminación subsiguiente de agua a pH < 5, opcionalmente en presencia de un ácido. Oxidaciones sin metales de alcoholes para dar los aldehídos, cetonas, ácidos carboxílicos, lactoles y lactonas correspondientes se recogen en el artículo de revisión de W. Adam et al., Chem. Rev. 2001, 101, 3499-3548. Oxidaciones sin metales en presencia de 2, 2, 6, 6-tetrametilpiperidin-N-óxido (TEMPO) han sido descritas por van Bekkum et al. Synthesis 1996, 1153-1174. Los alcoholes primarios pueden oxidarse con bromito de sodio (NaBrO2) o hipoclorito de calcio [Ca (OCl) 2] en presencia de derivados de TEMPO para dar aldehídos oxidarse [S. Torii et al. J. Org. Chem. 1990, 55, 462-466]. Como agente de oxidación puede emplearse también hipoclorito de sodio (NaOCl) (Org. Synth. 69, 212) . La oxidación de alcoholes secundarios o cetonas y particularmente la oxidación de alcoholes primarios a ácidos carboxílicos (v.g. por medio de dioles apropiados para dar lactonas requiere un cocatalizador (P.L. Anelli et al, J. Org. Chem. 1987, 52, 2559-2562) . Como cocatalizador se emplea un bromuro (por regla general KBr o NaBr) . La adición de iones bromuro puede ser apropiada incluso para la oxidación de alcoholes primarios a aldehídos (P.L. Anelli et al, J. Org. Chem. 1987, 52, 2559-2562) . Inconveniente en la utilización de bromuros como cocatalizador es el riesgo de la formación de subproductos que contienen bromo en las condiciones de oxidación. Este método de oxidación es particularmente apropiado para la oxidación de alcoholes primarios a los aldehídos respectivos. Sin adición de bromuro, la oxidación catalizada por TEMPO de alcoholes secundarios a las cetonas correspondientes requiere grandes excesos del... [Seguir leyendo]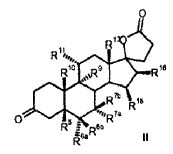
Reivindicaciones:
1. Proceso para la producción de 3-oxo-17α-pregn-4-en-21, 17-carbolactonas de la fórmula III
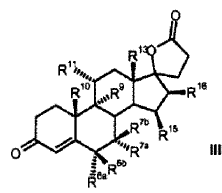
en donde son:
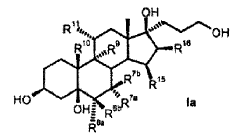
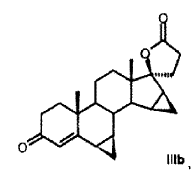
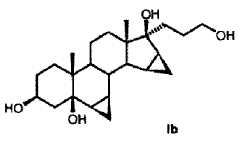
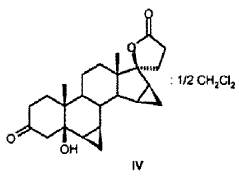
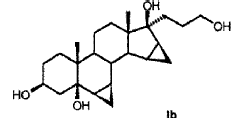
R6a R6b R7a R7b R9 R10 R11 R13 R15 R16 que comprende los pasos siguientes: a) la transformación de compuestos de la fórmula general I en donde R5 los restos R6a, R6b, R7a, R7b, R10, R11, R13, R15, R16 tienen el mismo significado que en la fórmula III, con al menos 3 equivalentes molares de un hipoclorito orgánico o inorgánico como agente oxidante en presencia de 1-5% molar de un derivado de N-óxido de 2, 2, 6, 6-tetrametilpiperidina a un valor de pH de al menos 8, 0 y a una temperatura de 0-15ºC en una mezcla bifásica diclorometano-agua, para dar los compuestos de la fórmula II b) eliminación subsiguiente del agua a pH < 5, opcionalmente en presencia de un ácido. 2. Proceso para la producción de 3-oxo-pregn-4-en-21, 17-carbolactonas de la fórmula III en donde son: R6a R6b R7a R7b R9 R10 R11 R13 R15 R16 que comprende los pasos siguientes: a) la transformación de compuestos de la fórmula general I donde R5 los restos R6a, R6b, R7a, R7b, R10, R11, R13, R15, R16 tienen el mismo significado que en la fórmula III, con al menos 3 equivalentes molares de un hipoclorito orgánico o inorgánico como agente oxidante en presencia de cantidades catalíticas de un derivado de N-óxido de 2, 2, 6, 6-tetrametilpiperidina a un valor de pH de al menos 8, 0 en una mezcla bifásica diclorometano-agua, para dar los compuestos de la fórmula II b) aislamiento del compuesto de la fórmula II, c) eliminación subsiguiente del agua a pH < 5, opcionalmente en presencia de un ácido. 3. Proceso según la reivindicación 1 ó 2 para la producción de 3-oxo-17α-pregn-4-en-21, 17-carbolactonas de la fórmula IIIa en donde pueden ser: R6a R6b R7a R7b R9 R10 R11 R15 R16 caracterizado porque se transforman compuestos de la fórmula Ia 4. Proceso según cualquiera de las reivindicaciones anteriores para la producción del compuesto de la fórmula IIb donde se emplea como compuesto de partida el compuesto de la fórmula Ib 5. Proceso para la producción del Hemisolvato con diclorometano IV: que comprende los pasos siguientes: a) la transformación del compuesto de la fórmula Ib con al menos 3 equivalentes molares de un hipoclorito orgánico o inorgánico como agente oxidante en presencia de cantidades catalíticas de un derivado de N-óxido de 2, 2, 6, 6-tetrametilpiperidina a un valor de pH de al menos 8, 0 en una mezcla bifásica diclorometano-agua; b) aislamiento del compuesto IV. 6. Proceso según cualquiera de las reivindicaciones 2 a 5 anteriores, caracterizado porque se emplea 1-5% molar del derivado de N-óxido de 2, 2, 6, 6-tetrametilpiperidina. 7. Proceso según cualquiera de las reivindicaciones anteriores caracterizado porque se emplea 1-1, 5% molar de 2, 2, 6, 6-tetrametilpiperidin-N-óxido. 8. Proceso según cualquiera de las reivindicaciones anteriores, caracterizado porque se emplean 3-6 equivalentes molares de hipoclorito alcalino. 9. Proceso según cualquiera de las reivindicaciones anteriores, caracterizado porque se emplean 3-4 equivalentes molares de hipoclorito de sodio. 10. Proceso según cualquiera de las reivindicaciones anteriores, caracterizado porque el valor de pH de la solución de reacción está comprendido entre 8, 5 y 10, 0. 11. Proceso según cualquiera de las reivindicaciones anteriores, caracterizado porque el valor de pH de la solución de reacción se ajusta con hidrogenocarbonato de potasio. 12. Proceso según cualquiera de las reivindicaciones anteriores, caracterizado porque la temperatura de reacción es de 0 a 15ºC. 13. Proceso según cualquiera de las reivindicaciones anteriores, caracterizado porque, una vez terminada la reacción de oxidación, se añade a la mezcla de reacción un agente reductor para la destrucción del reactivo hipoclorito en exceso. 14. Proceso según la reivindicación 13, caracterizado porque el agente reductor se añade con adición de una base o de un tampón básico a un valor de pH superior a 5. 15. Proceso según la reivindicación 13 ó 14, caracterizado porque como agente reductor se utiliza una solución acuosa de hidrogenosulfito alcalino. 16. Proceso según cualquiera de las reivindicaciones 13 a 15, caracterizado porque como agente reductor se utiliza hidrogenosulfito de sodio o hidrogenosulfito de potasio en forma de la solución acuosa de disulfito de sodio o disulfito de potasio. 17. Proceso según cualquiera de las reivindicaciones 14 a 16, caracterizado porque se utiliza como base o tampón básico fosfato de sodio (Na3PO4) . 18. Hemisolvato con diclorometano de 6β, 7β;15β, 16β-dimetilen-3-oxo-17α-pregnan-5β-ol-21, 17-carbolactona. 19. Proceso para la producción de drospirenona, caracterizado porque se transforma hemisolvato con diclorometano de 6β, 7β;15β, 16β-dimetilen-3-oxo-17α-pregnan-5β-ol-21, 17-carbolactona (IV) con un ácido. 20. Proceso según la reivindicación 19, en el que el ácido es ácido sulfúrico, ácido clorhídrico o ácido paratoluenosulfónico.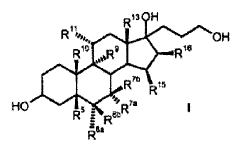
Patentes similares o relacionadas:
Método para la separación de los constituyentes isoprénicos de guayule, del 6 de Noviembre de 2019, de versalis S.p.A: Método para la separación de al menos un constituyente isoprénico de la resina de una planta de guayule y/o de tipo guayule que comprende las etapas de: […]
 Composición farmacéutica que comprende una suspensión acuosa de un derivado de androstano para el tratamiento de afecciones inflamatorias y alérgicas, del 11 de Febrero de 2019, de GLAXO GROUP LIMITED: Una formulación farmacéutica que comprende:
(i) una suspensión acuosa de un compuesto en partículas de fórmula (I)**Fórmula**
o un solvato de […]
Composición farmacéutica que comprende una suspensión acuosa de un derivado de androstano para el tratamiento de afecciones inflamatorias y alérgicas, del 11 de Febrero de 2019, de GLAXO GROUP LIMITED: Una formulación farmacéutica que comprende:
(i) una suspensión acuosa de un compuesto en partículas de fórmula (I)**Fórmula**
o un solvato de […]
Composiciones que comprenden un lofenol, del 23 de Enero de 2019, de MORINAGA MILK INDUSTRY CO., LTD.: Utilización no terapéutica de un compuesto de lofenol para mejorar o prevenir un síntoma de la piel seleccionado entre el grupo que comprende […]
Procedimiento de producción de 3-oxo-pregn-4-en-21,17-carbolactonas por la oxidación libre de metal de 17-(3-hidroxipropil)-3,17-dihidroxiandrostanos, del 3 de Enero de 2018, de Bayer Intellectual Property GmbH: Un procedimiento de producción de 3-oxo-17α-pregn-4-en-21,17-carbolactonas de fórmula IIIa **(Ver fórmula)** en la que R6a es hidrógeno o, junto con R7a, […]
Formulación farmacéutica que comprende un derivado de androstano y un agente de solubilización en un vehículo líquido acuoso, del 18 de Octubre de 2017, de GLAXO GROUP LIMITED: Una formulación farmacéutica que comprende un vehículo acuoso líquido que se ha disuelto en el mismo (a) un glucocorticoide de fórmula (I) **(Ver fórmula)** […]
Proceso para la preparación de drospirenona, del 13 de Septiembre de 2017, de INDUSTRIALE CHIMICA S.R.L.: Procedimiento para la preparación de drospirenona (I), que comprende la reacción de transformación de 17α-(3- hidroxipropil)-6ß,7ß;15ß,16ß-dimetilen-5ß-androstan-3ß,5,17ß-triol […]
Agente para mejorar la resistencia a la insulina, del 1 de Marzo de 2017, de MORINAGA MILK INDUSTRY CO., LTD.: Un agente para uso en el tratamiento de una enfermedad seleccionada de tolerancia anormal a la glucosa e hiperinsulinemia, que comprende un compuesto seleccionado de 9,19-ciclolanostan-3-ol […]
Proceso para la preparación de drospirenona, del 17 de Agosto de 2016, de INDUSTRIALE CHIMICA S.R.L.: 6ß,7ß;15ß,16ß-dimetilen-3ß,5ß-dihidroxi-17α-pregn-21,17-211α-carbolactol.