PROCESO PARA PREPARAR ACIDO 3ALFA(BETA)-7ALFA(BETA)-DIHIDROXI-6ALFA(BETA)-ALQUIL-5BETA-COLANICO.
Proceso para preparar para preparar ácidos 3a-7a(ß)-di-hidroxi-6a(ß)-alquil-5ß-colánicos de fórmula general (I)
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2006/062446.
Solicitante: ERREGIERRE S.P.A..
Nacionalidad solicitante: Italia.
Dirección: VIA FRANCESCO BARACCA, 19,24060 SAN PAOLO D'ARGON (BERGA.
Inventor/es: FERRARI, MASSIMO, PELLICCIARI, ROBERTO.
Fecha de Publicación: .
Fecha Concesión Europea: 30 de Diciembre de 2009.
Clasificación Internacional de Patentes:
- C07J9/00B
Clasificación PCT:
- A61K31/575 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › sustituidos en posición 17 beta por una cadena de al menos tres átomos de carbono, p. ej. colano, colestano, ergosterol, sitosterol.
- A61P9/10 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 9/00 Medicamentos para el tratamiento de trastornos en el aparato cardiovascular. › para enfermedades isquémicas o ateroscleróticas, p.ej. medicamentos antianginosos, vasodilatadores coronarios,medicamentos para el tratamiento del infarto de miocardio, de la retinopatía, de la insuficiencia cerebrovascular, de la arterioesclerosis renal.
- C07J9/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07J ESTEROIDES (seco-steroides C07C). › Esteroides normales que contienen carbono, hidrógeno, halógeno u oxígeno, sustituidos en posición 17beta por una cadena de más de dos átomos de carbono, p. ej. colano, colestano, coprostano.
Fragmento de la descripción:
Proceso para preparar ácido 3a(ß)-7a(ß)-dihidroxi-6a(ß)-alquil-5ß-colánico.
Ámbito de la presente invención
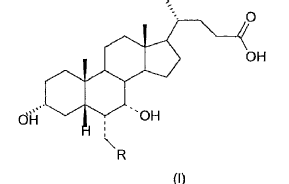
La presente invención se refiere a un proceso para preparar ácidos 3a-7a(ß)-dihidroxi-6a(ß)-alquil-5ß-colánicos.
Estado técnico
Los receptores de farnesoid X (FXR) son, en principio, receptores nucleares huérfanos, identificados por primera vez a partir de una biblioteca de ADNc de hígado de rata (B.M Forman y otros, Cell. 81:687-693 (1995)), y pertenecen a la familia de los receptores nucleares de factores de transcripción activados por ligandos, incluyendo los receptores de hormonas esteroideas, retinoides y tiroideas (D.J. Mangelsdorf y otros, Cell.83:841-850(1995)).
Varios ácidos biliares de tipo natural, y en particular los ácidos quenodesoxicólico, desoxicólico, litocólico y los respectivos conjugados con taurina y glicina, fijan y activan los FXR en concentraciones fisiológicas, tal como está descrito en la patente WO00/37077.
También se cree que los FXR intervienen en la regulación de la homeostasis de los ácidos biliares y del colesterol.
La patente WO 02/072598 describe ácidos 3-a,7-a-dihidroxi-6a-alquil-(alil)-5ß-colánicos de fórmula general (A)
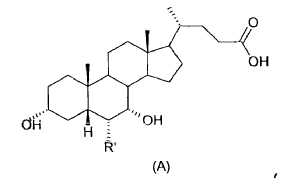
donde R' es etilo, propilo o alilo, que también son agonistas de receptores de farnesoid X.
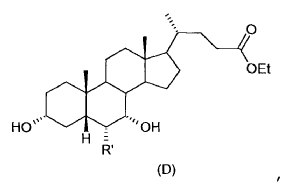
En concreto, el compuesto de la fórmula (I) en el cual R' = etilo es dos o más veces potente que el ácido quenodesoxicólico, el agonista natural de los FXR más potente.
Los compuestos de la fórmula (I) - usados especialmente para incrementar el colesterol HDL y disminuir los triglicéridos para la prevención y el tratamiento de enfermedades hepáticas de origen colestático - se preparan mediante un proceso que comprende las siguientes etapas:
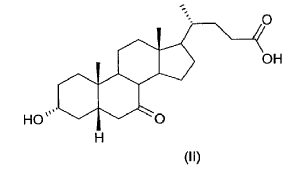
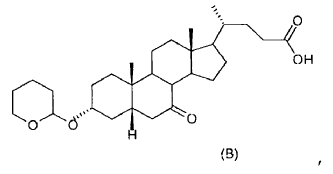
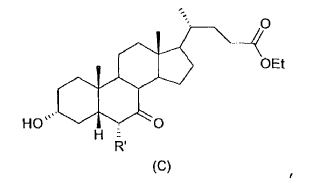
Aunque este proceso consta de pocas etapas, presenta una serie de inconvenientes.
En primer lugar, en todas las etapas, los productos de reacción se purifican en una columna cromatográfica, es decir un método de separación muy caro que no puede realizarse a escala industrial.
Además el rendimiento de la reacción en la etapa (ii) es extremadamente bajo (12-13%), con un descenso considerable del rendimiento global, que es inferior al 3,5%.
También en esta etapa, se usa como reactivo hexametilen-fosfonamida, que es un agente cancerígeno conocido.
Resumen de la presente invención
El solicitante ha encontrado ahora un proceso que permite obtener los compuestos de la fórmula general (I)

donde el enlace representado por una línea de trazos en la posición 6 y 7 indica que el sustituyente puede ir en posición a o ß, escogidos de la clase formada por:
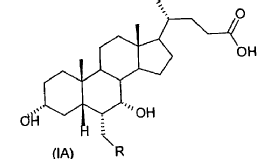
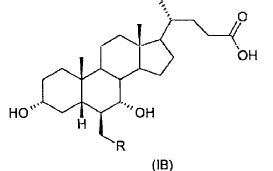
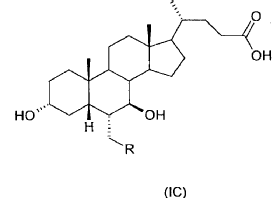
donde R es un alquilo C1-C5 lineal o ramificado, y que comprende las siguientes etapas
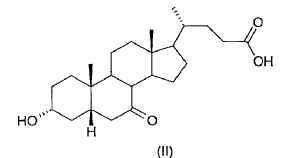
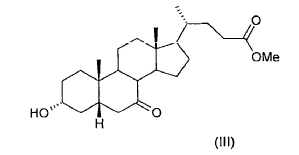
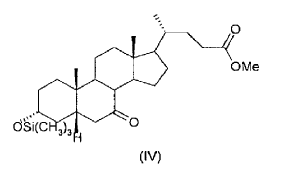
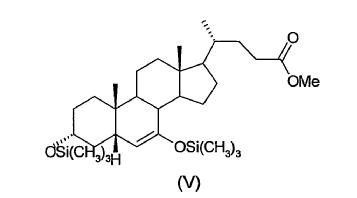


El proceso según la presente invención tiene considerables ventajas respecto a los...
Reivindicaciones:
1. Proceso para preparar para preparar ácidos 3a-7a(ß)-di-hidroxi-6a(ß)-alquil-5ß-colánicos de fórmula general (I)
donde el enlace representado por una línea de trazos en la posición 6 y 7 indica que el sustituyente puede ir en posición a o ß, escogidos de la clase formada por:

donde R es un alquilo C1-C5 lineal o ramificado, y que comprende las siguientes etapas

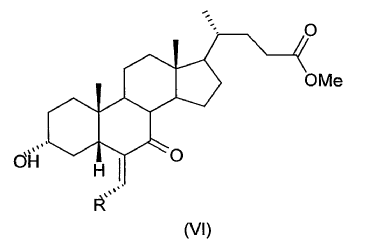
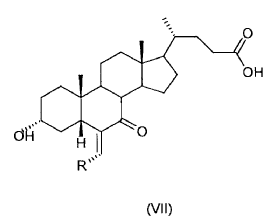

2. Proceso según la reivindicación 1, caracterizado porque la etapa (a) de esterificación se realiza a una temperatura entre 30 y 60ºC en un medio ácido.
3. Proceso según la reivindicación 2, caracterizado porque dicho ácido es el ácido metanosulfónico.
4. Proceso según una de las reivindicaciones 1-3, caracterizado porque la etapa de sililación (b) se efectúa en un disolvente apolar, en presencia de un aceptor de ion hidrógeno.
5. Proceso según la reivindicación 4, caracterizado porque dicho disolvente apolar es un disolvente aromático.
6. Proceso según la reivindicación 5, caracterizado porque dicho disolvente aromático es tolueno.
7. Proceso según la reivindicación 4-6, caracterizado porque dicho aceptor de ion hidrógeno es una amina terciaria de tipo alifático, alicíclico o heteroaromático.
8. Proceso según la reivindicación 7, caracterizado porque dicha amina terciaria es trietilamina.
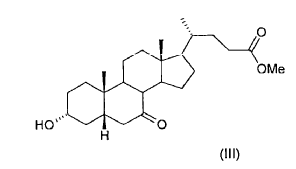
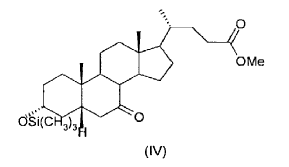
9. Proceso según una de las reivindicaciones 1-8, caracterizado porque el 3-a-trimetilsiloxi-7-ceto-5ß-colanato de metilo (IV) obtenido en la etapa (b) no se aísla ni se purifica antes de usarlo en la etapa (c).
10. Proceso según la reivindicación 9, caracterizado porque como reactivo (IV) en la etapa (c) se usa el residuo aceitoso obtenido tras evaporar el disolvente de reacción, del cual se han eliminado previamente las sales por extracción con agua.
11. Proceso según cualquiera de las reivindicaciones 1-10, caracterizado porque la subsiguiente sililación del grupo cetónico en la etapa (c) se efectúa empleando como base fuerte una amida alcalina obtenida de amoniaco o de una amina secundaria.
12. Proceso según la reivindicación 11, caracterizado porque dicha amida alcalina es diisopropilamida de litio.
13. Proceso según cualquiera de las reivindicaciones 1-12, caracterizado porque dicha etapa (c) se realiza en un disolvente aprótico polar.
14. Proceso según la reivindicación 13, caracterizado porque dicho disolvente aprótico polar es tetrahidrofurano.
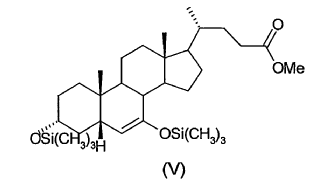
15. Proceso según cualquiera de las reivindicaciones 1-14, caracterizado porque el 3a-,7a-ditrimetilsiloxi-6-en-5ß-colanato de metilo (V) obtenido en la etapa (c) no se aísla ni se purifica antes de usarlo en la etapa (d).
16. Proceso según la reivindicación 15, caracterizado porque como reactivo (V) se emplea el residuo aceitoso obtenido tras evaporar el disolvente de reacción, del cual se han eliminado previamente las sales por extracción con agua.
17. Proceso según cualquiera de las reivindicaciones 1-16, caracterizado porque la etapa (d) se realiza en un disolvente apolar.
18. Proceso según la reivindicación 17, caracterizado porque dicho disolvente apolar es un haluro de alquilo.
19. Proceso según una de las reivindicaciones 17 y 18, en que dicho disolvente es cloruro de metileno.
20. Proceso según cualquiera de las reivindicaciones 1-19, caracterizado porque el ácido de Lewis es eterato de trifluoruro de boro.
21. Proceso según la reivindicación 20, caracterizado porque la etapa (d) se realiza según las siguientes condiciones operativas: la mezcla reactiva se enfría a una temperatura entre -90ºC y -60ºC durante un periodo de 2 a 4 horas y después se mantiene a una temperatura entre 0 y 35ºC durante un periodo de 1 a 6 horas.
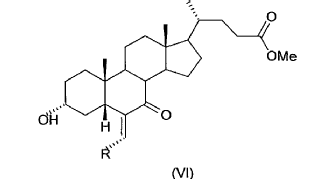
22. Proceso según cualquiera de las reivindicaciones 1-21, caracterizado porque el 3a-hidroxi-6-alquiliden-7-ceto-5ß-colanato de metilo (VI) obtenido en la etapa (d) no se aísla ni se purifica antes de usarlo en la siguiente etapa (e).
23. Proceso según la reivindicación 22, caracterizado porque la hidrólisis en la etapa (e) se realiza usando como reactivo (VI) el residuo aceitoso obtenido tras evaporar el disolvente de reacción, del cual se han eliminado previamente las sales y los componentes hidrosolubles por extracción con agua.
24. Proceso según cualquiera de las reivindicaciones 1-23, caracterizado porque la reacción de hidrólisis en la etapa (e) se efectúa en un disolvente alcohólico, en presencia de una solución acuosa de un hidróxido alcalino.
25. Proceso según la reivindicación 24, caracterizado porque dicha reacción se realiza a una temperatura entre 20 y 60ºC.
26. Proceso según cualquiera de las reivindicaciones 1-25, caracterizado porque la hidrogenación en la etapa (f) se realiza en un medio acuoso, en presencia de una solución acuosa de hidróxido sódico, a una presión entre 1 y 3 atmósferas.
27. Proceso según cualquiera de las reivindicaciones 1-26, caracterizado porque, cuando comprende la etapa (g), ésta se lleva a cabo directamente en la mezcla reactiva resultante de la etapa (f).
28. Proceso según la reivindicación 27, caracterizado porque dicha etapa (g) se realiza a una temperatura entre 95 y 105ºC durante unas pocas horas.
29. Proceso según cualquiera de las reivindicaciones 1-28, caracterizado porque el producto de reacción obtenido en la etapa (f) - cuando el proceso no incluye la etapa (g) - o de la etapa (g) se aísla de la mezcla reactiva conforme a las siguientes condiciones operativas:
30. Proceso según cualquiera de las reivindicaciones 1-29, caracterizado porque, cuando la reducción de la etapa (h) se efectúa según las condiciones operativas contempladas en la etapa (h') o (h''') el hidruro metálico es borohidruro sódico en una solución acuosa en la que se ha disuelto un hidróxido alcalino.
31. Proceso según la reivindicación 30, caracterizado porque dicho hidróxido alcalino es una solución de hidróxido sódico al 30%.
32. Proceso según la reivindicación 30-31, caracterizado porque la reacción se lleva a cabo a una temperatura entre 70 y 105ºC durante 1 hora.
33. Proceso según la reivindicación 30-32, caracterizado porque el producto obtenido se aísla según las siguientes condiciones operativas:
34. Proceso según cualquiera de las reivindicaciones 1-29, caracterizado porque, cuando la etapa (h) se realiza según las condiciones operativas (h'') la reacción de reducción se efectúa en un alcohol C1-C5 lineal o ramificado, a la temperatura de reflujo del disolvente.
35. Proceso según la reivindicación 34, caracterizado porque dicho alcohol es sec-butil alcohol.
36. Proceso según cualquiera de las reivindicaciones 1-35, en que R es preferiblemente metilo.
37. Proceso según cualquiera de las reivindicaciones 1-30 para preparar ácido 3-a,7-a-dihidroxi-6a-etil-5b-colánico.
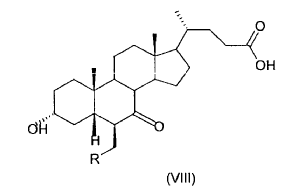
38. Ácido 3-a-hidroxi-6ß-alquil-7-ceto-5ß-colánico (VIII)
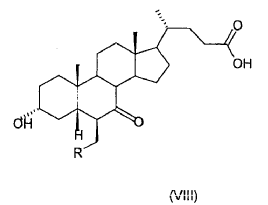
donde R es un alquilo C1-C5 lineal o ramificado.
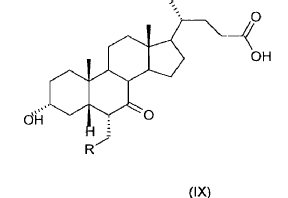
39. Ácido 3-a-hidroxi-6-a-alquil-7-ceto-5ß-colánico (IX)
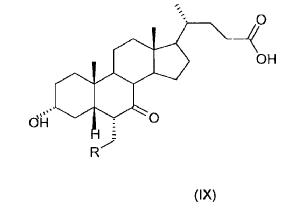
donde R es un alquilo C1-C5 lineal o ramificado.
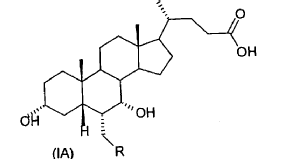
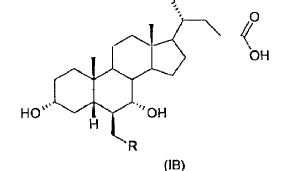
40. Ácido 3-a,7-a-dihidroxi-6-ß-alquil-5ß-colánico de fórmula general (IB)
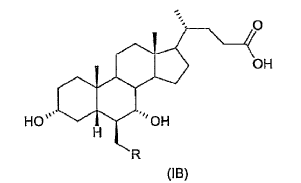
donde R es un alquilo C1-C5 lineal o ramificado.
41. Ácido 3-a,7-ß-dihidroxi-6-a-alquil-5ß-colánico de formula general (IC)

donde R es un alquilo C1-C5 lineal o ramificado.
42. Composición farmacéutica que lleva como ingrediente activo al menos uno de los ácidos 3-a,7-a-dihidroxi-6-ß-alquil-5ß-colánicos según la reivindicación 40 o las respectivas sales farmacéuticamente aceptables, en combinación con excipientes y/o diluyentes adecuados.
43. Composición farmacéutica que lleva como ingrediente activo al menos uno de los ácidos 3-a,7-ß-dihidroxi-6-a-alquil-5ß-colánicos según la reivindicación 41 y las respectivas sales farmacéuticamente aceptables, en combinación con excipientes y/o diluyentes adecuados.
Patentes similares o relacionadas:
 NUEVOS AMIDODERIVADOS DE ACIDOS BILLARES FUNCIONALIZADOS EN LA POSICION 3 DEL ANILLO A. PROCEDIMIENTOS PARA SU OBTENCION Y APLICACIONES, del 16 de Febrero de 2009, de UNIVERSIDADE DE SANTIAGO COMPOSTELA: Nuevos amidoderivados de ácidos biliares funcionalizados en la posición 3 del anillo A y procedimientos para su obtención y aplicaciones. Los nuevos compuestos resultan de la […]
NUEVOS AMIDODERIVADOS DE ACIDOS BILLARES FUNCIONALIZADOS EN LA POSICION 3 DEL ANILLO A. PROCEDIMIENTOS PARA SU OBTENCION Y APLICACIONES, del 16 de Febrero de 2009, de UNIVERSIDADE DE SANTIAGO COMPOSTELA: Nuevos amidoderivados de ácidos biliares funcionalizados en la posición 3 del anillo A y procedimientos para su obtención y aplicaciones. Los nuevos compuestos resultan de la […]
Compuestos heterocíclicos que activan AMPK y métodos de uso de los mismos, del 29 de Julio de 2020, de RIGEL PHARMACEUTICALS, INC.: Un compuesto que es N-((cis)-1-(4-cianobencil)-3-fluoropiperidin-4-il)-6-(4-(4-metoxibenzoil)piperidin-1-carbonil)nicotinamida; N-((3S,4S)-1-(4-cianobencil)-3-fluoropiperidin-4-il)-6-(4-(4-metoxibenzoil)piperidin-1-carbonil)nicotinamida; […]
Administración intravascular de composiciones de nanopartículas y usos de las mismas, del 29 de Julio de 2020, de ABRAXIS BIOSCIENCE, LLC: Una composición que comprende nanopartículas que comprenden rapamicina y albúmina para su uso en un procedimiento para inhibir la remodelación […]
Composición para el tratamiento de enfermedades isquémicas o trastornos inflamatorios neurogénicos, que contienen el secretoma de células progenitoras neurales como ingrediente activo, del 22 de Julio de 2020, de S-BIOMEDICS: Una composición para uso en el tratamiento de enfermedad cerebrovascular isquémica, cardiopatía isquémica, infarto de miocardio, enfermedad de Alzheimer, enfermedad […]
Antagonistas del receptor CB1, del 8 de Julio de 2020, de INSERM (INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE): Pregnenolona para su uso en el tratamiento de una afección o trastorno patológico seleccionado del grupo que consiste en adicción al cannabis, dependencia, abuso, […]
Composición autoemulsionante de ácidos grasos omega-3, del 24 de Junio de 2020, de MOCHIDA PHARMACEUTICAL CO., LTD.: Una preparación autoemulsionante encapsulada que tiene una composición autoemulsionante que comprende, cuando se define que la composición autoemulsionante […]
Moléculas químicas que inhiben el mecanismo de corte para tratar enfermedades causadas por anomalías de empalme, del 17 de Junio de 2020, de CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE (C.N.R.S.): Un compuesto elegido entre el grupo que comprende: • N-(3-Dimetilamino-propil)-3-(4-trifluorometoxi-fenilamino)-benzamida; • 4-(4-Metoxi-fenilamino)-3-metil-N-(3-metil-butil)-benzamida; […]
Sales de butirato para uso en enfermedades inflamatorias, del 17 de Junio de 2020, de Birrbeheer B.V: Una preparación que comprende una sal de butirato para uso en el tratamiento de un sujeto que padece una enfermedad que está asociada con inflamación sistémica, […]