PROCESO PARA LA PREPARACION DE ZIPRASIDONA.
Proceso para la preparación de la sal de hidrocloruro de ziprasidona de fórmula I,
teniendo una pureza de, como mínimo, 99,9% y el contenido total de impurezas inferior al 0,1% cuando se determina por HPLC,
Tipo: Resumen de patente/invención. Número de Solicitud: W05000512IB.
Solicitante: RANBAXY LABORATORIES LIMITED.
Nacionalidad solicitante: India.
Dirección: PLOT NO. 90, SECTOR-32 GURGAON,HARYANA 122001, DELHI.
Inventor/es: KUMAR, YATENDRA, AHUJA, SEEMA, PRASAD,MOHAN, KHANNA,MAHIVIR,SINGH.
Fecha de Publicación: .
Fecha Concesión Europea: 9 de Diciembre de 2009.
Clasificación Internacional de Patentes:
- C07D417/12 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 417/00 Compuestos heterocíclicos que contienen dos o más heterociclos, teniendo al menos un ciclo átomos de nitrógeno y azufre como únicos heteroátomos del ciclo, no previstos por el C07D 415/00. › unidos por una cadena que contiene heteroátomos como enlaces de cadena.
Clasificación PCT:
- C07D417/12 C07D 417/00 […] › unidos por una cadena que contiene heteroátomos como enlaces de cadena.
Clasificación antigua:
- C07D417/12 C07D 417/00 […] › unidos por una cadena que contiene heteroátomos como enlaces de cadena.
Fragmento de la descripción:
Proceso para la preparación de ziprasidona.
Sector de la invención
La presente invención se refiere a la preparación de una sal de hidrocloruro de ziprasidona sustancialmente pura.
Antecedentes de la invención
Químicamente, la ziprasidona es 5-[2-[4-(1,2-bencisotiazol-3-yl)-1-piperazinil]etil]-6-cloro-1,3-dihidro-2H-indol-2-ona que tiene la fórmula estructural I. Es indicada para el tratamiento de la esquizofrenia. La ziprasidona está comercialmente disponible en forma de sal de hidrocloruro.

La patente U.S. 4,831,031 da a conocer un proceso para preparar hidrocloruro de ziprasidona, que incluye el reflujo de N-(1,2-bencisotiazol-3-yl)piperazina con 5-(2-cloroetil)-6-cloro-oxindol en metil isobutil cetona en presencia de yoduro de sodio y carbonato de sodio durante aproximadamente 40 horas, seguido de una purificación mediante columna cromatográfica del producto para obtener la base de ziprasidona, que se disuelve en cloruro de metileno y se trata con cloruro de hidrógeno etéreo para obtener la sal de hidrocloruro de ziprasidona. La sal se lava con acetona y el producto se seca.
La patente U.S. 5.312.925 da a conocer un proceso para preparar hidrocloruro de ziprasidona, que incluye calentar hasta el reflujo una mezcla de 5-(2-cloroetil)-6-cloro-oxindol y 1-(1,2-bencisotiazol-3-yl)piperazina en carbonato de sodio acuoso durante 14 horas, seguido por un enfriamiento a 20ºC y filtración. El producto húmedo se resuspende en alcohol isopropílico y se filtra, se lava con alcohol isopropílico fresco seguido de secado al vacío para obtener la base de ziprasidona. La base se trata posteriormente con ácido clorhídrico acuoso en presencia de agua a una temperatura aproximadamente de aproximadamente 60-65ºC durante 3 a 24 horas, seguido de una filtración, lavado con agua y secado al vacío para obtener hidrocloruro de ziprasidona.
Las patentes U.S. 5.206.366 y U.S. 5.338.846 dan a conocer un proceso para preparar base de ziprasidona, que incluye calentar hasta reflujo una mezcla de 5-(2-cloroetil)-6-cloro-oxindol y 1-(1,2-bencisotiazol-3-yl)piperazina en carbonato de sodio acuoso durante 13 horas seguido de un enfriamiento a 25ºC y filtración. El producto se resuspende en alcohol isopropílico dos veces y posteriormente se filtra y se seca al vacío. El producto seco se recristaliza a partir de tetrahidrofurano para obtener base de ziprasidona que tiene una pureza de 99,7%, medida por HPLC.
La patente U.S. 6.150.366 da a conocer un proceso para preparar hidrocloruro de ziprasidona a partir de base de ziprasidona recristalizada dos veces que tiene una pureza de aproximadamente 99,7% medida por HPLC. El proceso incluye refluir una suspensión de base de ziprasidona en tetrahidrofurano y agua para obtener una solución transparente seguida de la adición de una solución de ácido clorhídrico acuoso a 60-62ºC en dos partes, enfriar la mezcla hasta 13ºC para completar la cristalización del hidrocloruro de ziprasidona. El producto se filtra y se lava con tetrahidrofurano frío fresco.
El enfoque de la técnica anterior para preparar ziprasidona o una sal farmacéuticamente aceptable de la misma no es adecuado desde el punto de vista comercial porque el producto no se obtiene con alta pureza y no tiene un color estable, haciendo el enfoque comercialmente difícil de implementar. La pureza en el presente documento se refiere a la pureza del compuesto.
Para alcanzar una alta eficiencia de reacción para la síntesis a escala industrial de hidrocloruro de ziprasidona, es necesario minimizar la formación de impurezas.
Los presentes inventores han encontrado que estos problemas asociados a la técnica anterior pueden atribuirse a la eliminación no eficaz del cloruro de hidrógeno atrapado en el producto de la reacción. El cloruro de hidrógeno atrapado conduce a la degradación del hidrocloruro de ziprasidona y a la formación de impurezas, que ambas oscurecen el color y aumentan el contenido de impurezas. Estas impurezas se han identificado en el producto como impurezas de isopropilen ziprasidona y óxido de mesitilo.
Por lo tanto, la presente invención da a conocer un proceso mediante el cual puede obtenerse mayor cantidad de ziprasidona pura que tiene menos de 0,1% de impurezas para la conversión a la sal de hidrocloruro. El hidrocloruro de ziprasidona cuando se obtiene mediante el proceso de la presente invención tiene un color estable y es fácil de manipular haciendo, por lo tanto, el proceso asequible para el uso a escala comercial.
Características de la invención
En un aspecto general se da a conocer un proceso para la preparación de la sal de hidrocloruro de la base de ziprasidona de fórmula I:

El proceso incluye hacer reaccionar un compuesto de fórmula II,

en la que L es un grupo saliente, con 1-(1,2-bencisotiazol-3-yl) piperazina de fórmula III,

en agua, en ausencia de una base para formar una mezcla, calentar la mezcla resultante desde aproximadamente 50ºC hasta la temperatura de reflujo y aislar la base de ziprasidona de fórmula I o una sal de la misma, y calentar la base obtenida en un disolvente orgánico.
El grupo saliente puede ser un grupo saliente convencional, por ejemplo, cloro, bromo, yodo, mesiloxi, tosiloxi o acetiloxi.
El proceso puede incluir el secado posterior del producto obtenido.
El disolvente puede ser uno o más entre alcanoles inferiores, éteres, cetonas, hidrocarburos clorados, disolventes apróticos polares, agua o mezclas de los mismos. El alcanol inferior puede incluir uno o más entre alcohol primario, secundario y terciario que tienen de uno a seis átomos de carbono. El alcanol de C1-C6 puede incluir uno o más entre metanol, etanol, n-propanol e isopropanol.
La cetona puede incluir uno o más entre acetona, etil metil cetona, metil isobutil cetona y diisobutil cetona.
El éter puede incluir uno o ambos entre tetrahidrofurano y 1,4-dioxano. Un hidrocarburo clorado adecuado incluye uno o más entre cloroformo, diclorometano y 1,2-dicloroetano.
El disolvente aprótico polar puede incluir uno o más entre N,N-dimetilformamida, N,N-dimetilacetamida, dimetilsulfóxido, acetonitrilo y N-metilpirrolidona.
Eliminar el disolvente puede incluir, por ejemplo, una o más entre destilación, destilación al vacío, evaporación, filtración, filtración al vacío, decantación y centrifugación.
La ziprasidona puede recuperarse de la solución mediante filtración, filtración al vacío, decantación o centrifugación. El proceso puede incluir la formación posterior del producto obtenido en una forma de dosificación terminada.
La ziprasidona puede también recuperarse de la solución añadiendo un disolvente/segundo disolvente adicional adecuado que provoca la precipitación de la ziprasidona sustancialmente pura y eliminar el disolvente formado mediante filtración, filtración al vacío, decantación o centrifugación.
El proceso puede incluir el secado posterior del producto obtenido.
En un aspecto general, la solución puede enfriarse antes de la filtración para obtener mejores rendimientos de ziprasidona sustancialmente pura o una sal de la misma.
El proceso puede incluir, en particular, la producción de ziprasidona pura que tiene una pureza mayor de 99,9% con impurezas totales menores de 0,1%.
El aspecto fundamental da a conocer un proceso para preparar hidrocloruro de ziprasidona. El proceso, en particular, incluye obtener una suspensión de ziprasidona en uno o más disolventes; poner en contacto la suspensión con cloruro de hidrógeno; y aislar el hidrocluro de ziprasidona en forma sustancialmente pura.
El hidrocluro de ziprasidona sustancialmente puro producido puede utilizarse en un método para el tratamiento de la esquizofrenia en un animal de sangre caliente, comprendiendo el método proporcionar una composición farmacéutica al animal de sangre caliente que incluye hidrocloruro de ziprasidona sustancialmente puro.
Los detalles de una o más realizaciones de la presente invención se...
Reivindicaciones:
1. Proceso para la preparación de la sal de hidrocloruro de ziprasidona de fórmula I, teniendo una pureza de, como mínimo, 99,9% y el contenido total de impurezas inferior al 0,1% cuando se determina por HPLC,
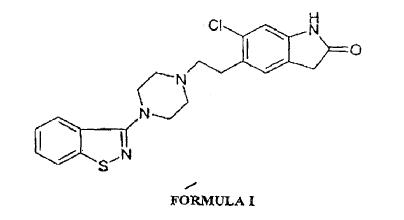
- comprendiendo el proceso:
(a) hacer reaccionar un compuesto de fórmula II,

en la que L es un grupo saliente, con 1-(1,2-benzisotiazol-3-il)piperazina de fórmula III

en agua en ausencia de una base para formar una mezcla;
(b) calentar la mezcla resultante desde aproximadamente 50ºC hasta la temperatura de reflujo;
(c) aislar la ziprasidona de fórmula I, y
(d) calentar la base obtenida en la etapa (c) en un disolvente orgánico.
2. Proceso, según la reivindicación 1, en el que el grupo saliente L en la etapa (a) se selecciona del grupo que comprende cloro, bromo, yodo, mesiloxi, tosiloxi o acetiloxi.
3. Proceso, según la reivindicación 1, en el que el disolvente en la etapa (d) comprende uno o más entre alcanol C1 a C6, éter, cetona, hidrocarburo clorado, disolvente aprótico polar, agua o mezclas de los mismos.
4. Proceso, según la reivindicación 3, en el que el alcanol C1 a C6 comprende uno o más entre metanol, etanol, n-propanol e isopropanol.
5. Proceso, según la reivindicación 3, en el que el éter comprende uno o ambos entre tetrahidrofurano y 1,4-dioxano.
6. Proceso, según la reivindicación 3, en el que la cetona comprende uno o más entre acetona, etil metil cetona, metil isobutil cetona y diisobutilcetona.
7. Proceso, según la reivindicación 3, en el que el hidrocarburo clorado comprende uno o más entre cloroformo, diclorometano y 1,2-diclorometano.
8. Proceso, según la reivindicación 3, en el que el disolvente aprótico polar comprende uno o más entre N,N-dimetilformamida, N,N-dimetilacetamida, dimetilsulfóxido, acetonitrilo y N-metilpirrolidona.
9. Proceso, según la reivindicación 1, en el que la base se calienta en un disolvente orgánico desde aproximadamente 40ºC hasta la temperatura de reflujo en la etapa (d).
10. Proceso, según la reivindicación 1, que comprende poner en contacto la base de ziprasidona obtenida en la etapa (d) con cloruro de hidrógeno en un disolvente para formar un sólido.
11. Proceso, según la reivindicación 10, en el que el disolvente se selecciona entre el grupo que comprende alcanoles C1 a C6, hidrocarburos clorados, hidrocarburos aromáticos, disolventes apróticos polares, éteres, cetonas, y mezclas de los mismos.
12. Proceso, según la reivindicación 10, en el que el sólido se lava con agua, disolvente aprótico polar, alcanol C1 a C6, éter o mezclas de los mismos antes del aislamiento.
13. Proceso, según la reivindicación 10, en el que el sólido se lava hasta que los lavados están libres de cualquier acidez.
Patentes similares o relacionadas:
Bloqueador de canales de sodio, del 29 de Julio de 2020, de DAEWOONG PHARMACEUTICAL CO., LTD.: Un compuesto representado por la Fórmula Química 1 más abajo, o una sal farmacéuticamente aceptable del mismo: **(Ver fórmula)** en la Fórmula […]
Derivados de piperidina 1,4 sustituidos, del 29 de Julio de 2020, de 89Bio Ltd: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de […]
Ureas asimétricas p-sustituidas y usos médicos de las mismas, del 22 de Julio de 2020, de Helsinn Healthcare SA: Un compuesto de Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: una línea discontinua indica un enlace opcional; X es CH; […]
Inhibidores de lisina gingipaína, del 1 de Julio de 2020, de Cortexyme, Inc: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde Z es ariloximetil-carbonilo sustituido con halógeno; […]
Moduladores de la indolamina 2,3-dioxigenasa, del 24 de Junio de 2020, de Glaxosmithkline Intellectual Property (No. 2) Limited: Un compuesto que tiene la estructura de Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: X es **(Ver fórmula)** […]
Compuestos de diaminopirimidilo sustituidos, composiciones de los mismos y procedimientos de tratamiento con ellos, del 17 de Junio de 2020, de SIGNAL PHARMACEUTICALS LLC: Un compuesto de fórmula (I): **(Ver fórmula)** o una sal, un tautómero, un isotopólogo o un estereoisómero farmacéuticamente aceptable […]
Modificador del sabor dulce, del 17 de Junio de 2020, de Firmenich Incorporated: Un compuesto que tiene la fórmula estructural (Ia): **(Ver fórmula)** o una sal o solvato del mismo; en la que m es 4 y n es 0 o m es 3 y […]
Compuestos para el tratamiento del cáncer, del 3 de Junio de 2020, de Oncternal Therapeutics, Inc: Un compuesto representado por la fórmula II: **(Ver fórmula)** en donde Q es S, NH, u O; Z es CH o N; A es fenilo sustituido o no sustituido; indolilo […]