Procedimientos para el tratamiento de una enfermedad bacteriana infecciosa con un anticuerpo contra las moléculas señal derivadas de una antilactona o una lactona.
Un procedimiento para explorar una biblioteca de presentación de fagos humanos vírgenes con respecto a un anticuerpo monoclonal antibacteriano específico para una molécula de señalización bacteriana,
comprendiendo el procedimiento conjugar una molécula seleccionada del grupo que consiste en una molécula de homoserina lactona de fórmula general:**Fórmula**
en la que n = 0 a 12,
una péptido tiolactona de fórmula general (IV):
en la que x es cualquier aminoácido y n = 1 a 10;
o Auto Inductor-2 (AI-2),
o Pro-AI-2 o un derivado de ácido carboxílico insaturado o saturado C1-C10 del mismo
con una molécula vehículo, explorar la biblioteca para generar una biblioteca enriquecida y explorar dicha biblioteca enriquecida frente a la misma molécula de señalización bacteriana conjugada con una segunda molécula vehículo diferente para identificar un anticuerpo monoclonal que se une específicamente a la forma soluble libre de la homoserina lactona, péptido tiolactona, AI-2 o Pro-AI-2 o un derivado de ácido carboxílico insaturado o saturado C1- C10 del mismo de la biblioteca de presentación de fagos humanos vírgenes en presencia de derivados conjugados de los mismos.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB2003/003529.
Solicitante: HAPTOGEN LTD.
Nacionalidad solicitante: Reino Unido.
Dirección: POLWARTH BUILDING, FORESTERHILL ABERDEEN AB25 2ZD REINO UNIDO.
Inventor/es: CHARLTON,Keith Alan, PORTER,Andrew Justin Radcliffe.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K39/395 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- A61K39/40 A61K 39/00 […] › bacterianos.
- A61P31/04 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 31/00 Antiinfecciosos, es decir antibióticos, antisépticos, quimioterápicos. › Agentes antibacterianos.
- C07K16/12 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra materiales bacterianos.
- C07K16/44 C07K 16/00 […] › contra material no previsto.
PDF original: ES-2382075_T3.pdf
Fragmento de la descripción:
Procedimientos para el tratamiento de una enfermedad bacteriana infecciosa con un anticuerpo contra las moléculas señal derivadas de una antilactona o una lactona
Campos de la invención
La presente invención se refiere a procedimientos para controlar y tratar infecciones bacterianas en pacientes. Los procedimientos de la invención son aplicables a la mayoría de, si no a todas, las infecciones bacterianas Gram negativas y Gram positivas. La invención posibilita la aplicación de terapias basadas en, en la realización preferida, inmunoglobulina o moléculas receptoras de tipo inmunoglobulina que tienen afinidad y especificidad por moléculas de señalización implicadas en los procesos de comunicación bacteriana de célula a célula. Uniéndose a tales moléculas, los receptores pueden usarse para diagnosticar la presencia de bacterias o para evaluar la patología de pacientes, y pueden usarse adicionalmente para controlar concentraciones de moléculas implicadas en la inducción de un estado virulento en patógenos oportunistas y otros.
Antecedentes de la invención
Una de las causas principales de mortalidad y morbilidad entre pacientes que se someten a tratamiento en hospitales en la actualidad se debe a infección adquirida en el hospital. La susceptibilidad a dicha infección puede ser como resultado de la enfermedad primaria para la que se admitió al paciente, de regímenes de tratamiento inmunosupresores, o como consecuencia de lesión que da como resultado daño cutáneo grave, tal como quemaduras. La bacteria a la que se atribuye la mayor proporción de casos es Pseudomonas aeruginosa. Es el paradigma de un patógeno oportunista de seres humanos. La bacteria casi nunca infecta tejidos no comprometidos, pero apenas hay ningún tejido que no puede infectar, si las defensas del tejido están comprometidas de alguna manera. Aunque representa un número relativamente pequeño de especies, supone una amenaza grave para la salud humana y se usa en lo sucesivo como un ejemplo representativo de una bacteria infecciosa.
Pseudomonas aeruginosa es un patógeno oportunista que provoca infecciones del tracto urinario, infecciones del sistema respiratorio, dermatitis, infecciones de tejido blando, bacteriemia y una diversidad de infecciones sistémicas, particularmente en víctimas de quemaduras graves, y en pacientes de cáncer y SIDA que están inmunosuprimidos. Las infecciones respiratorias provocadas por Pseudomonas aeruginosa se producen casi exclusivamente en individuos con un tracto respiratorio inferior comprometido o un mecanismo de defensa sistémica comprometida. Se produce neumonía primaria en pacientes con enfermedad pulmonar crónica e insuficiencia cardiaca congestiva. La neumonía bacteriémica se produce habitualmente en pacientes con cáncer neutropénico que se someten a quimioterapia. La colonización del tracto respiratorio inferior de pacientes con fibrosis quística por cepas mucoides de Pseudomonas aeruginosa es habitual y difícil, si no imposible, de tratar. Provoca bacteriemia principalmente en pacientes inmunocomprometidos. Las afecciones que predisponen incluyen tumores malignos hematológicos, inmunodeficiencia relacionada con SIDA, neutropenia, diabetes mellitus y quemaduras graves. La mayor parte de la bacteriemia por Pseudomonas se adquiere en hospitales y residencias en los que representa aproximadamente el 25 por ciento de todas las bacteriemias Gram negativas adquiridas en hospital.
La bacteria es conocida por su resistencia natural a muchos antibióticos debido a la barrera de permeabilidad que le aporta su LPS de membrana exterior y es, por lo tanto, un patógeno particularmente peligroso y temido. Además, su tendencia a colonizar superficies en forma de biofilm hace a las células impermeables a concentraciones terapéuticas de antibióticos. Puesto que su hábitat natural es el suelo, viviendo en asociación con los bacilos, actinomicetes y mohos, ha desarrollado resistencia a una diversidad de sus antibióticos de origen natural. Además, Pseudomonas spp. mantiene plásmidos de resistencia a antibióticos, tanto factores de resistencia (factores R) como factores de transferencia de resistencia (RTF) , y son capaces de transferir estos genes por medio de los procesos bacterianos de transducción y conjugación. Solo unos pocos antibióticos son eficaces contra Pseudomonas, incluyendo fluoroquinolona, gentamicina e imipenem, e incluso estos antibióticos no son eficaces contra todas las cepas. Se ha notificado que las combinaciones de gentamicina y carbenicilina son eficaces en pacientes con infecciones por Ps. Aeruginosa agudas. La inutilidad de tratar infecciones por Pseudomonas con antibióticos se ilustra de forma más drástica en pacientes con fibrosis quística, prácticamente todos los cuales se infectan con el tiempo con una cepa que es tan resistente que no puede tratarse. Debido a la resistencia a antibióticos, es obligatorio el ensayo de susceptibilidad de aislados clínicos.
Ps. aeruginosa puede aislarse habitualmente de suelo y agua, así como las superficies de plantas y animales. Se encuentra por todo el mundo, en cualquier lugar en el que aparezcan estos hábitats, de modo que es una bacteria bastante "cosmopolita". En ocasiones está presente como parte de la flora normal de seres humanos, aunque la prevalencia de colonización de individuos sanos fuera del hospital es relativamente baja (las estimaciones varían de 0 a 24 por ciento dependiendo de la situación anatómica) . En los hospitales se sabe que coloniza alimentos, pilas, grifos, fregonas, instrumentos quirúrgicos de equipamiento respiratorio. Aunque la colonización habitualmente precede a infecciones por Ps. aeruginosa, la fuente exacta y el modo de transmisión del patógeno con frecuencia no están claros debido a su presencia ubicua en el ambiente. Entre los pacientes de cuidados intensivos en los que se sospecha infección por razones clínicas, hasta el 50 % no tienen fuente identificable de infección. En la actualidad, 1.400 muertes en todo el mundo están provocadas cada día por Ps. aeruginosa en unidades de cuidados intensivos (UCI) , haciéndolo la causa de muerte principal.
Ps. aeruginosa es principalmente un patógeno nosocomial. De acuerdo con el CDC, la incidencia global de infecciones por Ps. aeruginosa en los hospitales de Estados Unidos tiene una media de aproximadamente 0, 4 por ciento (4 por cada 1000 altas) y la bacteria es el cuarto patógeno nosocomial aislado más habitualmente, representando 10, 1 % de todas las infecciones adquiridas en el hospital. Globalmente es responsable del 16 % de los casos de neumonía nosocomiales, 12 % de las infecciones de tracto urinario adquiridas, 8 % de infecciones de herida quirúrgica y 10 % de infecciones del torrente sanguíneo. Los pacientes inmunocomprometidos tales como pacientes de cáncer neutropénico y trasplante de médula ósea son susceptibles de infección por Ps. aeruginosa oportunista, lo que conduce al 30 % de las muertes notificadas. También es responsable del 38 % de neumonías asociadas con ventilador y 50 % de muertes entre los pacientes con SIDA. En casos de quemaduras las infecciones por Ps. aeruginosa se han reducido en años recientes debido a la mejora del tratamiento y cambios de la dieta. Las tasas de mortalidad sin embargo permanecen altas, representando el 60 % de todas las muertes debido a infección secundaria de pacientes con quemaduras.
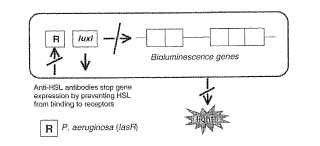
Una razón para la versatilidad de Ps. aeruginosa es que produce una batería de determinantes de virulencia diversos, incluyendo elastasa, proteasa LasA, proteasa alcalina, ramnolípidos, movilidad de contracción mediada por pelo de tipo IV, pioverdina (Williams y col., 1996, Stintzi y col., 1998, Glessner y col., 1999) , piocianina (Brint & Ohman, 1995, Reimmann y col., 1997) y las lectinas citotóxicas PA-I y PA-II (Winzer y col. 2000) . Se sabe ahora que muchos de estos determinantes de virulencia se regulan al nivel genético de una manera dependiente de densidad celular a través de sensibilidad de quórum. Ps. aeruginosa posee al menos dos sistemas de sensibilidad de quórum, concretamente los sistemas las y rhl (vsm) que comprenden los homólogos de LuxRI LasRI (Gambello & Iglewski, 1991) y Rh1RI (VsmRI) (Latif y col., 1995) respectivamente (Figura 2) . LasI dirige la síntesis de 3-oxo-C12-HSL (Passador y col., 1993, Pearson y col., 1994) , mientras que RH1I dirige la síntesis de C4-HSL (Winson y col., 1995) . Se cree que los sistemas las y rhl existen en una jerarquía en la que el sistema las ejerce control transcripcional sobre Rh1R (Williams y col., 1996, Pesci y col., 1997) . El activador transcripcional LasR actúa junto con 3-oxo-C12-HSL para regular la expresión de los genes que codifican... [Seguir leyendo]
Reivindicaciones:
1. Un procedimiento para explorar una biblioteca de presentación de fagos humanos vírgenes con respecto a un anticuerpo monoclonal antibacteriano específico para una molécula de señalización bacteriana, comprendiendo el procedimiento conjugar una molécula seleccionada del grupo que consiste en una molécula de homoserina lactona de fórmula general:
en la que n = 0 a 12, 10 una péptido tiolactona de fórmula general (IV) :
en la que x es cualquier aminoácido y n = 1 a 10;
o Auto Inductor-2 (AI-2) , o Pro-AI-2 o un derivado de ácido carboxílico insaturado o saturado C1-C10 del mismo con una molécula vehículo, explorar la biblioteca para generar una biblioteca enriquecida y explorar dicha biblioteca enriquecida frente a la misma molécula de señalización bacteriana conjugada con una segunda molécula vehículo diferente para identificar un anticuerpo monoclonal que se une específicamente a la forma soluble libre de la homoserina lactona, péptido tiolactona, AI-2 o Pro-AI-2 o un derivado de ácido carboxílico insaturado o saturado C1
C10 del mismo de la biblioteca de presentación de fagos humanos vírgenes en presencia de derivados conjugados de los mismos.
2. Un procedimiento de acuerdo con la reivindicación 1, en el que la molécula vehículo es una proteína.
3. Un procedimiento de acuerdo con la reivindicación 1 ó 2, en la que la molécula homoserina lactona de fórmula
general I es N-butanoil-L-homoserina lactona (BHL) en la que n = 0, N-dodecanoil-L-homoserina lactona (dDHL) en 10 la que n = 8 y n-tetradecanoil-L-homoserina lactona (tDHL) en la que n = 10.
4. Un procedimiento de acuerdo con la reivindicación 1 ó 2, en el que la molécula de homoserina lactona de fórmula general II es N- (-3-oxohexanoil) -L-homoserina lactona (OHHL) en la que n = 2 y N- (-3-oxododecanoil) -L-homoserina lactona (OdDHL) en la que n = 8.
5. Un procedimiento de acuerdo con la reivindicación 1 ó 2, en el que la molécula de homoserina lactona de fórmula 15 general III es N- (-3-hidroxibutanoil) -L-homoserina lactona (HBHL) en la que n = 0.
6. Un procedimiento de acuerdo con la reivindicación 1 ó 2, en el que la molécula de péptido tiolactona es:
7. Un anticuerpo de cadena sencilla (scAb) de los clones de E. coli G3H5, G3B12, G3G2 o G3H3 depositados como NCIMB-41167, NCIMB-41168, NCIMB-41169 y NCIMB-41170 respectivamente.
8. Un anticuerpo de cadena sencilla de la reivindicación 7 para su uso en medicina.
9. El uso de un anticuerpo de cadena sencilla de la reivindicación 7 en la preparación de un medicamento para el 25 tratamiento de infección bacteriana.
10. Una composición farmacéutica que comprende un anticuerpo de cadena sencilla (scAb) de los clones de E. coli G3H5, G3B12, G3G2 o G3H3 depositados como NCIMB-41167, NCIMB-41168, NCIMB-41169 y NCIMB-41170 respectivamente Tabla 1
Organismo Proteínas reguladoras Molécula señal Fenotipo Aeromonas hydrophila Ahyl/AhyR BHL, HHL serina proteasa, metaloproteasa Aeromonas salmonicida Asal/AsaR BHL, HHL ? Agrobacterium tumefaciens Tral/TraR HHL, OOHL conjugación Burkholderia cepacia Cepl/CepR OHL ornibactina, sideróforos, exoproteasa Chromobacterium violaceum Cvil/CviR HHL antibióticos, violaceina, exoenzimas, cianuro Erwinia carotovora Carl/CarR ExpI/ExpR OHHL +? antibiótico carbapenem exoenzimas Erwinia chr y santhemi ExpI/ExpR OHHL, HHL pectato liasa Escherichia coli ?/SdiR LuxS/? ? AI-2 división celular ? Pantoea stewartii Esal/EsaR OHHL Exopolisacárido Pseudomonas aeruginosa LasI/LasR RhlI/RhlR OdDHL, OHHL, OOHL BHL, HHL Factores de virulencia incluyendo: proteasa alcalina, exotoxina elastasa A Quitinasa, piocianina, ramnolípido Pseudomonas aureofaciens PhzI/PhzR BHL, HHL Antibiótico de fenazina Pseudomonas fluorescens PhzI/PhzR OHL, HHHL, HOHL, HDHL Antibiótico de fenazina Ralstonia solanacearum SolI/SolR HHL, OHL ? (aidA) Rhizobium leguminosarum Rhil/RhiR HHL, OHL Nodulación Rhodobacter sphaeroides Cerl/CerR ? Expresión de EPS de escape de la comunidad Serrana liquifaciens Swrl/? BHL, HHL Enjambrazón, fosfolipasa Vibrio anguillarum Vanl/VanR ODHL ? Vibrio fischeri LuxI/LuxR AinS/AinR OHHL, HHL OHL Bioluminiscencia Vibrio harveyi LuxI/LuxR LuxPQ/LuxS HBHL AI-2 Bioluminiscencia Xenorlmbdus nematophilus ? HBHL Factores de virulencia Yersinia enterocolitica YenI.YenR HHL, OHHL ? Yersinia pestis Ypel/YeR HHL, OHHL Patogenicidad Yersinia pseudotuberculosis YpsI/YpsR YtbI/YtbR HHL, OHHL OHL Producción de flagelos ? Bacillus anthracis ? AI-2 Factores de virulenciaFigura 1a.
Acil-homoserina lactona, por ejemplo, BHL (n=0) , dDHL (n=8) , tDHL (n=10)
3. oxo-homoserina lactona, por ejemplo, OHHL (n=2) , OdDHL (n=8)
3. hidroxi-homoserina lactona, por ejemplo, HBHL (n=0)
Figura 1b.
Pro AI-2 Auto lnductor-2 (AI-2) Hapteno sensible a Pro-AI-2
Figura 1c.
Agr D1 Tiolactona Agr D2 Tiolactona Agr D3 Tiolactona Agr D4 Tiolactona Tabla 2. Figura 2.
5 scAb dDHL-COOH tDHL G3G2 11 !M 21 !M G3B12 4 !M 5 !M N/D indica que no pudo determinarse valor de CI50. OHHL 17 mM 2 mM dDHL-BSA 0, 28 !M 0, 32 !M Paraquat N/D N/D Tabla 3. scAb G3G2 ka (mol l-1 s-1) 4, 19 x 104 kd (s-1) 1, 43 x 10-3 KA (mol/l) 2, 93 x 107 KD (nM) 34, 1 G3B12 3, 93 x 104 1, 56 x 10-3 2, 52 x 107 39, 7 10 Tabla 4. scAb BHL dDHL tDHL OHHL Paraquat G3B12 17 mM 1, 4 mM 4, 5 mM 10 mM N/D L1-A7 1, 25 mM 40 !M --N/D (G3B12) (x 13, 6) (x 35) L1-B7 - 130 !M --N/D (G3B12) (x 10, 8) L1-C11 - 200 !M --N/D (G3B12) (x 7) G12 3 mM -0, 6 mM 5 mM N/D (G3B12) (x 5, 7) (x 7, 5) (x 2)Figura 3.
Figura 4. Figura 5. Figura 6. Figura 7. Figura 8.
Tabla 5.
Densidad óptica alta Densidad baja
Días de Inc Control de PBS scAb de control G3H5 G3B12 G3H3 Control de PBS Mezcla de 3 scAb 1 100 100 100 100 100 100 100 2 100 100 100 100 100 100 82 3 100 95 70 68 84 100 75 4 100 100 58 52 65 100 65 5 100 95 52 47 49 100 56Figura 9.
Patentes similares o relacionadas:
Formulaciones estabilizadas que contienen anticuerpos anti-receptor de interleucina 4 (IL-4R), del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Una jeringuilla precargada que contiene una formulación farmacéutica líquida estable, en la que la formulación farmacéutica líquida comprende: […]
Composición para el tratamiento de enfermedades isquémicas o trastornos inflamatorios neurogénicos, que contienen el secretoma de células progenitoras neurales como ingrediente activo, del 22 de Julio de 2020, de S-BIOMEDICS: Una composición para uso en el tratamiento de enfermedad cerebrovascular isquémica, cardiopatía isquémica, infarto de miocardio, enfermedad de Alzheimer, enfermedad […]
Utilización de anticuerpos optimizados en ADCC para tratar a los pacientes con bajo nivel de respuesta, del 22 de Julio de 2020, de LABORATOIRE FRANCAIS DU FRACTIONNEMENT ET DES BIOTECHNOLOGIES: Utilización de una composición de anticuerpo monoclonal quimérico, humanizado o humano de isotipo IgG1 anti- Rhesus del glóbulo rojo humano cuya […]
Composiciones farmacéuticas que contienen una leucocidina E mutada, del 22 de Julio de 2020, de NEW YORK UNIVERSITY: Una composición que comprende: una proteína Leucocidina E (LukE) aislada que comprende la secuencia de aminoácidos de la SEQ ID NO: 4, o un polipéptido […]
Método para producir inmunoconjugados de anticuerpo-SN-38 con un enlazador CL2A, del 22 de Julio de 2020, de IMMUNOMEDICS, INC.: Un método para producir un compuesto, CL2A-SN-38, que presenta la estructura, **(Ver fórmula)** que comprende realizar un esquema de reacción como el que se muestra: **(Ver […]
Composición de anticuerpos monoclonales dirigidos contra BDCA-2, del 22 de Julio de 2020, de LABORATOIRE FRANCAIS DU FRACTIONNEMENT ET DES BIOTECHNOLOGIES: Composición de anticuerpos monoclonales dirigidos contra la proteína BDCA-2, presentando dichos anticuerpos un porcentaje de fucosilación inferior al 60% […]
Anticuerpos anti-PD-L1 y usos de los mismos, del 22 de Julio de 2020, de MERCK PATENT GMBH: Un anticuerpo anti-PD-L1 aislado o su fragmento de union a antigeno que comprende una secuencia de region variable de cadena pesada y de cadena ligera, en donde: […]
PTPRS y proteoglicanos en enfermedad autoinmune, del 15 de Julio de 2020, de LA JOLLA INSTITUTE FOR ALLERGY AND IMMUNOLOGY: Una proteína recombinante no enzimática que comprende una secuencia de aminoácidos de un dominio extracelular de PTPRS, donde la proteína comprende tanto el dominio 1 (Ig1) […]