Procedimientos y composiciones relacionadas con el dominio Kunitz I mutante de TFPI-2.
Un polipéptido que comprende la SEC ID Nº 1 o una secuencia que tiene al menos el 79% deidentidad con la SEC ID Nº 1,
con una sustitución de leucina a arginina o lisina en la posición 17, usando el sistemade numeración de BPTI, y que inhibe la plasmina y tiene una actividad de anticoagulación reducida en comparacióncon el dominio Kunitz de tipo silvestre de TFPI-2.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2006/062723.
Solicitante: THE REGENTS OF THE UNIVERSITY OF CALIFORNIA OFFICE OF TECHNOLOGY TRANSFER.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 1111 FRANKLIN STREET, 12TH FLOOR OAKLAND, CALIFORNIA 94607-5200 ESTADOS UNIDOS DE AMERICA.
Inventor/es: BAJAJ,PAUL S.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K48/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen material genético que se introduce en las células del cuerpo vivo para tratar enfermedades genéticas; Terapia génica.
PDF original: ES-2431526_T3.pdf
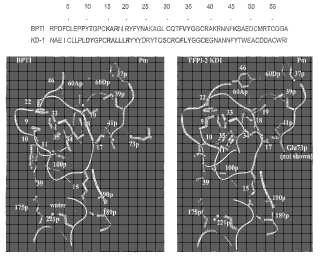
Fragmento de la descripción:
Procedimientos y composiciones relacionadas con el dominio Kunitz I mutante de TFPI-2.
ANTECEDENTES DE LA INVENCIÓN
El agente principalmente responsable de la fibrinólisis es la plasmina, la forma activada del plasminógeno. Muchas sustancias pueden activar el plasminógeno, incluyendo el factor de Hageman activado, estreptoquinasa, uroquinasa (uPA) , activador del plasminógeno de tipo tisular (tPA) y calicreína plasmática (pKA) . La pKA es tanto un activador de la forma zimógena de uroquinasa como un activador directo del plasminógeno.
La plasmina es indetectable en la sangre circulante normal, pero el plasminógeno, el zimógeno, está presente a aproximadamente 3 !M. Una cantidad no medida adicional de plasminógeno está unida a fibrina y otros componentes de la matriz extracelular y las superficies celulares. La sangre normal contiene el inhibidor fisiológico de plasmina, inhibidor de plasmina a2 (a2-PI) , a aproximadamente 2 !M. La plasmina y el a2-PI forman un complejo 1:1. La plasmina unida a la matriz o a la célula es relativamente inaccesible a la inhibición por a2-PI. Por lo tanto, la activación de plasmina puede superar la capacidad de neutralización de a2-PI causando un estado profibrinolítico.
La plasmina, una vez formada, degrada los coágulos de fibrina, algunas veces de forma prematura; digiere el fibrinógeno (el material de construcción de coágulos) alterando la hemostasia causando la formación de coágulos desmenuzables, que se lisan fácilmente a partir de los productos de degradación y la inhibición de la adhesión/agregación de plaquetas por los productos de degradación de fibrinógeno; interactúa directamente con las plaquetas para escindir glucoproteínas Ib y IIb/IIIa impidiendo la adhesión al endotelio lesionado en zonas de flujo sanguíneo de alto cizallamiento y alterando la respuesta de agregación necesaria para la formación de un tapón de plaquetas (ADEL86) ; inactiva proteolíticamente enzimas en la ruta de coagulación extrínseca promoviendo, además, un estado prolítico.
La fibrinólisis y fibrinogenólisis inapropiadas que conducen a hemorragia excesiva son una complicación frecuente de procedimientos quirúrgicos que requieren circulación extracorpórea, tal como derivación cardiopulmonar, y también se encuentra en terapia trombolítica y transplante de órganos, particularmente de hígado. Otras afecciones clínicas caracterizadas por alta incidencia de diátesis hemorrágica incluyen cirrosis hepática, amiloidosis, leucemia promielocítica aguda y tumores sólidos. La restauración de la hemostasia requiere infusión de plasma y/o productos plasmáticos, lo que supone un riesgo de reacción inmunológica y exposición a patógenos, por ejemplo virus de la hepatitis y VIH.
Una pérdida de sangre muy grande puede resistir la resolución incluso con infusión masiva. Cuando se considera potencialmente letal, la hemorragia se trata con antifibrinolíticos tales como ácido s-aminocaproico (Véase HOOV93) (EACA) , ácido tranexámico o aprotinina (NEUH89) . La aprotinina también se conoce como Trasylolv y como Inhibidor de tripsina pancreática bovina (BPTI) . En lo sucesivo en el presente documento, la aprotinina se denominará “BPTI”. El EACA y el ácido tranexámico solamente impiden que la plasmina se una a fibrina uniéndose a los dominios Kringle, dejando de este modo a la plasmina como una proteasa libre en el plasma. El BPTI es un inhibidor directo de plasmina y es el más eficaz de estos agentes. Debido al potencial para complicaciones trombóticas, toxicidad renal y, en el caso de BPTI, inmunogenicidad, estos agentes se usan con precaución y habitualmente se reservan como un “último recurso” (PUTT89) . Todos estos tres agentes antifibrinolíticos carecen de especificidad y afinidad por una diana e interactúan con tejidos y órganos a través de rutas metabólicas sin caracterizar. Las dosis grandes requeridas debido a baja afinidad, efectos secundarios debidos a falta de especificidad y potencial para reacción inmunológica y toxicidad para órganos/tejidos aumentan contra el uso estos antifibrinolíticos de forma profiláctica para impedir la hemorragia o como una terapia postoperatoria rutinaria para evitar o reducir la terapia de transfusión. Por lo tanto, existe una necesidad de un antifibrinolítico seguro.
Una hemorragia excesiva puede ser el resultado de una actividad de coagulación deficiente, actividad fibrinolítica elevada o una combinación de las dos afecciones. En la mayoría de las diátesis hemorrágicas se debe controlar la actividad de plasmina. Se cree que el efecto clínicamente beneficioso del inhibidor de tripsina pancreática bovina (BPTI) en la reducción de la pérdida de sangre es el resultado de su inhibición de plasmina (Kd aproximadamente 0, 3 nM) o de calicreína plasmática (Kd aproximadamente 100 nM) o de ambas enzimas.
Curiosamente, la reacción de hipersensibilidad inducida por BPTI se produce en aproximadamente del 1, 2 al 2, 7 por ciento de los pacientes expuestos de nuevo a aprotinina (30) . De estas reacciones, el 50 por ciento son potencialmente letales con una tasa de letalidad del 9 por ciento (30) . Por lo tanto, una molécula humana que está modificada de forma selectiva para hacerla más potente es altamente deseable. También se espera que dicha molécula sea menos inmunógena. Recientemente se han descrito problemas de efectos secundarios y toxicidad para el uso de BPTI (Manago y col., N Engl J Med 2006; 354: 353-65) . La textilinina también se ha comparado con aprotinina, sin embargo, la textilinina es una proteína de serpiente y, por lo tanto, hay problemas de inmunogenicidad asociados con ella. (Pathophysiol Haemost Thromb. 2005; 34 (4-5) : 188-93 y Patente de [0008] Estados Unidos Nº 7.070.969) .
Lo que se necesita en la técnica es un inhibidor de plasmina que sea tan potente (o más potente) que BPTI, pero que sea casi idéntico a un dominio de proteína humana, ofreciendo de este modo potencial terapéutico similar pero planteando menos potencial para antigenicidad.
RESUMEN DE LA INVENCIÓN
De acuerdo con el fin o los fines de esta invención, tal como se realiza y se describe ampliamente en el presente documento, esta invención, en un aspecto, se refiere a un polipéptido según las reivindicaciones 1 a 7, por ejemplo uno que comprende la SEC ID Nº 1 con una o más mutaciones. Por ejemplo, en el presente documento se proporciona la SEC ID Nº 1 con una o más de las siguientes sustituciones: leucina se cambia a arginina o lisina en la posición 17 (numeración de BPTI) ; tirosina se cambia a ácido glutámico en la posición 46; tirosina se cambia a treonina en la posición 11; ácido aspártico se cambia a tirosina o ácido glutámico en la posición 10; alanina se cambia a metionina en la posición 16; alanina se cambia a glicina en la posición 16; alanina se cambia a serina en la posición 16.
En el presente documento también se desvelan los polipéptidos que inhiben la plasmina. En el presente documento también se desvelan polipéptidos que inhiben la plasmina y tienen actividad de anticoagulación reducida en comparación con el dominio Kunitz de tipo silvestre de TFPI-2. En el presente documento también se desvelan polipéptidos que son específicos como agentes antifibrinolíticos.
También se desvelan composiciones que comprenden los polipéptidos descritos en el presente documento.
También se desvelan ácidos nucleicos que codifican los polipéptidos desvelados en el presente documento.
También se desvelan procedimientos de inhibición de al menos una actividad de plasmina que comprenden poner en contacto plasmina con una cantidad eficaz de un polipéptido desvelado en el presente documento.
También se desvela un procedimiento de tratamiento de un sujeto que necesita inhibición de una actividad de plasmina, que comprende administrar al sujeto una cantidad eficaz de un polipéptido desvelado en el presente documento. Los ejemplos de enfermedades, trastornos, y tratamientos relacionados con la necesidad de inhibición de plasmina incluyen, aunque sin limitarse a, tumorigénesis, angiogénesis, remodelación ósea, cirugía, hemofilia, cirugía ortopédica, injerto de derivación de la arteria coronaria (CABG) y síndrome de respuesta inflamatoria sistémica (SIRS) .
También se desvela un procedimiento de tratamiento de artritis reumatoide en un sujeto que lo necesita, que comprende administrar al sujeto una cantidad eficaz de un polipéptido desvelado en el presente documento.
Un procedimiento de identificación de un inhibidor de plasmina puede ser útil, comprendiendo dicho procedimiento: modelar una estructura cristalina de plasmina con una variante de KD1; determinar... [Seguir leyendo]
Reivindicaciones:
1. Un polipéptido que comprende la SEC ID Nº 1 o una secuencia que tiene al menos el 79% de identidad con la SEC ID Nº 1, con una sustitución de leucina a arginina o lisina en la posición 17, usando el sistema de numeración de BPTI, y que inhibe la plasmina y tiene una actividad de anticoagulación reducida en comparación con el dominio Kunitz de tipo silvestre de TFPI-2.
2. El polipéptido de la reivindicación 1, en el que la secuencia de aminoácidos tiene al menos el 80% de identidad con la SEC ID Nº 1.
3. El polipéptido de la reivindicación 1, en el que la secuencia de aminoácidos tiene al menos el 81% de identidad con la SEC ID Nº 1.
4. El polipéptido de la reivindicación 1, en el que la secuencia de aminoácidos tiene al menos el 82% de identidad con la SEC ID Nº 1.
5. Un polipéptido que comprende la SEC ID Nº 1 o una secuencia que tiene al menos el 80% de identidad con la SEC ID Nº 1, con una sustitución de leucina a arginina o lisina en la posición 17 y una sustitución de tirosina a ácido glutámico en la posición 46, usando el sistema de numeración BPTI, y que inhibe la plasmina y tiene una actividad de anticoagulación reducida en comparación con el dominio Kunitz de tipo silvestre de TFPI-2.
6. Un polipéptido que comprende la SEC ID Nº 1 o una secuencia que tiene al menos el 79% de identidad con la SEC ID Nº 1, con una sustitución de leucina a arginina o lisina en la posición 17 y una sustitución de tirosina a treonina en la posición 11, usando el sistema de numeración BPTI, y que inhibe la plasmina y tiene una actividad de anticoagulación reducida en comparación con el dominio Kunitz de tipo silvestre de TFPI-2.
7. El polipéptido de la reivindicación 6, en el que la secuencia de aminoácidos tiene al menos el 80% de identidad con la SEC ID Nº 1.
8. Un polipéptido que comprende la SEC ID Nº 1 o una secuencia que tiene al menos el 79% de identidad con la SEC ID Nº 1, con una sustitución de leucina a arginina o lisina en la posición 17 y una sustitución de ácido aspártico a tirosina en la posición 10, usando el sistema de numeración BPTI, y que inhibe la plasmina y tiene una actividad de anticoagulación reducida en comparación con el dominio Kunitz de tipo silvestre de TFPI-2.
9. Un polipéptido que comprende la SEC ID Nº 1 o una secuencia que tiene al menos el 79% de identidad con la SEC ID Nº 1, con una sustitución de leucina a arginina o lisina en la posición 17 y una sustitución de ácido aspártico a ácido glutámico en la posición 10, usando el sistema de numeración BPTI, y que inhibe la plasmina y tiene una actividad de anticoagulación reducida en comparación con el dominio Kunitz de tipo silvestre de TFPI-2.
10. Un polipéptido que comprende la SEC ID Nº 1 o una secuencia que tiene al menos el 79% de identidad con la SEC ID Nº 1, con una sustitución de leucina a arginina o lisina en la posición 17 y una sustitución de alanina a metionina, glicina o serina en la posición 16, usando el sistema de numeración BPTI, y que inhibe la plasmina y tiene una actividad de anticoagulación reducida en comparación con el dominio Kunitz de tipo silvestre de TFPI-2.
11. Un polipéptido que comprende la SEC ID Nº 1 o una secuencia que tiene al menos el 79% de identidad con la SEC ID Nº 1, con una sustitución de leucina a arginina o lisina en la posición 17 y una o más sustituciones seleccionadas entre el grupo constituido por una sustitución de tirosina a treonina en la posición 11, una sustitución de alanina a metionina, glicina o serina en la posición 16, o una sustitución de ácido aspártico a tirosina o ácido glutámico en la posición 10, usando el sistema de numeración BPTI, y que inhibe la plasmina y tiene una actividad de anticoagulación reducida en comparación con el dominio Kunitz de tipo silvestre de TFPI-2.
12. El polipéptido de la reivindicación 11, en el que la secuencia de aminoácidos tiene al menos el 80% de identidad con la SEC ID Nº 1.
13. Un ácido nucleico que codifica el polipéptido de una cualquiera de las reivindicaciones 1-12.
14. Un procedimiento in vitro de inhibición de al menos una actividad de plasmina que comprende poner en contacto plasmina con una cantidad eficaz del polipéptido de una cualquiera de las reivindicaciones 1-12.
15. Una composición que comprende el polipéptido de una cualquiera de las reivindicaciones 1-12 para uso para el tratamiento de una afección en un sujeto seleccionada entre angiogénesis; tumorigénesis; hemofilia; síndrome de respuesta inflamatoria sistémica (SIRS) ; remodelación ósea; cirugía; cirugía ortopédica; injerto de derivación de la arteria coronaria (CABG) ; artritis reumatoide; o para uso para una reducción de la pérdida de sangre.
16. Uso de una cantidad eficaz del polipéptido de una cualquiera de las reivindicaciones 1-12 para preparar un medicamento para el tratamiento de una afección en un sujeto seleccionada entre angiogénesis; tumorigénesis; hemofilia; síndrome de respuesta inflamatoria sistémica (SIRS) ; remodelación ósea; cirugía; cirugía
ortopédica; injerto de derivación de la arteria coronaria (CABG) ; artritis reumatoide; o para uso para una reducción de la pérdida de sangre.
17. La composición para el uso de la reivindicación 15 o el uso de la reivindicación 16, en la que la afección es angiogénesis; tumorigénesis; hemofilia; o síndrome de respuesta inflamatoria sistémica (SIRS) . 10
18. La composición para el uso de la reivindicación 15 o el uso de la reivindicación 16, en la que el tratamiento es para un sujeto sometido a remodelación ósea; para un sujeto sometido a cirugía ortopédica; o para un sujeto sometido a injerto de derivación de la arteria coronaria (CABG) .
19. El polipéptido de una cualquiera de las reivindicaciones 1-12, para uso en el tratamiento de artritis reumatoide en un sujeto que lo necesita.
20. El polipéptido de una cualquiera de las reivindicaciones 1-12, en el que un ligando está unido al
polipéptido. 20
21. Un animal no humano transgénico que comprende el ácido nucleico de la reivindicación 13.
Patentes similares o relacionadas:
Composiciones útiles en el tratamiento de la deficiencia de ornitina transcarbamilasa (OTC), del 8 de Julio de 2020, de THE TRUSTEES OF THE UNIVERSITY OF PENNSYLVANIA: Un vector vírico recombinante que comprende una secuencia de ácido nucleico que codifica la proteína ornitina transcarbamilasa humana (hOTC) y secuencias […]
Terapia génica para la diabetes, del 8 de Julio de 2020, de UCL Business Ltd: Una molécula de ácido nucleico que comprende una secuencia de nucleótidos que codifica una proteína preproinsulina funcional en donde la secuencia de nucleótidos tiene al menos […]
Vacuna de ADN que contiene un epítopo específico de VEGF y/o un epítopo específico de angiopoyetina-2, del 1 de Julio de 2020, de OSAKA UNIVERSITY: Un vector de expresión que codifica un polipéptido del antígeno del núcleo del virus de la hepatitis B quimérico con una inserción para uso en el tratamiento o la profilaxis […]
Composiciones para modular la expresión de SOD-1, del 24 de Junio de 2020, de Biogen MA Inc: Un compuesto antisentido según la siguiente fórmula: mCes Aeo Ges Geo Aes Tds Ads mCds Ads Tds Tds Tds mCds Tds Ads mCeo Aes Geo mCes Te (secuencia […]
Ácido nucleico antisentido, del 24 de Junio de 2020, de NIPPON SHINYAKU CO., LTD.: Un oligómero antisentido de 14 a 32 bases de longitud, que comprende dos unidades de oligómeros conectadas seleccionadas del grupo que consiste […]
Plekhg5 como diana farmacéutica para trastornos neurológicos, del 15 de Junio de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC): Plekhg5 como diana farmacéutica para trastornos neurológicos. La invención hace referencia al uso del gen Plekhg5 como diana farmacológica para el cribado, […]
Vectores de AAV dirigidos a oligodendrocitos, del 10 de Junio de 2020, de THE UNIVERSITY OF NORTH CAROLINA AT CHAPEL HILL: Un ácido nucleico que codifica una cápside de AAV, comprendiendo el ácido nucleico una secuencia codificante de la cápside de AAV que es al menos el 96 % idéntica […]
Método para activar células T auxiliares, del 10 de Junio de 2020, de OTSUKA PHARMACEUTICAL CO., LTD.: Una composición para su uso en el tratamiento o prevención del cáncer mediante la activación de células T auxiliares en un sujeto, en donde dicha composición […]