Procedimiento y sistema para la purificación a escala industrial de bacteriófagos destinados para terapia con bacteriófagos.
Procedimiento para una purificación a escala industrial de bacteriófagos destinados para terapia conbacteriófagos,
que comprende las etapas de:
- hacer crecer bacterias huésped de dichos bacteriófagos;
- mezclar bacterias y bacteriófagos con el fin de permitir que los bacteriófagos crezcan;
- realizar una primera filtración por rotación de una preparación de bacterias y bacteriófagos mezclados, dejandoque los bacteriófagos pasen a su través;
- filtrar por rotación por primera vez, en la que los bacteriófagos permanecen en solución en un material retenido;
- realizar una segunda filtración por rotación con contraflujo con respecto a dicha primera filtración por rotación,en la que los bacteriófagos se someten a elución; teniendo lugar dicha segunda filtración por rotación concontraflujo a bajas presiones de 0,2 bares (20 kPa) y con una rotación lenta de 200 rotaciones por minuto; y
- almacenar la solución de bacteriófagos purificados.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IT2007/000684.
Solicitante: PTC Phage Technology Center GmbH.
Nacionalidad solicitante: Alemania.
Dirección: Im Kompetenzzentrum Bio-Security, Siemensstrasse 42 59199 Bönen ALEMANIA.
Inventor/es: BARTSCH,REINHARD, LEHNHERR,HANSJÖRG.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C12N7/02 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 7/00 Virus, p. ej. bacteriófagos; Composiciones que los contienen; Su preparación o purificación (preparaciones de uso médico que contienen virus A61K 35/76; preparación de composiciones de uso médico que contienen antígenos o anticuerpos virales, p. ej. vacunas virales, A61K 39/00). › Aislamiento o purificación.
PDF original: ES-2401162_T3.pdf
Fragmento de la descripción:
Procedimiento y sistema para la purificación a escala industrial de bacteriófagos destinados para terapia con bacteriófagos La presente invención se refiere a un procedimiento y a un sistema para la purificación a escala industrial de bacteriófagos destinados para terapia con bacteriófagos.
Como adaptación al entorno selectivo con el que se encuentran, muchas bacterias patógenas se han vuelto resistentes a una amplia gama de antibióticos [9]. Por lo tanto, existe una alta demanda de formas alternativas de tratar tales bacterias resistentes. La terapia con bacteriófagos es una de las alternativas en consideración hoy en día. A nivel mundial, el interés en la terapia con bacteriófagos se encuentra en alza, después de que este haya estado latente en el mundo occidental durante casi 60 años [6]. Las aplicaciones anteriores de la terapia con bacteriófagos se han visto obstaculizadas por la incapacidad para purificar las preparaciones de bacteriófagos con el fin de retirar las exo- y endotoxinas, así como para preservar la actividad biológica de los bacteriófagos [8]. Los procedimientos actuales para producir y purificar bacteriófagos se derivan de procedimientos de laboratorio y no son adecuados para preparaciones a gran escala. La presente invención se refiere a la producción y a la purificación a gran escala de preparaciones de bacteriófagos con el fin de combatir enfermedades infecciosas, en especial, pero no exclusivamente, cuando las bacterias que dan lugar a estas enfermedades son resistentes a los antibióticos. Esta describe un procedimiento para producir, a escala industrial, unas composiciones de bacteriófagos que están sumamente concentradas y libres de cualquier resto tóxico (residuos bacterianos, endo-y exotoxinas bacterianas) , que son el producto secundario del procedimiento de producción.
El uso de bacteriófagos para combatir las infecciones bacterianas ya lo ha propuesto d’Hérelle, el codescubridor de los bacteriófagos [2]. No obstante, a pesar de que parte de las aplicaciones tempranas mostraron ser exitosas, otras no lo fueron, debido principalmente, de manera retrospectiva, a la falta de conocimiento acerca de las interacciones entre los bacteriófagos y sus bacterias huésped [11]. Con la aparición del campo de los antibióticos, se abandonó todo intento de establecer bacteriófagos como agentes antimicrobianos en la medicina occidental. Por otro lado, los bacteriófagos se usaron ampliamente en la antigua Unión Soviética y en Polonia, pero desafortunadamente, la mayor parte de los estudios orientales que muestran la eficacia de la terapia con bacteriófagos no cumplen las normas de nuestros actuales sistemas médicos. No obstante, los bacteriófagos sirvieron como herramientas de estudio principales en el campo de la biología molecular tanto en Oriente como en Occidente y, por lo tanto, se han investigado de manera intensiva en muchos laboratorios a lo largo de los últimos ochenta años [1]. El conocimiento adquirido a partir de esta investigación básica debería mostrarse ahora útil para preparar unas preparaciones de bacteriófagos mejoradas que cumplan los estrictos criterios que requieren las aplicaciones tanto en animales como en seres humanos [7, 11].
En la presente invención, los bacteriófagos se amplifican en fermentadores a gran escala o, como alternativa, sobre un medio semisólido (véase la solicitud de patente de los Estados Unidos 2007/001001) , produciendo cientos de litros de solución enriquecida en bacteriófagos, pero contaminada con residuos bacterianos, toxinas y componentes del medio de crecimiento bacteriano. Una solución de este tipo se pasa a continuación a través de una serie de filtros con el fin de separar los bacteriófagos de estas sustancias contaminantes. En el procedimiento, el medio de crecimiento bacteriano que contiene los bacteriófagos se sustituye por una solución adecuada para el envasado y el almacenamiento a largo plazo de los bacteriófagos.
La presente invención puede usarse para purificar cualquier bacteriófago a gran escala, lo que da como resultado unas preparaciones que pueden usarse directamente como agentes desinfectantes o productos médicos para su uso tanto en animales como en seres humanos.
Los bacteriófagos son omnipresentes en el entorno. Por lo tanto, los expertos en la materia conocen procedimientos para aislar y enriquecer nuevos bacteriófagos con las gamas de huéspedes deseadas [4, 5, 10]. En teoría, es posible aislar bacteriófagos que crezcan sobre cualquier patógeno bacteriano conocido. No obstante, no todos los bacteriófagos encontrados en la naturaleza son adecuados también para las aplicaciones prácticas. Una caracterización genética precisa de los fagos aislados será esencial para seleccionar aquellos que destruyan sus bacterias huésped con una alta eficacia y que no transfieran rasgo no deseado alguno [8]. La identificación de aquellos bacteriófagos que son los más adecuados para una tarea específica constituye una destreza técnica en sí misma (véase, por ejemplo, el documento WO 2004/004495) . Asimismo, existen diversos procedimientos para mejorar los aislados naturales o para modificar sus propiedades, tal como se describe en las patentes de los Estados Unidos 5811093 o 7087226.
Habitualmente, los bacteriófagos se hacen crecer en cultivos líquidos usando unos fermentadores de diversos tamaños [3]. Como alternativa, se puede hacer que los bacteriófagos crezcan también sobre un medio semisólido, según se divulga en la solicitud de patente de los Estados Unidos 2007/0010001. No obstante, cualquiera de estos dos procedimientos crea unos volúmenes igualmente grandes de soluciones que contienen fagos líquidas que necesitan purificarse para su uso adicional. Se han descrito diferentes procedimientos para la purificación de las partículas de tipo virus y los virus, en especial de bacteriófagos, por ejemplo, en los documentos EP 1736 538 A, EP 1780 269 A y por Smrekar y col. [12]. El procedimiento de laboratorio convencional actual, tal como se perfila a continuación, sigue un protocolo de múltiples etapas que requiere mucho trabajo y, por lo tanto, es adecuado solo para volúmenes más pequeños de líquido.
1. La solución que contiene bacteriófagos se aclara por centrifugación.
2. Se añade polietilenglicol al líquido con el fin de hacer que precipiten los bacteriófagos. El polietilenglicol es un agente reticulante reversible no específico, que hace que precipite la totalidad de las proteínas presentes en la solución. El procedimiento de precipitación toma aproximadamente 12-18 horas a 4 grados centígrados.
3. Precipitación de los bacteriófagos por centrifugación.
4. Resuspensión de los bacteriófagos precipitados en la cantidad mínima de un líquido adecuado. Durante la presente etapa, habitualmente los bacteriófagos se concentran aproximadamente 50 veces.
5. Esta solución se estratifica cuidadosamente a continuación sobre un gradiente en densidad de CsCl2 y se procesa por centrifugación en una ultracentrífuga. En la presente etapa, los bacteriófagos se separan de otras proteínas e impurezas de acuerdo con su densidad específica. Este procedimiento toma aproximadamente 24 horas.
6. Aislamiento de los bacteriófagos usando una jeringuilla con una aguja de punta afilada. Este procedimiento requiere un pulso firme y un cierto grado de destreza técnica experimental.
7. Retirada de la solución de CsCl2 por diálisis (de 12 a 24 horas) frente a un tampón de elección.
A pesar de que este procedimiento da como resultado unas preparaciones de bacteriófagos sumamente puras, parece obvio que este no puede aplicarse para purificar bacteriófagos a escala industrial. El procedimiento no solo consume mucho tiempo, sino que requiere una cantidad desmesurada de trabajo manual y tampoco es rentable.
En Georgia y en la antigua Unión Soviética, los bacteriófagos no se purificaron hasta este punto [3]. Habitualmente, las soluciones de bacteriófagos solo se esterilizaron por filtración y, a continuación, se envasaron directamente para las aplicaciones. No obstante, un procedimiento de este tipo no retira un gran número de proteínas bacterianas, entre las mismas toxinas y casi la totalidad de los componentes del medio de crecimiento bacteriano, lo que hace que tales soluciones no sean adecuadas para las presentes aplicaciones.
Los anteriores objetivos y ventajas, así como otros, de la invención, según será evidente a partir de la siguiente descripción, se obtienen con un procedimiento y un sistema tal como se divulga, respectivamente, en las reivindicaciones independientes. Las realizaciones preferentes y variaciones no triviales de la presente invención son la materia objeto de las reivindicaciones... [Seguir leyendo]
Reivindicaciones:
1. Procedimiento para una purificación a escala industrial de bacteriófagos destinados para terapia con bacteriófagos, que comprende las etapas de:
- hacer crecer bacterias huésped de dichos bacteriófagos;
-mezclar bacterias y bacteriófagos con el fin de permitir que los bacteriófagos crezcan;
- realizar una primera filtración por rotación de una preparación de bacterias y bacteriófagos mezclados, dejando que los bacteriófagos pasen a su través;
- filtrar por rotación por primera vez, en la que los bacteriófagos permanecen en solución en un material retenido;
- realizar una segunda filtración por rotación con contraflujo con respecto a dicha primera filtración por rotación, en la que los bacteriófagos se someten a elución; teniendo lugar dicha segunda filtración por rotación con contraflujo a bajas presiones de 0, 2 bares (20 kPa) y con una rotación lenta de 200 rotaciones por minuto; y
- almacenar la solución de bacteriófagos purificados.
2. Procedimiento de acuerdo con la reivindicación 1, caracterizado porque además comprende, después de dicha primera etapa de filtración, una segunda etapa de filtración de la preparación de bacterias y bacteriófagos mezclados.
3. Procedimiento de acuerdo con la reivindicación 1 o 2, caracterizado porque dicha primera etapa de filtración y/o dicha segunda etapa de filtración son etapas de filtración rotatorias de flujo cruzado, realizándose dicha primera etapa de filtración mediante el uso de unos poros cuyo tamaño es igual a 1.000 nanómetros, realizándose dicha segunda etapa de filtración mediante el uso de unos poros cuyo tamaño es igual a 200 nanómetros.
4. Procedimiento de acuerdo con la reivindicación 1, caracterizado porque, en dicha etapa de almacenamiento, la solución de bacteriófagos se somete a un vórtice o una rotación adaptados para obtener una distribución homogénea de bacteriófagos.
5. Procedimiento de acuerdo con la reivindicación 1, caracterizado porque además comprende la etapa de envasado de la solución de bacteriófagos en forma líquida.
6. Procedimiento de acuerdo con la reivindicación 1, caracterizado porque además comprende la etapa de envasado de la solución de bacteriófagos en forma seca después de liofilización.
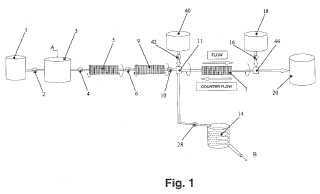
7. Sistema para una purificación a escala industrial de bacteriófagos destinados para terapia con bacteriófagos, que comprende:
- un primer fermentador (1) , preferentemente de un tipo quimioestático de alta densidad celular, adaptado para realizar un crecimiento continuo de las bacterias huésped;
- un segundo fermentador (3) conectado con dicho primer fermentador (1) y adaptado para realizar una mezcla de bacterias y bacteriófagos con el fin de permitir que los bacteriófagos crezcan;
caracterizado porque además comprende:
-una unidad de filtración (5) conectada con dicho segundo fermentador (3) y adaptada para filtrar dicha preparación de bacterias y bacteriófagos dejando que los bacteriófagos pasen a su través; y
- una unidad de filtración rotatoria (7) conectada con dicha unidad de filtración (5) adaptada para realizar una primera filtración por rotación, en la que los bacteriófagos permanecen en solución en el material retenido, y una segunda filtración por rotación con contraflujo con respecto a dicha primera filtración por rotación, en la que los bacteriófagos se someten a elución, teniendo lugar dicha segunda filtración por rotación con contraflujo a bajas presiones de 0, 2 bares (20 kPa) y con una rotación lenta de 200 rotaciones por minuto.
8. Sistema de acuerdo con la reivindicación 7, caracterizado porque además comprende:
- una primera unidad de bombeo (42) conectada con dicha unidad de filtración rotatoria (7) y adaptada para bombear una solución de elución a través de la unidad de filtración rotatoria (7) , reteniendo los bacteriófagos en el material retenido;
- un recipiente de almacenamiento intermedio (14) para la solución de bacteriófagos purificados; y
- una segunda unidad de bombeo (16) conectada con dicha unidad de filtración rotatoria (7) y adaptada para bombear una solución de limpieza a través de dicha unidad de filtración rotatoria (7) al interior de dicho recipiente de almacenamiento intermedio (14) .
9. Sistema de acuerdo con la reivindicación 7, caracterizado porque además comprende:
- una primera unidad de bombeo (10) conectada con dicha unidad de filtración rotatoria (7) y adaptada para bombear una solución de elución de dichos bacteriófagos en el material retenido;
- un recipiente de almacenamiento intermedio (14) para la solución de bacteriófagos purificados;
- una segunda unidad de bombeo (42) conectada con dicha unidad de filtración rotatoria (7) y con dicho recipiente intermedio (14) y adaptada para bombear una solución de limpieza al interior de dicha unidad de filtración rotatoria (7) ;
- una tercera unidad de bombeo (16) conectada con dicha unidad de filtración rotatoria (7) y adaptada para bombear al interior de dicha solución de bacteriófagos, una solución de contraflujo, y para bombear a continuación ambas soluciones al interior de dicha unidad de filtración rotatoria (7) para el contraflujo en un sentido opuesto; y - opcionalmente, una cuarta unidad de bombeo (28) conectada con dicha unidad de filtración rotatoria (7) y adaptada para bombear la solución final de bacteriófagos limpios al interior de dicho recipiente de almacenamiento intermedio (14) .
10. Sistema de acuerdo con la reivindicación 9, caracterizado porque, en dicho recipiente de almacenamiento intermedio (14) , la solución obtenida se somete a vórtice o rotación para obtener una distribución homogénea y purificada de bacteriófagos.
11. Sistema de acuerdo con la reivindicación 7, caracterizado porque dicha unidad de filtración (5) tiene unos poros cuyo tamaño es igual a 1.000 nanómetros, y dicho sistema comprende una unidad de filtración (9) adicional que contiene unos poros cuyo tamaño es igual a 200 nanómetros.
12. Sistema de acuerdo con la reivindicación 11, caracterizado porque dicha unidad de filtración (5) y dicha unidad de filtración (9) adicional son del tipo rotatorio.
13. Sistema de acuerdo con la reivindicación 7, caracterizado porque dicha unidad de filtración rotatoria (7) se divide en dos unidades de filtración rotatoria (7A, 7B) separadas idénticas, estando la primera (7A) de dichas unidades de filtración rotatoria (7A, 7B) separadas conectada con dicha unidad de filtración (5) y estando adaptada para realizar una primera filtración por rotación, en la que los bacteriófagos permanecen en solución en el material retenido, estando la segunda (7B) de dichas unidades de filtración rotatoria (7A, 7B) separadas conectada con dicha primera unidad de filtración rotatoria (7A) y estando adaptada para realizar una segunda filtración por rotación con contraflujo con respecto a dicha primera unidad de filtración rotatoria (7A) , en la que los bacteriófagos se someten a elución y la solución obtenida se somete a vórtice o rotación para obtener una distribución homogénea y purificada de bacteriófagos.
14. Sistema de acuerdo con la reivindicación 7, caracterizado porque dicha unidad de filtración rotatoria (7) está adaptada para realizar por primera vez una primera filtración por rotación, en la que los bacteriófagos permanecen en solución en el material retenido, y posteriormente está adaptada para realizar por separado una segunda filtración por rotación con contraflujo con respecto a dicha primera filtración por rotación, en la que los bacteriófagos se someten a elución y la solución obtenida se somete a vórtice o rotación para obtener una distribución homogénea y purificada de bacteriófagos.
15. Sistema de acuerdo con la reivindicación 7, caracterizado porque dicha unidad de filtración rotatoria (7) está adaptada para desmontarse de uno de dichos sistemas y dicha unidad de filtración rotatoria (7) desmontada está adaptada para insertarse en otro de dichos sistemas.
Patentes similares o relacionadas:
Virus recombinantes de la influenza de alto título con replicación mejorada en células Vero, del 29 de Julio de 2020, de WISCONSIN ALUMNI RESEARCH FOUNDATION: Una célula Vero infectada con un virus de la influenza recombinante aislado reordenado que comprende un segmento del gen HA que codifica […]
Señal para el empaquetamiento de vectores del virus de la gripe, del 24 de Junio de 2020, de WISCONSIN ALUMNI RESEARCH FOUNDATION: Un vector del virus de la gripe para la expresión y empaquetamiento de ARNv recombinante, en el que el vector comprende: secuencias correspondientes […]
Nuevo bacteriófago y composición que comprende al mismo, del 25 de Marzo de 2020, de CJ CHEILJEDANG CORPORATION: Un bacteriófago ΦCJ24 (KCCM11462P) que tiene una capacidad específica para eliminar la Escherichia coli patogénica aviar.
Nuevo bacteriófago y composición que comprende el mismo, del 25 de Marzo de 2020, de CJ CHEILJEDANG CORPORATION: Un bacteriófago ΦCJ25 (KCCM11463P) que tiene una capacidad específica para matar Escherichia coli patógena aviar.
Nuevo bacteriófago y composición que comprende el mismo, del 25 de Marzo de 2020, de CJ CHEILJEDANG CORPORATION: Un bacteriófago ΦCJ26 (KCCM11464P) que tiene una capacidad específica para matar Salmonella. Una composición que comprende el bacteriófago ΦCJ26 (KCCM11464P) según […]
Procedimiento para purificar partículas similares a virus (VLP), del 6 de Noviembre de 2019, de Life Science Inkubator Betriebs GmbH & Co. KG: Procedimiento para la purificación de partículas similares a virus (VLP), caracterizado porque se filtra una composición que contiene VLP por un medio filtrante con […]
Método para la producción y purificación a gran escala de parvovirus, del 23 de Octubre de 2019, de DEUTSCHES KREBSFORSCHUNGSZENTRUM: Un método para producir partículas de parvovirus vacías inactivas o completas activas, comprendiendo dicho método: (a) proporcionar la estirpe […]
Purificación del virus del herpes, del 23 de Octubre de 2019, de Sanofi Pasteur Biologics, LLC: Una composición que comprende partículas purificadas del virus del herpes simple (VHS) en un tampón de estabilización líquido, en donde el tampón de estabilización […]