PROCEDIMIENTO DE SEMISINTESIS PARA LA PREPARACION DE 10-DESACETIL-N-DESBENZOIL-PACLITAXEL.
Procedimiento para la preparación de 10-desacetil-N-desbenzoil-paclitaxel (I) **(Ver fórmula)** que comprende las siguientes etapas:
a) hacer reaccionar ácido 2-(2,4-dimetoxifenil)-3-(2-nitrobencenosulfenil)-4(S)-fenil-5(R)-oxazolidincarboxílico (V) **(Ver fórmula)** con 10-desacetil-bis-7,10-tricloroacetilbacatina III (VI) **(Ver fórmula)** para dar éster 10-desacetil-7,10-bis-tricloroacetilbacatina III 13-ílico del ácido 2-(2,4-dimetoxifenil)-3-(2-nitrobencenosulfenil)-4(S)-fenil-5(R)-oxazolidincarboxílico (VII) **(Ver fórmula)** b) hidrolizar los grupos tricloroacetilo en las posiciones 7 y 10 del compuesto de fórmula (VII) para dar éster 10-desacetilbacatina III 13-ílico del ácido 2-(2,4-dimetoxifenil)-3-(2-nitrobencenosulfenil)-4(S)-fenil-5(R)-oxazolidincarboxílico (VIII) **(Ver fórmula)** c) tratar con ácido el compuesto de fórmula (VIII) para dar 10-desacetil-N-desbenzoil-paclitaxel (I)
Tipo: Resumen de patente/invención. Número de Solicitud: W05010822EP.
Solicitante: INDENA S.P.A..
Nacionalidad solicitante: Italia.
Dirección: VIALE ORTLES, 12,20139 MILANO.
Inventor/es: BOMBARDELLI, EZIO, FONTANA, GABRIELE, GABETTA, BRUNO, GAMBINI,ANDREA.
Fecha de Publicación: .
Fecha Concesión Europea: 9 de Diciembre de 2009.
Clasificación Internacional de Patentes:
- C07D305/14 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 305/00 Compuestos heterocíclicos que contienen ciclos de cuatro miembros que tienen un átomo de oxígeno como único heteroátomo del ciclo. › condensados con ciclos o sistemas cíclicos carbocíclicos.
- C07D413/12 C07D […] › C07D 413/00 Compuestos heterocíclicos que contienen dos o más heterociclos, teniendo al menos un ciclo átomos de nitrógeno y oxígeno como únicos heteroátomos del ciclo. › unidos por una cadena que contiene heteroátomos como enlaces de cadena.
Clasificación PCT:
- C07D305/14 C07D 305/00 […] › condensados con ciclos o sistemas cíclicos carbocíclicos.
Fragmento de la descripción:
Procedimiento de semisíntesis para la preparación de 10-desacetil-N-desbenzoil-paclitaxel.
Campo de la invención
El objeto de la presente invención es un nuevo procedimiento de semisíntesis para la preparación de 10-desacetil-N-desbenzoil-paclitaxel (I), un sintón útil para la preparación de taxanos con actividad antitumoral.

Estado de la técnica
Un procedimiento que comprende la esterificación con oxazolidinas de fórmula (II)

de 10-desacetilbacatina protegida en las posiciones 7 y 10 de fórmula (III)

para dar ésteres de fórmula (IV)

se ha dado a conocer en el documento WO 94/07877 para la síntesis del sintón (I), notificado en la bibliografía a principios de los 90 (F. Guéritte-Voegelein et al., J. Med. Chem. 34, 992, 1991).
La liberación de la función amino en la posición 3' y los grupos hidroxilo en las posiciones 2', 7 y 10 de los ésteres de fórmula (IV) proporciona el sintón (I).
En particular, según la solicitud de patente citada anteriormente, los grupos R pueden ser hidrógeno, alquilo, alcoxilo o fenilo sustituido de diversa manera y R1 es alquilo sustituido con uno o más átomos de cloro. Los grupos G son grupos alquilsililo o R1-O-CO en los que R1 es según lo definido anteriormente.
Partiendo de los productos intermedios de fórmula (IV), las funciones hidroxilo y amino se liberan mediante reducción con zinc y ácidos y, cuando los grupos G son alquilsililo, las funciones hidroxilo se liberan mediante tratamiento con ácido, por ejemplo con ácido fluorhídrico.
Sumario de la invención
La presente invención, en una primera realización de la misma, se refiere a un procedimiento para la preparación de 10-desacetil-N-desbenzoil-paclitaxel (I)

que comprende las siguientes etapas:
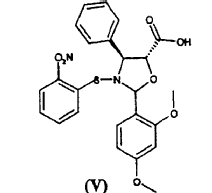
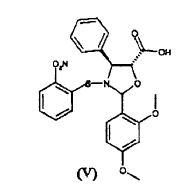
a) hacer reaccionar ácido 2-(2,4-dimetoxifenil)-3-(2-nitrobencenosulfenil)-4(S)-fenil-5(R)-oxazolidincarboxílico (V)
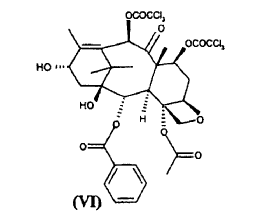
con 10-desacetil-bis-7,10-tricloroacetilbacatina III (VI)

para dar éster 10-desacetil-7,10-bis-tricloroacetilbacatina III 13-ílico del ácido 2-(2,4-dimetoxifenil)-3-(2-nitrobencenosulfenil)-4(S)-fenil-5(R)-oxazolidincarboxílico (VII)

b) hidrolizar los grupos tricloroacetilo en las posiciones 7 y 10 del compuesto de fórmula (VII) para dar éster 10-desacetilbacatina III 13-ílico del ácido 2-(2,4-dimetoxifenil)-3-(2-nitrobencenosulfenil)-4(S)-fenil-5(R)-oxazolidincarboxílico (VIII)

c) tratar con ácido el compuesto de fórmula (VIII) para dar 10-desacetil-N-desbenzoil-paclitaxel (I).
La invención proporciona también como nuevos productos intermedios éster 10-desacetil-7,10-bis-tricloroacetilbacatina III 13-ílico del ácido 2-(2,4-dimetoxifenil)-3-(2-nitrobencenosulfenil)-4(S)-fenil-5(R)-oxazolidincarboxílico (VII) y éster 10-desacetilbacatina III 13-ílico del ácido 2-(2,4-dimetoxifenil)-3-(2-nitrobencenosulfenil)-4(S)-fenil-5(R)-oxazolidincarboxílico (VIII).
Descripción de la invención
La presente invención se refiere a un procedimiento para la síntesis del sintón (I)

con un alto rendimiento y/o calidad. El procedimiento además no requiere reactivos contaminantes o difíciles de manejar, tales como zinc y ácido fluorhídrico.
El procedimiento consiste en la reacción de ácido 2-(2,4-dimetoxifenil)-3-(2-nitrobencenosulfenil)-4(S)-fenil-5(R)-oxazolidincarboxílico (V)

con 10-desacetil-bis-7,10-tricloroacetilbacatina III (VI)
para dar el éster (VII)

a partir del cual se obtiene el sintón (I) después de la liberación de las funciones amino e hidroxilo.
El compuesto de fórmula (VII) es novedoso y es un objeto adicional de la presente invención.
El ácido de oxazolidina (V) o bien 2R, 2S o bien una mezcla de éstos, es igualmente útil en la síntesis, ya que el centro quiral en la posición 2 del anillo de oxazolina se elimina del producto intermedio (VII) tras la liberación de las funciones amino e hidroxilo. En otras palabras, la razón relativa entre los diastereoisómeros no deteriora el rendimiento de la síntesis.
El ácido de oxazolidina (V) se prepara fácilmente mediante el tratamiento con ácido de las correspondientes sales alcalinas, cuya preparación se ha dado a conocer en el documento WO 03/087077 A1.
En comparación con otros ácidos de oxazolidina, el ácido (V) se caracteriza por su notable estabilidad; lo que permite llevar a cabo fácilmente la esterificación con el sintón (VI).
Además, después de la esterificación, la liberación de las funciones amino e hidroxilo contenidas en el residuo ácido pueden llevarse a cabo fácilmente mediante tratamiento con ácidos, sin la necesidad de adoptar condiciones drásticas.
El sintón de taxano (VI) puede obtenerse a partir de un metabolito natural 10-desacetilbacatina III a través de la esterificación de las posiciones 7 y 10 mediante tratamiento con derivados activados del ácido tricloroacético, según métodos de esterificación conocidos. Preferiblemente, el sintón (VI) se obtiene mediante reacción con cloruro de ácido tricloroacético a una temperatura de aproximadamente 0ºC, usando piridina como disolvente. Preferiblemente, la 10-desacetil-bis-7,10-tricloroacetilbacatina III (VI), se purifica de sus correspondientes ésteres 7 y 10-mono-tricloroacetílicos mediante cromatografía en gel de sílice o métodos equivalentes. La cantidad residual de dichas impurezas no debe superar el 0,1% tal como se mide mediante los % de picos de HPLC.
Según la presente invención, la esterificación de (VI) con el ácido de oxazolidina (V) para dar (VII) puede llevarse a cabo en presencia de un agente de condensación, tal como la diimida, por ejemplo diciclohexilcarbodiimida, y un agente de activación, por ejemplo 4-dimetilamino-piridina o 4-pirrolidino-piridina en un disolvente seleccionado de un éter, tal como etil éter, diisopropil éter, tetrahidrofurano o dioxano; un éster, tal como acetato de etilo, propilo o butilo; un hidrocarburo aromático, tal como benceno, tolueno o o-, m-, p-xileno; o un hidrocarburo alifático halogenado, por ejemplo cloruro de metileno, cloroformo o dicloroetano. Llevar a cabo la esterificación en cloruro de metileno a una temperatura de aproximadamente 20ºC es particularmente ventajoso.
La preparación del sintón (I) a partir del éster (VII) requiere la eliminación de los grupos tricloroacetilo de las posiciones 7 y 10 y la liberación de las funciones amino e hidroxilo del residuo de oxazolidina.
Tal como se mencionó anteriormente, las funciones amino e hidroxilo pueden...
Reivindicaciones:
1. Procedimiento para la preparación de 10-desacetil-N-desbenzoil-paclitaxel (I)

que comprende las siguientes etapas:
a) hacer reaccionar ácido 2-(2,4-dimetoxifenil)-3-(2-nitrobencenosulfenil)-4(S)-fenil-5(R)-oxazolidincarboxílico (V)
con 10-desacetil-bis-7,10-tricloroacetilbacatina III (VI)

para dar éster 10-desacetil-7,10-bis-tricloroacetilbacatina III 13-ílico del ácido 2-(2,4-dimetoxifenil)-3-(2-nitrobencenosulfenil)-4(S)-fenil-5(R)-oxazolidincarboxílico (VII)

b) hidrolizar los grupos tricloroacetilo en las posiciones 7 y 10 del compuesto de fórmula (VII) para dar éster 10-desacetilbacatina III 13-ílico del ácido 2-(2,4-dimetoxifenil)-3-(2-nitrobencenosulfenil)-4(S)-fenil-5(R)-oxazolidincarboxílico (VIII)

c) tratar con ácido el compuesto de fórmula (VIII) para dar 10-desacetil-N-desbenzoil-paclitaxel (I).
2. Procedimiento según la reivindicación 1, en el que la etapa a) se lleva a cabo en un disolvente seleccionado de un éter, un éster, un hidrocarburo aromático o un disolvente alifático halogenado.
3. Procedimiento según la reivindicación 2, en el que el hidrocarburo halogenado alifático es cloruro de metileno.
4. Procedimiento según una cualquiera de las reivindicaciones 1 - 3, en el que la etapa a) se lleva a cabo en presencia de un agente de condensación y un agente de activación.
5. Procedimiento según la reivindicación 4, en el que el agente de condensación es diciclohexilcarbodiimida y el agente de activación es 4-dimetilamino-piridina.
6. Procedimiento según una cualquiera de las reivindicaciones 1 a 5, en el que la etapa b) se lleva a cabo con hidróxido de amonio en tetrahidrofurano como disolvente.
7. Procedimiento según una cualquiera de las reivindicaciones 1 a 6, en el que la etapa c) se lleva a cabo con una disolución en metanol de ácido clorhídrico acuoso.
8. Éster 10-desacetil-7,10-bis-tricloroacetilbacatina III 13-ílico del ácido 2-(2,4-dimetoxifenil)-3-(2-nitrobencenosulfenil)-4(S)-fenil-5(R)-oxazolidincarboxílico (VII)

9. Éster 10-desacetilbacatina III 13-ílico del ácido 2-(2,4-dimetoxifenil)-3-(2-nitrobencenosulfenil)-4(S)-fenil-5(R)-oxazolidincarboxílico (VIII)

Patentes similares o relacionadas:
Reactivos de merilformilo sustituido y procedimiento de uso de los mismos para modificar propiedades fisicoquímicas y/o farmacocinéticas de compuestos, del 15 de Enero de 2020, de Sphaera Pharma Pte. Ltd: Un compuesto farmacéutico modificado, que se selecciona entre el grupo que consiste en: - Compuesto n.º 295: yoduro de 1-(acetoximetil)-4-((4-etoxi-3-(1-metil-7-oxo-3-propil-4,7-dihidro-1H-pirazolo[4,3- […]
Forma cristalina de cabazitaxel y proceso para la preparación de la misma, del 17 de Junio de 2019, de FRESENIUS KABI ONCOLOGY LIMITED: Una forma cristalina 1 de cabazitaxel, que se caracteriza por un patrón de difracción de polvo de rayos X (XRD), determinado con una radiación de Cu Kα, que […]
Procedimientos para la preparación de carbazitaxel que implican la sililación en C(7)-OH y C(13)-OH o solo la sililación en C(7)-OH, del 14 de Mayo de 2019, de FRESENIUS KABI ONCOLOGY LIMITED: Un procedimiento para la preparación de cabazitaxel (I),que comprende las etapas de: a) tratar 10-desacetilbacatina de fórmula (III)**Fórmula** […]
Preparación de tesetaxel y compuestos relacionados y los compuestos intermedios de síntesis correspondientes, del 29 de Marzo de 2019, de Odonate Therapeutics, LLC: Un método de fabricación de un compuesto taxano que comprende acoplar un precursor de la cadena lateral de taxano a un grupo hidroxilo C13 del […]
Procedimiento para la preparación de cabazitaxel y sus compuestos intermedios, del 20 de Marzo de 2019, de Intas Pharmaceuticals Limited: Procedimiento para preparar cabazitaxel (I) que comprende una etapa de: reacción de un compuesto de fórmula (II)**Fórmula** donde X representa H o cadena lateral de […]
Derivados de taxano solubles en agua y sus usos, del 20 de Febrero de 2019, de Jiangsu Nhwaluokang Pharmaceutical Research and Development Co., Ltd: Un derivado de taxano soluble en agua de fórmula general (I-1), (I-2) o (I-3): **Fórmula** en donde, R1 es H o metilo; R2 es H, metilo […]
Formas de estado sólido de cabazitaxel y procesos de preparación de las mismas, del 8 de Marzo de 2017, de Teva Pharmaceuticals International GmbH: La forma cristalina III de cabazitaxel, solvato de 2-propanol, caracterizada por los datos seleccionados de: (a) un patrón de difracción de rayos X en polvo que […]
Un proceso mejorado para la preparación de derivados de taxano, del 11 de Enero de 2017, de EMCURE PHARMACEUTICALS LIMITED: Un proceso para la preparación de derivados de taxano que comprende las etapas: i) formar una mezcla de reacción de un derivado de taxano y una sal metálica […]