Procedimiento para producir un ester (4E)-5-cloro-2-isopropil-4-pentenoato y un isómero ópticamente activo de este ester.
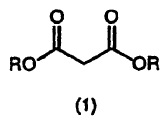
Un procedimiento de producción de un (4E)-5-cloro-2-isopropil-4-pentenoato representado por la siguiente fórmula (4) (donde R es grupo alquilo de C1 - 4 o un grupo aralquilo,
que comprende la reacción de un compuesto representado por la siguiente fórmula (2) en la presencia de un disolvente aprótico (II) con una base (II) y luego con (1E)-1, 3-dicloro-1-propeno para dar un compuesto representado por la siguiente fórmula (3), y desalcoxicarbonilación de uno u otro grupo éster del compuesto representado por la siguiente fórmula (3): (Ver fórmula)
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/JP2003/015694.
Solicitante: ASAHI GLASS COMPANY, LIMITED.
Nacionalidad solicitante: Japón.
Dirección: Shin-Marunouchi Building 1-5-1 Marunouchi Chiyoda-ku Tokyo 100-8405 JAPON.
Inventor/es: MORIZAWA, YOSHITOMI, KAMINUMA, TOSHIHIKO, MATSUMURA, YASUSHI, MORI,NOBUAKI, AOKI,YUUICHI.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07C67/32 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07C COMPUESTOS ACICLICOS O CARBOCICLICOS (compuestos macromoleculares C08; producción de compuestos orgánicos por electrolisiso electroforesis C25B 3/00, C25B 7/00). › C07C 67/00 Preparación de ésteres de ácidos carboxílicos. › Descarboxilación.
- C07C67/343 C07C 67/00 […] › por aumento del número de átomos de carbono.
- C07C67/48 C07C 67/00 […] › Separación; Purificación; Estabilización; Empleo de aditivos.
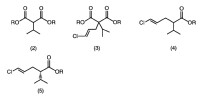
Fragmento de la descripción:
Procedimiento para producir un éster (4E) -5-cloro-2-isopropil-4-pentenoato y un isómero ópticamente activo de este éster.
Campo industrial
La presente invención se refiere a un procedimiento de producción de un (4E) -5-cloro-2-isopropil-4-pentenoato útil como intermediario para un producto agroquímico o un medicamento. La presente invención se refiere también a un procedimiento para producir un (S) - (4E) -5-cloro-2-isopropil-4-pentenoato especialmente útil como intermediario para un producto agroquímico o un medicamento.
Antecedentes de la invención
Para la síntesis de (4E) -5-cloro-2-isopropill-4-pentenoatos y sus análogos han sido publicados los siguientes procedimientos:
(1) Un procedimiento para producir un 5-cloro-2-isopropil-4-pentenoato por reacción de isopentanoato de metilo con 1, 3-dicloro-1-propeno en presencia de diisopropilamida de litio (LDA) a una temperatura extremadamente baja (-78ºC) (Patente estadounidense 4492799) .
(2) El procedimiento (1) en que la reacción se lleva a cabo a -15ºC utilizando yoduro de sodio (NaI) para una reactividad más alta (Ejemplos en WO 02/08172 y WO01/09079) .
(3) Un procedimiento para sintetizar ácido 5-cloro-2-isopropil-4-pentenoico, que comprende alquilación cuaternaria de isopropilmalonato de dietilo con 1, 3-dicloro-1-propeno en etanol como disolvente en la presencia de etóxido de sodio (NaOC2H5) , hidrólisis de las dos uniones éster y monodescarboxilación del ácido dicarboxílico resultante (Akad. Nauk Armyan, S.S.R. Khim. Nauki
1960, vol. 13 (4) , páginas 259-262 (Rusia) ) .
(4) Un procedimiento para sintetizar varios derivados de 4-pentenoato, que comprende alquilación cuaternaria de un derivado de malonato de dietilo con un derivado de cloropropeno, en tolueno como disolvente, en presencia de hidruro de sodio (NaH) y desalcoxicarbonilación de una u otra unión éster (Patente estadounidense USP4492799) .
Para la síntesis de (S) - (4E) -5-cloro-2-isopropil-4-pentenoatos ópticamente activos y sus análogos, se han publicado los siguientes procedimientos:
(5) Un procedimiento para producir (S) - (4E) -5-cloro-2-isopropil-4-pentenoato de etilo, que comprende la adición de esterasa de hígado porcino (Roche Diagnostics, Grado Industrial) , toda de una vez, al (4E) -5-cloro-2-isopropil-4-pentenoato de etilo racémico obtenido por el procedimiento (2) (WO01/09079) .
(6) Un procedimiento para producir ácido (S) - (4E) -5-cloro-2-isopropil-4-pentenoico, que comprende la hidrólisis del (4E) -5-cloro-2-isopropil-4-pentenoato de etilo racémico obtenido por el procedimiento (2) , tratamiento del ácido (4E) -5-cloro-2-isopropil-4-pentenoico racémico resultante con cinconidina ópticamente activa para la formación de sal diastereomérica, separación de la sal de (S) -diastereómero por recristalización y tratamiento de la sal (S) diastereomérica con un ácido (Patente internacional 01/09079) .
Los informes de los procedimientos (1) , (3) y (4) , sin embargo, no hablan de la relación E/Z del doble enlace en los 5-cloro-2-isopropil-4-pentenoatos. Además, aunque el procedimiento (2) está dirigido a la obtención de isómeros E de un 5-cloro-2-isopropil-4-pentenoato con rendimientos de 84% y 76%, la reproducción de experimentos allí descritos por los autores de la presente invención no dió el isómero E con el rendimiento indicado, sino un rendimiento de solo aproximadamente 4, 2%. Según esto, ha sido difícil la síntesis selectiva del isómero E de 5-cloro-2-isopropil-4-pentenoatos con altos rendimientos sin isomerización a la forma Z.
Además, debido al empleo de diisopropilamida de litio (LDA) , se requiere que la temperatura de reacción se mantenga termostáticamente a un valor tan extremadamente bajo como -78ºC, y debido a que el LDA se prepara a partir de n.butillitio (n-BuLi) que es caro, el procedimiento (1) es inadecuado para producción industrial en masa por razones económicas y en vista de las dificultades operativas y de un rendimiento tan bajo como 46%. El procedimiento (2) tiene el problema de que el producto se obtiene con un bajo rendimiento de que el producto se obtiene con bajo rendimiento y de que es difícil de purificar porque el isopentanoato de metilo como material de partida sufre reacciones secundarias tales como auto-condensación. El procedimiento (3) tiene el problema de que la esterificación de ácido 5-cloro-2-isopropil-4-pentenoico, que se puede obtener con un rendimiento del 23%, da un 5-cloro-2-isopropil-4-pentenoato en aún menor rendimiento. El procedimiento (4) es económica y operativamente inadecuado para la producción industrial en masa por el empleo de NaH.
El informe sobre el procedimiento (5) no describe suficientemente las condiciones de reacción para producción de un isómero ópticamente activo y mantiene completamente confusa la forma de obtención del deseado compuesto. Los procedimientos (5) y (6) son inadecuados para producción industrial en masa, porque la utilización del procedimiento (2) para producción del racemato que necesita resolución rebaja considerablemente el rendimiento total.
Descripción de la invención
La presente invención se ha completado para resolver los problemas antes mencionados y proporciona un procedimiento para producción de (4E) -5-cloro-2-isopropil-4-pentenoato utilizando reactivos t materiales de partida baratos. Con el procedimiento de la presente invención se puede producir selectivamente la forma E con alto rendimiento a través de reacciones sencillas y es adecuado para producción industrial en masa. La presente invención proporciona también un procedimiento para producir un (S) - (4E) -5-cloro-2-isopropil-4-pentenoato con alto rendimiento y en un alto exceso de enantiómero por resolución óptica del (4E) -5-cloro-2-isopropil-4-pentenoato resultante.
Es decir, la presente invención proporciona los siguientes:
1. Un procedimiento para producir un (4E) -5-cloro-2-isopropil-4-pentenoato representado por la siguiente fórmula (4) (donde R es un grupo alquilo inferior o un grupo aralquilo) , que comprende la reacción de un compuesto representado por la siguiente fórmula (2) en la presencia de un disolvente aprótico (II) con una base (II) y luego con (1E) -1, 3-dicloro-1-propeno para dar un compuesto representado por la siguiente fórmula (3) , y desalcoxicarbonilación de uno u otro grupo éster del compuesto representado por la siguiente fórmula (3) :
2. El procedimiento según 1, donde la base (II) es un alcóxido metálico representado por la fórmula M2OR2 (donde M2 es Na o K, y R2 es un grupo alquilo inferior) .
3. El procedimiento según 2, donde el compuesto representado por la fórmula (2) se hace reaccionar con el alcóxido metálico representado por la fórmula M2OR2 (donde M2 y R2 son tales como se han definido antes) como la base (II) en presencia del disolvente aprótico (II) , y después se separa un alcohol representado por la fórmula R2OH producido como sub-producto antes de la reacción con (1E) -1, 3-dicloro-1-propeno.
4. El procedimiento según cualquiera de los apartados 1 a 3, donde el disolvente aprótico (II) consiste en al menos un disolvente seleccionado del grupo formado por tolueno, xileno, benceno, heptano, dimetilformamida, dimetilacetamida, N-metilpirrolidinona, dimetilsulfóxido, éter dimetílico de dietilen glicol, tetrahidrofurano, éter t-butil metílico y sulfolano.
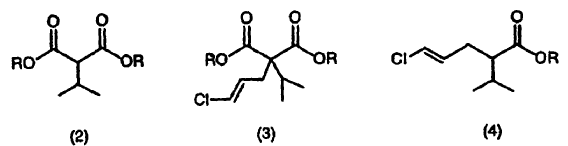
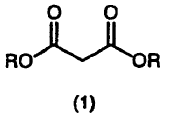
5. El procedimiento según cualquiera de los apartados 1 a 4, donde el compuesto representado por la fórmula (2) es un compuesto obtenido por reacción de un compuesto representado por la siguiente fórmula (1) con una base (I) y luego con un haluro de isopropilo en un disolvente aprótico (I) (donde R es tal como se ha definido antes) :
6. El procedimiento según 5, donde la base (I) es un alcóxido metálico representado por fórmula M1OR1 (donde M1 es Na o K, y R1 es un grupo alquilo inferior) .
7. El procedimiento según 6, donde el compuesto representado por la fórmula (1) se hace reaccionar con el alcóxido metálico representado por la fórmula con el alcóxido metálico representado por la fórmula M1OR1 (donde M1 y R1 son tales como se han definido antes) en la presencia del disolvente aprótico (I) , y se separa entonces un alcohol representado por la fórmula R1OH producido como sub-producto...
Reivindicaciones:
1. Un procedimiento de producción de un (4E) -5-cloro-2-isopropil-4-pentenoato representado por la siguiente fórmula (4) (donde R es grupo alquilo de C1-4 o un grupo aralquilo, que comprende la reacción de un compuesto representado por la siguiente fórmula (2) en la presencia de un disolvente aprótico (II) con una base (II) y luego con (1E) -1, 3-dicloro-1-propeno para dar un compuesto representado por la siguiente fórmula (3) , y desalcoxicarbonilación de uno u otro grupo éster del compuesto representado por la siguiente fórmula (3) :
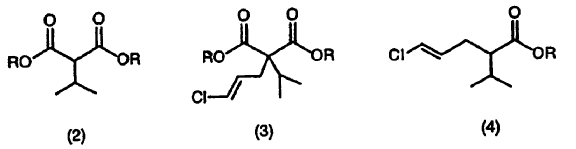
2. El procedimiento según la reivindicación 1, donde la base (II) es un alcóxido metálico representado por la fórmula M2OR2 (donde M2 es Na o K, y R2 es grupo alquilo de C1-4) .
3. El procedimiento según la reivindicación 2, donde el compuesto representado por la fórmula (2) se hace reaccionar con el alcóxido metálico representado por la fórmula M2OR2 (donde M2 y R2 son tales como se han definido antes) como la base (II) . en presencia del disolvente aprótico (II) , y se separa entonces un alcohol representado por la fórmula R2OH producido como subproducto antes de la reacción con (1E) -1, 3-dicloro-1-propeno.
4. El procedimiento según cualquiera de las reivindicaciones 1 a 3 donde el disolvente aprótico (II) consiste en al menos un disolvente seleccionado del grupo formado por tolueno, xileno, benceno, heptano, dimetilformamida, dimetilacetamida, N-metilpirrolidinona, sulfóxido de dimetilo, éter dimetílico de dietilen glicol, tetrahidrofurano, éter t-butil metílico y sulfolano.
5. El procedimiento según cualquiera de las reivindicaciones 1 a 4 donde el compuesto representado por la fórmula (2) es un compuesto obtenido por reacción de un compuesto representado por la siguiente fórmula (1) con una base (I) y luego con un haluro de isopropilo en un disolvente aprótico (I) (donde R es tal como se ha definido antes)
6. El procedimiento según la reivindicación 5, donde la base (I) es un alcóxido metálico representado por la fórmula M1OR1 (donde M1 es Na o K, y R1 es grupo alquilo de C1-4) .
7. El procedimiento según la reivindicación 6, donde el compuesto representado por la fórmula (I) se hace reaccionar con el alcóxido metálico representado por la fórmula M1OR1 (donde M1 y R1 son tales como se han definido antes) en la presencia del disolvente aprótico (I) , y luego se separa un alcohol representado por la fórmula R1OH producido como subproducto antes de la reacción con el haluro de isopropilo.
8. El procedimiento según cualquiera de las reivindicaciones 5 a 7, donde el compuesto representado por la fórmula (1) se hace reaccionar con al menos 1 equivalente molar del haluro de isopropilo y se separa entonces el haluro de isopropilo hasta que la cantidad de haluro d isopropilo alcanza 5% en moles o por debajo, basado en el compuesto resultante representado por la fórmula (2) .
9. El procedimiento según cualquiera de las reivindicaciones 5 a 8, donde el disolvente aprótico (I) consiste en al menos un disolvente seleccionado del grupo formado por tolueno, xileno, benceno, heptano, dimetilformamida, dimetilacetamida, N-metilpirrolidinona, dimetil sulfóxido, éter dimetílico de dietilen glicol, tetrahidrofurano, éter t-butil metílico y sulfolano.
10. El procedimiento según cualquiera de las reivindicaciones 1 a 9, donde la desalcoxicarbonilación se lleva a cabo en un disolvente polar en la presencia de agua y una sal inorgánica.
11. El procedimiento según cualquiera de las reivindicaciones 5 a 10, donde después de obtenerse el compuesto representado por la fórmula (2) , se lleva a cabo la reacción que da el compuesto representado por la fórmula (3) en el mismo recipiente.
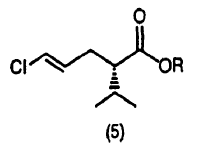
12. Un procedimiento para la producción de un (S) - (4E) -5-cloro-2-isopropil-4-pentenoato representado por la siguiente fórmula (5) (donde R es igual a cómo se ha definido antes) , que comprende la resolución óptica de un (4E) -5-cloro-2-isopropil-4-pentenoato representado por la fórmula (4) obtenido por el procedimiento que se define en cualquiera de las reivindicaciones 1 a 11
Patentes similares o relacionadas:
 Proceso de recuperación de productos químicos líquidos en un aparato de producción de productos químicos, del 13 de Enero de 2016, de MITSUBISHI CHEMICAL CORPORATION: Un proceso, llevado a cabo en un sistema cerrado, para la recuperación de productos químicos líquidos en una instalación para la producción de productos químicos que incluye […]
Proceso de recuperación de productos químicos líquidos en un aparato de producción de productos químicos, del 13 de Enero de 2016, de MITSUBISHI CHEMICAL CORPORATION: Un proceso, llevado a cabo en un sistema cerrado, para la recuperación de productos químicos líquidos en una instalación para la producción de productos químicos que incluye […]
Procedimiento para la preparación de ésteres del ácido benzoico, del 17 de Mayo de 2012, de EVONIK OXENO GMBH: Procedimiento para la preparación de ésteres del ácido benzoico, cuyos grupos alcoxi tienen 9 ó 13 átomos de carbono, mediante reacción del ácido benzoico […]
PURIFICACION DE GLICERIDOS DE ACIDOS GRASOS POLIINSATURADOS, del 16 de Marzo de 2003, de NORSK HYDRO ASA: Se purifica una composición que contiene glicéridos de ácidos grasos poliinsaturados mediante un fraccionamiento por fluido supercrítico en una o más columnas que operan […]
DERIVADOS DE TAXANO, SU PREPARACION Y USO EN ONCOLOGIA, del 16 de Julio de 1996, de INDENA S.P.A.: PREPARACION DE NUEVOS 3,11 GENERAL 1. EL CICLOTAXANO 1A (1, R'= R''= H) PUEDE AISLARSE DE PLANTAS DEL GENERO TAXUS. LOS NUEVOS CICLOTAXANOS 1 TIENEN ACTIVIDAD ANTIBLASTICA.
PROCEDIMIENTO PARA PRODUCIR MONOGLICERIDOS Y DIGLICERIDOS POROS DE UNA MEZCLA QUE CONTIENE MONO, DI Y TRIGLICERIDOS, del 1 de Junio de 1993, de PETER, SIEGFRIED, PROF. DR.: SE DESCRIBE UN PROCEDIMIENTO PARA LA OBTENCION DE MONOGLICERIDOS Y DIGLICERIDOS DE UNA MEZCLA QUE CONTIENE MONO, DI Y TRIGLICERIDOS MEDIANTE EXTRACCION CON UN MEDIO SUPERCRITICO […]
PROCESO DE SEPARACION DE ACIDO FLUORHIDRICO DE ACIDO ISOBUTIRICO O DE SUS ESTERES ALQUILICOS., del 1 de Diciembre de 1992, de ROHM GMBH: LA PATENTE AFECTA A UN PROCESO DE SEPARACION DE LA FLUORAMINA CONTENIDA EN ACIDO ISOBUTIRICO O EN SUS ESTERES, EN CANTIDADES DE UNAS 5 PPM […]
PROCEDIMIENTO PARA RECUPERACION DE PIRIDINA O METILPIRIDINA O SUS MEZCLAS DE REACCION CONTENIENDO ESTER METILICO DEL ACIDO BUTANODICARBOXILICO., del 16 de Mayo de 1992, de BASF AKTIENGESELLSCHAFT: PROCEDIMIENTO PARA RECUPERACION DE PIRIDINA O METILPIRIDINA O SUS MEZCLAS DE MEZCLAS DE REACCION QUE CONTIENEN ESTER METILICO DEL ACIDO BUTANOCARBOXILICO, QUE POR DESCOMPOSICION […]
MÉTODO PARA PREPARAR UNA CORRIENTE DE FENOL SUSTITUIDO CON ÉSTER PURIFICADO, del 20 de Octubre de 2011, de SABIC INNOVATIVE PLASTICS IP B.V.: Un método para producir una corriente de fenol sustituido con éster purificado a partir de una corriente de subproductos de una reacción de transesterificación en estado […]