Procedimiento de producción de un concentrado coagulable de factores de crecimiento de plaquetas.
Un procedimiento de preparación de un concentrado de factores de crecimiento de plaquetas viralmente inactivado coagulable que contiene tanto fibrinógeno como factor XIII,
que comprende las siguientes etapas:
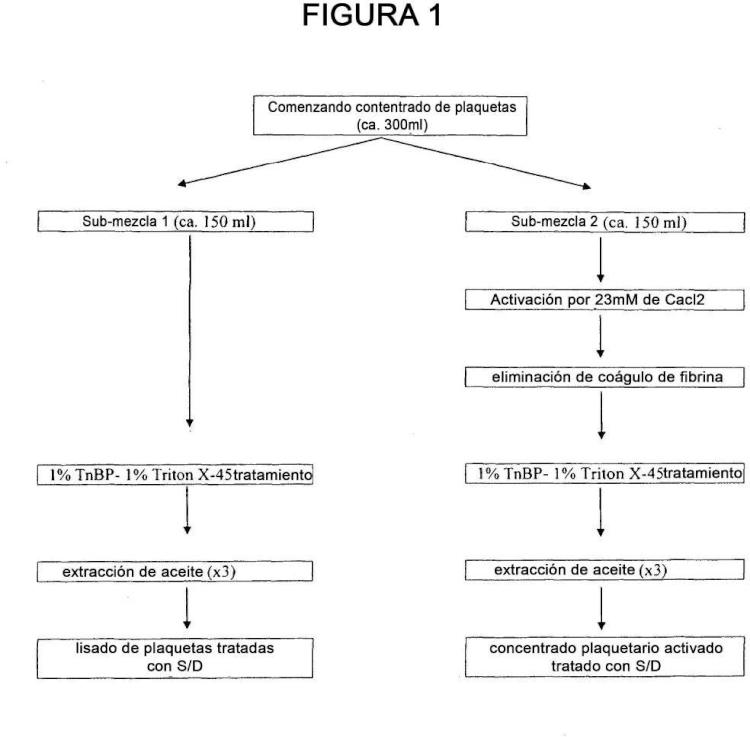
a) poner en contacto un concentrado de plaquetas de partida no activado con un disolvente y/o un detergente, en el que dicho disolvente está seleccionado preferentemente del grupo que consiste en fosfatos de di- o trialquilo, fosfatos de di- o trialquilo con diferentes cadenas de alquilo, y es preferentemente el fosfato de tri-nbutilo (TnBP), en el que dicho detergente está seleccionado preferentemente del grupo que consiste en derivados de polioxietileno de ácidos grasos, ésteres parciales de anhídridos de sorbitol, detergentes no iónicos, desoxicolato sódico y sulfobetaínas, y es más preferentemente Triton® x-45, Triton® X-100 o Tween® 80, y en el que la concentración final de cada uno de dicho disolvente y/o de dicho detergente oscila preferentemente del 0,2 al 5 % en volumen con respecto al volumen del concentrado de plaquetas de partida;
b) incubar dicho concentrado de plaquetas de partida con el disolvente y/o detergente durante un periodo de al menos 5 minutos a 6 horas, a un pH mantenido en un intervalo de aproximadamente 6,0 a aproximadamente 9,0, y a una temperatura dentro del intervalo de 2 ºC a 50 ºC, y
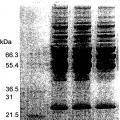
c) eliminar el disolvente y/o el detergente por extracción con aceite y/o medios cromatográficos, en el que la extracción con aceite se realiza preferentemente con un aceite de calidad farmacéutica, estando el aceite usado en una cantidad del 2 al 20 % en peso, o del 5 al 15 % en peso o del 5 al 10 % en peso, basado en el peso de la mezcla del concentrado de plaquetas con el disolvente y/o el detergente, y en el que los medios cromatográficos comprenden preferentemente una columna hidrófoba (fase inversa), preferentemente un material de empaquetamiento de sílice C18 o una SDR (eliminación de disolvente-detergente) Hyper D, o una columna cromatográfica de adsorción tal como una columna cromatográfica aniónica y/o catiónica; comprendiendo dicho procedimiento otra etapa de inactivar virus no envueltos por nanofiltración.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IB2009/000013.
Solicitante: Zheng Yang Biomedical Technology Co. Ltd.
Nacionalidad solicitante: Taiwan, Provincia de China.
Dirección: 1F, Nº 86, Sec. 1, Zhongcheng Road, Shilin District Taipei City 111 TAIWAN.
Inventor/es: BURNOUF, THIERRY, SU,CHENG-YOA.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/18 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Factores de crecimiento; Reguladores de crecimiento.
- A61K38/36 A61K 38/00 […] › Factores de coagulación sanguínea o de fibrinolisis.
- A61P17/02 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 17/00 Medicamentos para el tratamiento de problemas dermatológicos. › para tratar heridas, úlceras, quemaduras, cicatrices, queloides o similares.
- C07K1/14 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 1/00 Procedimientos generales de preparación de péptidos. › Extracción; Separación; Purificación.
PDF original: ES-2513391_T3.pdf


Fragmento de la descripción:
CAMPO DE LA INVENCIÓN
La presente Invención se refiere al campo de los derivados de plaquetas y más específicamente al campo de los concentrados de factores de crecimiento que se obtienen a partir de plaquetas. La presente invención también se refiere a procedimientos de preparación de tales concentrados de factores de crecimiento.
ANTECEDENTES
Se han estudiado mecanismos y rutas que gobiernan la cicatrización de tejido y regeneración de tejido en gran detalle, que muestran en particular que los acontecimientos celulares y moleculares resultantes después de una lesión traumática son principalmente compartidos por los diferentes tejidos del cuerpo. Así, un mecanismo común incluye fases de inflamación tempranas y tardías, proliferación y migración de célula, angiogénesis, formación de tejido por granulación y finalmente formación y remodelación de matriz.
De forma interesante, esta cascada de acontecimientos se inicia inmediatamente después de la lesión por la formación de un coágulo de sangre caracterizado por fibrina reticulada y mediante una variedad de proteínas tales como vitronectina, fibronectina y trombospondina, que previene adicionalmente la hemorragia, y sirve de matriz para invadir células mientras que proporcionan al mismo tiempo una barrera contra patógenos invasores. Además, este coágulo de partida actúa de depósito de derivados de células que se requieren durante las etapas tardías del proceso de curación.
Se supone en particular que todas las fases del proceso de reparación de tejido están mediadas y controladas por una amplia variedad de factores, citocinas y proteínas que modulan la función celular mediante interacciones físicas directas con dominio extracelular de receptores transmembrana. Los últimos transducen señales secundarias, controlando así diversos aspectos de la biología subcelular. Aunque la función de todos los componentes que participan en la regeneración de tejido se esclarece solo parcialmente, se han demostrado los posibles beneficios de muchos de ellos, especialmente para derivados de plaquetas, y más particularmente para factores de crecimiento derivados de plaquetas. Los factores de crecimiento derivados de plaquetas son particularmente conocidos por presentar propiedades quimiotácticas y mitogénicas y parecen participar directamente en la curación y regeneración de tejido blando y duro tal como quimiotaxia, proliferación celular, angiogénesis, deposición de matriz extracelular y remodelación y en la potenciación de la proliferación celular. Además, los derivados de plaquetas también participan indirectamente en funciones biológicas estrechamente relacionadas tales como la estimulación de la producción de quimiocinas y citocinas por células inocentes tales como fibroblastos, macrófagos, células endoteliales o linfocitos.
Por tanto, las preparaciones enriquecidas en plaquetas, además de geles, pegamentos y concentrados de plaquetas, se usan cada vez más solas o en combinación con biomateriales de injerto, como fuente de derivados de plaquetas o factores de crecimiento de plaquetas para diversas aplicaciones clínicas o terapéuticas.
Se ha encontrado que tales preparaciones que contienen o derivadas de plaquetas son particularmente beneficiosas para tratar defectos de huesos largos, craneoplastias complejas y heridas crónicas, por ejemplo, en cirugía oral y maxilofacial, ortopédica, periodóntica y plástica, además de en el tratamiento de úlceras crónicas, regeneración de hueso y tejido blando en odontología e ¡mplantología oral, y en el tratamiento de afecciones musculoesqueléticas.
Además, se mostró que los concentrados de plaquetas eran de particular interés para la expansión ex vivo y diferenciación de citoblastos mesenquimatosos, además de para acelerar la proliferación de condrocitos, células endoteliales y fibroblastos, soportando así perspectivas de expansión de beneficios terapéuticos parala regeneración y cicatrización de cartílago.
Las preparaciones tópicas derivadas de plaquetas, tales como geles, pegamentos y concentrados, se preparan normalmente mezclando concentrados de plaquetas con un activador que puede inducir la liberación del contenido de los gránulos de plaquetas e imitar la activación fisiológica de plaquetas. La etapa de activación se realiza generalmente por la adición directa de trombina exógena o mediante el uso de cloruro de calcio (CaCh), que contrarrestan los efectos del anticoagulante añadido durante la recogida de sangre o plaquetas, y desencadenan la cascada de coagulación y la liberación de trombina endógena. La trombina endógena y exógena también inducen la polimerización de fibrinógeno y la formación de un biomaterial basado en fibrina (un coágulo), conduciendo así a la posterior liberación de una mezcla polifacética de componentes atrapados en plaquetas, que comprenden, por ejemplo, diversos factores de crecimiento de plaquetas.
Más recientemente se desarrollaron nuevos enfoques que consisten en la producción de factores de crecimiento de plaquetas recombinantes en sistemas de expresión convencionales, tales como Regranex (PDGF-bb humano) (Janssen Cilag Internat.). Sin embargo, el número de factores de crecimiento recombinantes disponibles sigue siendo extremadamente limitado, que es en parte debido a la dificultad para aislar, identificar, clonar y expresar
estos factores de crecimiento. Además, la preparación derivada de plaquetas todavía proporciona un beneficio complementario con respecto al uso de factores recombinantes individuales, ya que puede observarse un efecto sinérgico de la combinación de factores de crecimiento.
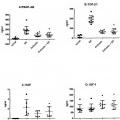
Uno de los principales inconvenientes de las preparaciones que contienen plaquetas o derivadas de plaquetas existentes pertenece a la falta de normalización y definición adecuada de tales preparaciones, que ha conducido a variabilidad en las características de productos enriquecidos en plaquetas con efectos terapéuticos variables. De hecho, la simple suposición de que la concentración de plaquetas predice el nivel de factores de crecimiento en derivados de plaquetas no es evidente, ya que las características técnicas de los procedimientos usados para recoger y/o para activar plaquetas afectan el contenido délos factores de crecimiento y los efectos clínicos resultantes. La heterogeneidad de los productos resultantes podría depender, por ejemplo, de parámetros tan diferentes como la concentración de plaquetas, presencia de glóbulos sanguíneos blancos en el material de partida, tipo, edad y condiciones de almacenamiento del material de partida y medios de activación. Así, es bastante obvio que estas variables conducen a importantes diferencias entre productos y, a su vez, a distintas propiedades biológicas y eficacia clínica tal como la capacidad de curación.
Por ejemplo, cuando dlsoluciones/geles que contienen plaquetas Intactas se cargan directamente sobre el sitio de la herida, la activación de plaquetas se asocia a una rápida formación de un coágulo de fibrina, pero, también, a una lisis Incompleta de las plaquetas. Así, una cantidad variable de plaquetas intactas sigue atrapada dentro del coágulo de fibrina, dificultando así determinar la cantidad real de factores de crecimiento liberados.
Además, cuando se obtienen geles de plaquetas y/o preparaciones de factores de crecimiento por un proceso de activación de tromblna que produce la activación de plaquetas, estos derivados de plaquetas se agotan completamente en flbrlnógeno y ya no son coagulables, requiriendo así mezclarse con productos naturales o sintéticos exógenos antes de aplicarse sobre el sitio de la herida.
Además, la mayoría de los derivados de plaquetas tópicos terapéuticos se preparan a partir de fuentes autólogas. Esto significa que los concentrados de plaquetas autólogos se preparan para aplicaciones de diagnóstico de inmediato de sangre donada por el paciente algunas horas o algunos días antes de la cirugía. Así su uso se reserva ampliamente para cirugías planeadas que requieren un volumen limitado de gel de plaquetas y para pacientes suficientemente sanos para donar sangre. Además, la fabricación de preparaciones autólogas en el sitio quirúrgico tiene la desventaja de llevarse a cabo frecuentemente bajo condiciones escasamente controladas que, por tanto, carecen de la normalización necesaria para garantizar la liberación y eficacia clínica de factores de crecimiento reproduclbles.
Por tanto, también existe una fuerte necesidad de un procedimiento que permita la preparación anticipada de derivados de plaquetas, y más específicamente de concentrados de factores de crecimiento de plaquetas bajo condiciones normalizadas, haciendo así posible formular una preparación... [Seguir leyendo]
Reivindicaciones:
1. Un procedimiento de preparación de un concentrado de factores de crecimiento de plaquetas viralmente inactivado coagulable que contiene tanto fibrinógeno como factor XIII, que comprende las siguientes etapas:
a) poner en contacto un concentrado de plaquetas de partida no activado con un disolvente y/o un detergente, en el que dicho disolvente está seleccionado preferentemente del grupo que consiste en fosfatos de di- o trialquilo, fosfatos de di- o trlalqullo con diferentes cadenas de alquilo, y es preferentemente el fosfato de tri-n- butllo (TnBP), en el que dicho detergente está seleccionado preferentemente del grupo que consiste en derivados de polioxietileno de ácidos grasos, ásteres parciales de anhídridos de sorbitol, detergentes no iónicos, desoxicolato sódico y sulfobetaínas, y es más preferentemente Tritón® x-45, Tritón® X-1 o Tween® 8, y en el que la concentración final de cada uno de dicho disolvente y/o de dicho detergente oscila preferentemente del ,2 al 5 % en volumen con respecto al volumen del concentrado de plaquetas de partida;
b) incubar dicho concentrado de plaquetas de partida con el disolvente y/o detergente durante un periodo de al menos 5 minutos a 6 horas, a un pH mantenido en un intervalo de aproximadamente 6, a aproximadamente 9,, y a una temperatura dentro del intervalo de 2 °C a 5 °C, y
c) eliminar el disolvente y/o el detergente por extracción con aceite y/o medios cromatográficos, en el que la extracción con aceite se realiza preferentemente con un aceite de calidad farmacéutica, estando el aceite usado en una cantidad del 2 al 2 % en peso, o del 5 al 15 % en peso o del 5 al 1 % en peso, basado en el peso de la mezcla del concentrado de plaquetas con el disolvente y/o el detergente, y en el que los medios cromatográficos comprenden preferentemente una columna hidrófoba (fase inversa), preferentemente un material de empaquetamiento de sílice C18 o una SDR (eliminación de disolvente-detergente) Hyper D, o una columna cromatográflca de adsorción tal como una columna cromatográfica aniónica y/o catiónica; comprendiendo dicho procedimiento otra etapa de inactivar virus no envueltos por nanofiltración.
2. El procedimiento según la reivindicación 1, en el que el concentrado de plaquetas de partida se pone en contacto tanto con 2 % de TnBP solo como con 1 % de TnBP y 1 % de Tritón X-45, basado en el volumen del concentrado de plaquetas de partida.
3. El procedimiento según una cualquiera de las reivindicaciones 1 a 2, que comprende además otra etapa (c1) en el que la etapa (c1) comprende al menos una separación por cromatografía aniónica y/o catiónica, en el que dicha cromatografía catiónica es preferentemente una cromatografía catiónica fuerte y/o la cromatografía aniónica es preferentemente una cromatografía amónica débil.
4. El procedimiento según una cualquiera de las reivindicaciones 1 a 3, en el que la etapa (c) comprende al menos una extracción con aceite, seguido de una cromatografía sobre intercambiador catiónico fuerte, y una cromatografía sobre intercambiador amónico débil, siendo preferentemente dicho intercambiador catiónico fuerte SP-Sepharose y siendo preferentemente dicho intercambiador aniónico débil DEAE-Sepharose.
5. El procedimiento según una cualquiera de las reivindicaciones 1 a 4, que comprende otra etapa d) de concentración por ultrafiltración preferentemente sobre membranas con un valor de corte de 5 Dalton o menos.
6. El procedimiento según una cualquiera de las reivindicaciones 1 a 5, en el que la etapa adicional de inactivar virus no envueltos se realiza por nanofiltración usando una membrana de filtración de 1 a 75 nm de tamaño de poro.
7. El procedimiento según una cualquiera de las reivindicaciones 1 a 6 que comprende además una etapa preliminar que consiste en preparar un concentrado de plaquetas de partida antes de dicha etapa a), en el que el concentrado de plaquetas de partida se prepara por aféresis o por aislamiento de capa leucocitaria de sangre completa, y en el que dicho concentrado de plaquetas de partida es fresco, caducado o caducado y congelado.
8. El procedimiento según una cualquiera de las reivindicaciones 1 a 7 que comprende otra etapa e) de eliminar fibrinógeno de la mezcla de factores de crecimiento, preferentemente añadiendo CaCh o trombina.
9. El procedimiento según cualquiera de las reivindicaciones 1 a 8 para la preparación de un concentrado de factores de crecimiento de plaquetas viralmente inactivado coagulable adecuado para uso terapéutico y/o cosmético.
Patentes similares o relacionadas:
Neuregulina para tratar la insuficiencia cardíaca, del 29 de Julio de 2020, de Zensun (Shanghai) Science & Technology, Co., Ltd: Neuregulina para usar en un método para tratar la insuficiencia cardíaca crónica en un paciente, donde el paciente tiene un nivel plasmático de NT-proBNP […]
Dispositivo médico que tiene un revestimiento que comprende ACCS, del 15 de Julio de 2020, de Noveome Biotherapeutics, Inc: Un dispositivo médico implantable que tiene un revestimiento en su superficie, útil para la implantación quirúrgica en el cuerpo de un sujeto, […]
Composiciones que comprenden cócteles de fagos antibacterianos y usos de las mismas para el tratamiento de infecciones bacterianas, del 24 de Junio de 2020, de Tecnifar-Indústria Técnica Farmacêutica, S.A: Una composicion que comprende: una primera y una segunda cepa purificada de bacteriofago, cada una de dichas cepas que tiene un genoma que comprende […]
Trampas de GDF, del 3 de Junio de 2020, de ACCELERON PHARMA, INC: Un polipéptido aislado que comprende la secuencia de aminoácidos de SEQ ID NO: 28.
Combinacion de peptidos tolerogenos con TFG-â para inducir y mantener la tolerancia oral en mamiferos jovenes, del 3 de Junio de 2020, de SOCIETE DES PRODUITS NESTLE S.A.: Una composición nutricional - que contiene al menos un péptido de cinco hasta doce aminoácidos de longitud e incluye una secuencia elegida entre […]
Formulaciones con oxidación reducida, del 3 de Junio de 2020, de F. HOFFMANN-LA ROCHE AG: Una formulación líquida que comprende un anticuerpo y un compuesto que previene la oxidación del anticuerpo en la formulación líquida, en la que el compuesto es […]
Modulación de la actividad del factor de crecimiento epidérmico de unión a heparina para la curación de la membrana timpánica, del 6 de Mayo de 2020, de THE BOARD OF TRUSTEES OF THE LELAND STANFORD JUNIOR UNIVERSITY: Un agente que proporciona actividad de factor de crecimiento epidérmico de unión a heparina (HB-EGF) para su uso en el tratamiento de una perforación crónica de la membrana […]
Composiciones para lograr niveles plasmáticos deseados del factor 2 de crecimiento glial, del 6 de Mayo de 2020, de ACORDA THERAPEUTICS, INC: Factor de crecimiento glial 2 (GGF2) para su uso en la promocion de la remielinizacion celular en un paciente, donde el GGF2 se administra al paciente en una cantidad de […]