Procedimiento para la produccíón de colágeno humano de tipo II.
Un método de producción de una proteina que tiene una estructura de triple helice,
en el que el método comprende:
(a) introducir ADN que codifica una proteina que tiene una estructura de triple helice en el vector pNOW/CMV-AA, en el que el ADN se selecciona de:
(i) un ADN que comprende la secuencia de nucleetidos de SEQ ID NO: 7; y
(ii) un ADN que se hibrida en condiciones rigurosas con un ADN que comprende la secuencia de nucleetidos de SEQ ID NO: 7;
(b) transformar una celula CHO por transferencia del vector genico; y
(c) cultivar o reproducir el transformante, y recoger la proteina que tiene una estructura de triple helice
de la celula o del sobrenadante del cultivo de la misma,
en el que la proteina que tiene una estructura de triple helice es colageno humano de tipo II o un peptido parcial del mismo.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E11002048.
Solicitante: FUSO PHARMACEUTICAL INDUSTRIES LTD..
Nacionalidad solicitante: Japón.
Dirección: 7-10, Doshomachi 1-chome, Chuo-ku Osaka-shi Osaka 541-0045 JAPON.
Inventor/es: KIMURA, AKIO, KESHI,HIROYUKI, KASE,Tetsuo, KISAKI,Hiroshi, UEYAMA,Hiroshi, NISHIHARA,Mizuki.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07K14/78 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Péptidos del tejido conectivo, p. ej. colágeno, elastina, laminina, fibronectina, vitronectina, globulina insoluble en frío (CIG).
- C12N15/09 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Tecnología del ADN recombinante.
- C12N5/10 C12N […] › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células modificadas por introducción de material genético extraño, p. ej. células transformadas por virus.
- C12P21/02 C12 […] › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › C12P 21/00 Preparación de péptidos o de proteínas (proteína monocelular C12N 1/00). › que tienen una secuencia conocida de varios aminoácidos, p. ej. glutation.
PDF original: ES-2489715_T3.pdf

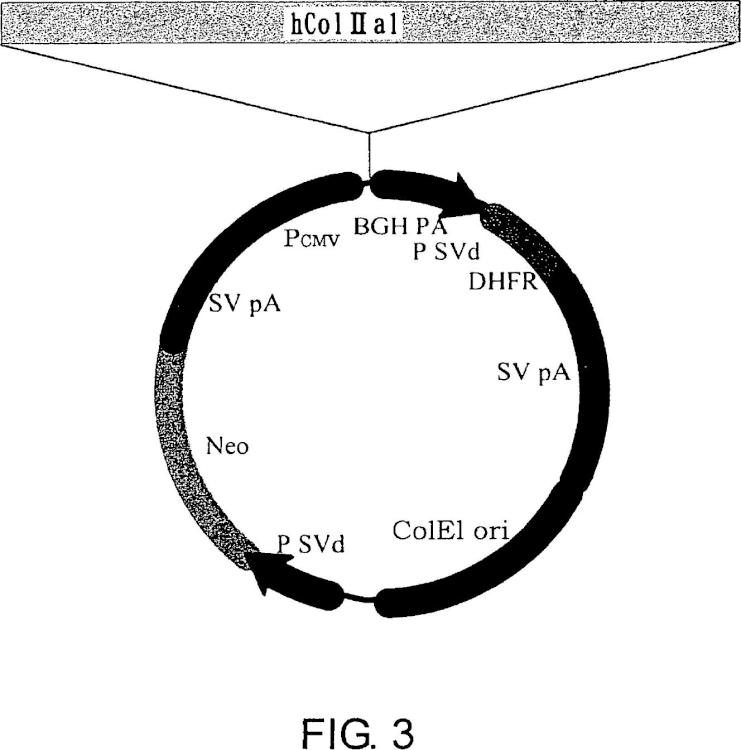
Fragmento de la descripción:
Procedimiento para la producción de colágeno humano de tipo II Campo técnico
La presente invención se refiere a procedimientos de producción de proteínas que tienen estructura de triple hélice. 5 Más específicamente, la presente invención se refiere a procedimientos de producción de colágeno humano o péptidos parciales de colágeno humano. Un objeto de la presente invención es proporcionar colágeno humano y péptidos parciales de colágeno humano que son seguros para el cuerpo vivo y que se pueden purificar y obtener fácilmente, y procedimientos de producción de los mismos. Más específicamente, la presente invención proporciona procedimientos de producción de colágeno humano y péptidos parciales del mismo, transduciendo de forma estable 10 células de ovario de hámster chino (CHO) con un vector de expresión de mamífero dentro del que se ha insertado ADNc de colágeno humano.
Técnica anterior
Ei colágeno es una proteína que se distribuye en casi todos ios tejidos del cuerpo incluyendo la piel, el hueso y el cartílago, y es muy conocido por desempeñar funciones importantes, tales como el mantenimiento de estructuras de 15 tejidos y órganos, proporcionando armazones para las células. Mientras tanto, el colágeno es un material bioabsorbible que se descompone por las colagenasas secretadas a partir de los fibroblastos y por las colagenasas presentes en los fagocitos. Se considera que el colágeno es útil como biomaterial debido a que es un material biocompatible y bioabsorbible, como se describió anteriormente. Hasta ahora, el colágeno se ha usado como un biomaterial para cubrir piel herida y se ha notificado que mejora la cicatrización (documentos distintos de patente 1 y 20 2).
En la piel hay un cuarenta por ciento de colágeno total, y un 70% o más del peso seco de la piel y del tendón es colágeno; por tanto, el colágeno es importante para desarrollar piel artificial. Se aplica como material útil para técnicas de cultivo de células y órganos, que ofrece una gran expectativa en sus aplicaciones en el campo en pleno auge de la medicina regenerativa. También se ha señalado que el colágeno (colágeno de tipo II) se puede usar para 25 suprimir el reumatismo articular por ingestión oral (documentos distintos de patente 3 y 4). Como material de fuente para este colágeno, se han usado principalmente los derivados de tejidos de animales no humanos grandes, tales como cerdos y vacas.
[Documento distinto de patente 1] Surg. Forum, 10, 303 (1960)
[Documento distinto de patente 2] J. Surg. Res., 10, 485-491 (1970)
[Documento distinto de patente 3] Lancet, 342, 799 (1993)
[Documento distinto de patente 4] Science, 261, 1727-1730 (1993)
[Documento de patente 1] Publicación kokai de la solicitud de patente japonesa n.° (JP-A) H10-179169 (solicitud de patente japonesa publicada, no examinada)
Divulgación de la invención
[Problemas para ser solucionados por la invención]
Como se describió anteriormente, el colágeno es útil como biomaterial o medicamento para terapia regenerativa y trasplante de órganos vivos, pero el colágeno usado hasta el momento se deriva de tejidos de animales no humanos grandes, tales como cerdos y vacas. Aunque el colágeno es una proteína con una inmunogenicídad baja por naturaleza, se ha reportado que cuando el colágeno de un animal xenogénico se trasplanta, se implanta o se 40 administra como biomaterial se inducen reacciones inmunitarias a una frecuencia baja (J. Immunol., 136, 877-882 (1986), Biomaterials, 11, 176-180 (1990)). Además, se ha vuelto imposible el uso de colágeno derivado de vaca debido al problema de la contaminación priónica en vacas. Además, no hay garantía de que no se produzcan problemas similares a la contaminación priónica en animales tales como los cerdos que se usan normalmente para la extracción de colágeno. De los aspectos mencionados anteriormente, es preferible el uso de colágeno derivado de 45 ser humano como biomaterial para aplicarse directamente en el cuerpo humano. Sin embargo, la extracción y la purificación de colágeno a partir de tejidos humanos no sólo tiene problemas éticos y técnicos, sino que también es problemático de forma cualitativa porque el colágeno obtenido forma entrecruzamientos inespecíficos y es difícil de purificar.
Para obtener colágeno no inmunogénico que esté libre de riesgo de contaminación por patógenos y que sea fácil de 50 aislar y purificar, se ha estudiado la producción de colágeno usando técnicas de recombinación genética (Biochem. Soc., 28, 350-353 (2000)). Sin embargo, es muy complicado preparar un vector de expresión para introducir en las células huésped, un ADNc que codifique una molécula de colágeno con un peso molecular de más de 100.000. Además, los procedimientos convencionales tienen una productividad baja y están lejos de una aplicación práctica. Además, se sabe que las moléculas de colágeno tienen una estructura de triple hélice en la que están asociados
tres péptidos. Esta estructura se forma como resultado de varias modificaciones en los productos de traducción primarios del gen (N. Engl. J. Med., 311, 376-386 (1984)); sin embargo, se cree que sólo las células específicas tienen esta capacidad de modificación.
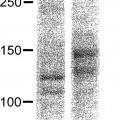
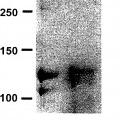
Se han realizado esfuerzos para producir colágeno humano recombinante usando fibroblastos de ratón, células de pulmón de hámster y similares como huésped (Proc. Nati. Acad. Sci. USA., 84, 764-768 (1987), J. Biol. Chem., 264, 20683-20687 (1989)). Aunque el colágeno producido en estos ejemplos tiene una estructura molecular normal, son moléculas de colágeno mezcladas de productos génicos de colágeno tanto de células huésped como humanas. En un ejemplo en el que se expresó colágeno de tipo II (Biochem. J., 298,31-37 (1994)), la cantidad producida fue tan solo de 0,5 a 1 mg por litro de medio de cultivo, y se encontró que el colágeno de tipo II expresado por el ADNc introducido estaba contaminado con una cantidad significativa de colágeno de tipo IV derivado de huésped. Por tanto, fue necesario separar el colágeno de tipo II endógeno del colágeno de tipo II derivado del gen introducido.
Fukui et al. (J. Biol Chem., vol. 277, n.° 3, págs. 2193-2002, 2002) describen el procesamiento de amino-propéptido de procolágeno de tipo II mediante metaloproteinasas de matriz.
Ala-Kokko et al. (J. Biol Chem., vol. 266, n.° 22, págs. 14175-14178, 1991) describen la formación de colágeno humano de tipo II en células NIH 3T3.
Stacey et al. (J. Virol., vol. 61, n.° 8, págs. 2549-2554, 1987) describen la expresión de la cadena pro-a1 de tipo I humana en células Mov-13.
El documento WO 93/07889 se refiere a la síntesis de procolágenos y colágenos humanos en sistemas de ADN recombinante, y describe la síntesis de colágeno humano de tipo I, II y III en diferentes células huésped.
Además de los ejemplos mencionados anteriormente, hay ejemplos de expresión de colágeno humano usando levaduras (publicación kohyo de patente japonesa n.° (JP-A) H7-501939 (publicación de fase nacional japonesa publicada, no examinada, correspondiente a una publicación internacional no japonesa)), células de insecto (publicación kokai de solicitud de patente japonesa n.° (JP-A) H8-23979 (solicitud de patente japonesa publicada, no examinada)), Bacillus brevis (JP-A H11-178574), y Escherichia coli (JP-A 2002-325584), pero las modificaciones posteriores a la expresión de los péptidos del colágeno pueden ser diferentes de las realizadas en células animales. Como se menciona anteriormente, no se ha notificado hasta ahora ningún procedimiento satisfactorio como procedimiento de recombinación genética para producir colágeno humano en términos de cantidad y calidad. Además, aún no se ha producido ninguna investigación sobre los procedimientos para producir grandes cantidades de proteínas con una estructura de triple hélice, tales como el colágeno.
La presente invención se logró en vista de las anteriores circunstancias. Un objeto de la presente invención es proporcionar métodos para producir proteínas con una estructura de triple hélice. Más específicamente, el objeto es proporcionar métodos para producir moléculas de colágeno humano que sean fáciles de aislar y de purificar, y que tengan sustancialmente la misma estructura que las moléculas de colágeno natural, sintetizando grandes cantidades de proteína de colágeno humano en células huésped a las que se les ha introducido un gen de colágeno, en el que la proteína de colágeno se deriva del gen introducido en un vector génico exógeno de expresión alta.
[Medios para resolver los problemas]
Los inventores de la presente invención realizaron diversos estudios... [Seguir leyendo]
Reivindicaciones:
Un método de producción de una proteína que tiene una estructura de triple hélice, en el que el método comprende:
(a) introducir ADN que codifica una proteína que tiene una estructura de triple hélice en el vector pNOW/CMV-AA, en el que el ADN se selecciona de:
(i) un ADN que comprende la secuencia de nucleótidos de SEQ ID NO: 7; y
(ii) un ADN que se híbrida en condiciones rigurosas con un ADN que comprende la secuencia de nucleótidos de SEQ ID NO: 7;
(b) transformar una célula CHO por transferencia del vector génico; y
(c) cultivar o reproducir el transformante, y recoger la proteina que tiene una estructura de triple hélice de la célula o del sobrenadante del cultivo de la misma,
en el que la proteína que tiene una estructura de triple hélice es colágeno humano de tipo II o un péptldo parcial del mismo.
Un vector introducido con al menos un ADN seleccionado de:
(a) un ADN que comprende la secuencia de nucleótidos de SEQ ID NO: 7; y
(b) un ADN que se híbrida en condiciones rigurosas con ADN que comprende la secuencia de nucleótidos de SEQ ID NO: 7.
Una célula CHO que porta el vector de la reivindicación 2.
Un kit para producir una proteína que tiene una estructura de triple hélice, en el que el kit comprende el vector de la reivindicación 2 o la célula CHO de la reivindicación 3, y en el que la proteína que tiene una estructura de triple hélice es colágeno humano de tipo II o un péptido parcial del mismo.
Patentes similares o relacionadas:
Método y medios para purificar vectores retrovíricos, del 29 de Julio de 2020, de Autolus Limited: Una célula productora de retrovirus que expresa una proteína de marcaje en la superficie celular, de tal manera que los vectores retrovíricos producidos por la célula se […]
Biblioteca de péptidos y su uso, del 8 de Julio de 2020, de DAIICHI SANKYO COMPANY, LIMITED: Una biblioteca de péptidos que comprende una pluralidad de péptidos diferentes en la que los péptidos comprenden cada uno una secuencia de aminoácidos […]
Marcador de células endoteliales corneales, del 17 de Junio de 2020, de OSAKA UNIVERSITY: Método para producir una célula endotelial corneal, comprendiendo el método la etapa de clasificar, a partir de una población celular que comprende una célula […]
Vectores de AAV dirigidos a oligodendrocitos, del 10 de Junio de 2020, de THE UNIVERSITY OF NORTH CAROLINA AT CHAPEL HILL: Un ácido nucleico que codifica una cápside de AAV, comprendiendo el ácido nucleico una secuencia codificante de la cápside de AAV que es al menos el 96 % idéntica […]
Anticuerpo contra péptido codificado por exón-21 de periostina y composición farmacéutica para prevenir o tratar enfermedades asociadas a inflamación que contienen el mismo, del 6 de Mayo de 2020, de OSAKA UNIVERSITY: Anticuerpo que se une a uno o más péptidos seleccionados del grupo que consiste en un péptido codificado por el exón-21 de periostina que […]
Reconocimiento de unión a diana celular mediante un agente bioactivo usando transferencia de energía de resonancia de bioluminiscencia intracelular, del 6 de Mayo de 2020, de PROMEGA CORPORATION: Un sistema de ensayo que comprende: (a) una biblioteca de agentes bioactivos, cada uno de los cuales está fijado a un fluoróforo; (b) una diana celular fusionada a […]
Combinación de dos elementos genéticos para el control del desarrollo del tipo floral de una planta dicotiledónea, y utilización en procedimientos de detección y selección, del 1 de Abril de 2020, de Institut national de recherche pour l'agriculture, l'alimentation et l'environnement: Utilización de una combinación de dos elementos genéticos para el control del desarrollo del tipo floral de una planta dicotiledónea, comprendiendo dicha combinación, respectivamente: […]
Producción de proteínas en medios de cultivo celular libres de glutamina, del 25 de Marzo de 2020, de F. HOFFMANN-LA ROCHE AG: Un procedimiento para producir un polipéptido en una célula huésped de mamífero que expresa dicho polipéptido, que comprende cultivar la célula […]