Un procedimiento para la preparación de Nebivolol racémico.
Un procedimiento para preparar racemato de [2S*[R*[R*[R*]]]] y [2R*[S*[S*[S*]]]]-(±)-α
,α'-[iminobis(metilen)]bis[6-fluoro-3,4-dihidro-2H-1-benzopirano-2-metanol] y sales farmacéuticamente aceptables del mismo, comprendiendo el procedimiento:
(a) proporcionar un compuesto de fórmula (IX)
un compuesto de fórmula (IX') que es una forma semicetal cíclica del compuesto de fórmula (IX)
o una mezcla de los mismos, en el cual el compuesto de fórmula (IX) y el compuesto de fórmula (IX') son mezclas de diastereómeros, en las cuales PG es hidrógeno o un grupo protector de 10 amina, en el cual el grupo protector de amina es al menos uno de un grupo alilo o un grupo arilalquilo C1;
(b) separar los diastereómeros del compuesto de fórmula (IX) o del compuesto de fórmula (IX'), obteniendo diastereómeros sustancialmente puros de fórmula (IX) o fórmula (IX') que presentan al menos un 50% de configuración RSS/SRR o RRS/SSR en una etapa de epimerización-cristalización simultánea, en el cual la etapa de epimerización-cristalización comprende:
(1) epimerizar una configuración RSR/SRS del compuesto de fórmula (IX) o (IX'), dando una mezcla de configuración RSS/SRR y configuración RSR/SRS de diastereómeros de fórmula (IX) o fórmula (IX') o
epimerizar una configuración RRR/SSS del compuesto de fórmula (IX) o (IX'), dando una mezcla de configuración RRS/SSR y de configuración RRR/SSS de diastereómeros de fórmula (IX) o fórmula (IX'), a condición de que dicha epimerización se realice en presencia de una base y un disolvente orgánico, en el cual la mezcla se enfría opcionalmente utilizando un gradiente de temperatura y en el cual la configuración RSS/SRR o la configuración RRS/SSR de la mezcla se obtienen en un exceso de al menos dos veces respecto a la configuración RSR/SRS y la configuración RRR/SSS; y
(2) cristalizar diastereómeros sustancialmente puros de fórmula (IX) o fórmula (IX') que presentan la configuración RSS/SRR o la configuración RRS/SSR en un exceso de al menos dos veces respecto a la configuración RSR/SRS y la configuración RRR/SSS;
separar la mezcla mediante cristalización fraccionada opcionalmente después de la formación 30 de sal o después de la derivatización, obteniendo diastereómeros sustancialmente puros de fórmula (IX) o fórmula (IX') que presenten la configuración RSS/SRR o la configuración RRS/SSR.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E06010861.
Solicitante: ACINO PHARMA AG.
Nacionalidad solicitante: Suiza.
Dirección: BIRSWEG 2 4253 LIESBERG (BL) SUIZA.
Inventor/es: STUTZ,ALFRED.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07D311/58 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 311/00 Compuestos heterocíclicos que contienen ciclos de seis miembros que contienen un átomo de oxígeno como único heteroátomo, condensados con otros ciclos. › con sustituyentes diferentes a los átomos de oxígeno o azufre en las posiciones 2 ó 4.
- C07D407/06 C07D […] › C07D 407/00 Compuestos heterocíclicos que contienen dos o más heterociclos, teniendo al menos un ciclo átomos de oxígeno como únicos heteroátomos del ciclo, no previstos por el C07D 405/00. › unidos por una cadena de carbono que contiene solamente átomos de carbono alifático.
- C07D413/14 C07D […] › C07D 413/00 Compuestos heterocíclicos que contienen dos o más heterociclos, teniendo al menos un ciclo átomos de nitrógeno y oxígeno como únicos heteroátomos del ciclo. › que contienen tres o más heterociclos.
PDF original: ES-2391830_T3.pdf
Fragmento de la descripción:
Un procedimiento para la preparacion de nebivolol racemico.
ANTECEDENTES DE LA INVENCION
1. CAMPO DE LA INVENCION
Esta invencion se refiere a un procedimiento novedoso para la preparacion de Nebivolol racemico, a sus compuestos enantiomericos y a compuestos novedosos preparados mediante el procedimiento.
2. DESCRIPCION DE LA TECNICA RELACIONADA
El Nebivolol (veanse la Figura 1A, la cual muestra el d-Nebivolol, nombre quimico: [2R*[R*[R* (S*) ]]]-a, a'[iminobis (metilen) ]bis[6-fluoro-3, 4-dihidro-2H-1-benzopirano-2-metanol] o, alternativamente, [2R*[R*[R* (S*) ]]]-a, a'
[iminobis (metilen) ]bis[6-fluorocromano-2-metanol] y la Figura 18, la cual muestra el Nebivolol racemico, el cual es una mezcla de 1 y d-Nebivolol) es conocido como antagonista º-adrenergico, agente antihipertensivo, inhibidor de la agregacion de plaquetas y agente vasodilatador.
El Nebivolol se administra en forma de comprimidos (por ejemplo, una dosificacion de 5, 45 mg de clorhidrato de Nebivolol es equivalente a 5 mg de Nebivolol) que contienen Nebivolol en forma de una mezcla 15 racemica de los enantiomeros SRRR-Nebivolol (dextro-d-Nebivolol) y RSSS-Nebivolol (levo-l-Nebivolol) .
El Nebivolol contiene cuatro centros asimetricos, y por lo tanto son teoricamente posibles 16 estereoisomeros. Sin embargo, debido a la constitucion particular de las estructuras y configuraciones de los estereoisomeros (por ejemplo, simetria axial) , solo pueden crearse 10 estereoisomeros (6 diastereomeros, 4 formas dl y 2 formas meso) (Tabla 1) .
Se describe en general una preparacion no estereoselectiva de estos estereoisomeros en la patente de EE.UU. n° 4.654.362 de Van Lommen y col. (Janssen Pharmaceutica N. V.) (y su equivalente EP 0145067) . Se ha descrito una sintesis estereoselectiva del isomero [2R, aS, 2'S, a'S]-a, a'-[iminobis (metilen) ]bis[6-fluoro-3, 4-dihidro-2H1-benzopirano-2-metanol] en la patente de EE.UU. n° 6.545.040 (Janssen Pharmaceutica N. V.) (y su equivalente EP 0334429) .
Se ha descrito un procedimiento para separar una mezcla diastereoisomerica consistente en (±) [2R*[1S*, 5S* (S*) ]] + [2R*[1S*[5R* (S*) ]]]-a, a'-[iminobis (metilen) ]bis[6-fluoro-3, 4-dihidro-2H-1-benzopirano-2-metanol] mediante la cristalizacion fraccionada de las correspondientes sales clorhidrato en la patente US 5.759.580 (Janssen Pharmaceutica N. V.) (y su equivalente EP 0744946) . El clorhidrato de Nebivolol podia obtenerse solo con un muy bajo rendimiento del 6, 6%.
La publicacion de solicitud de patente PCT WO 2004/041805 (Egis Gyogyszergyar RT.) describe un nuevo procedimiento para la preparacion de racemato de [2S[2R*[R[R*]]]]- y [2R[2S*[S[S*]]]]- (±) -a, a'[iminobis (metilen) ]bis[6-fluoro-3, 4-dihidro-2H-1-benzopirano-2-metanol] y sus enantiomeros [2S[2R*[R[R*]]]] y [2R[2S*[S[S*]]]] puros.
Se han descrito sintesis alternativas y enantioselectivas de d-Nebivolol en J. Am. Chem. Soc. 1998, 120, 35 8340-8347 y Tetrahedron 56, 2000, 6339-6344.
Tabla 1: Estereoisomeros del Nebivolol
Formula general de los isomeros de Nebivolol R2 = R1 = SRRS Estereoisomero 1 SRRR Estereoisomero 2 d-Nebivolol SRSR Estereoisomero 3 Forma meso 1 SRSS Estereoisomero 4 RRRS Estereoisomero 2 d-Nebivolol RRRR Estereoisomero 5 RRSR Estereoisomero 6 RRSS Estereoisomero 7 Forma meso 2 RSRS Estereoisomero 3 Forma meso 1 RSRR Estereoisomero 6 RSSR Estereoisomero 8 RSSS Estereoisomero 9 l-Nebivolol SSRS Estereoisomero 4 SSRR Estereoisomero 7 Forma meso 2 SSSR Estereoisomero 9 l-Nebivolol SSSS Estereoisomero 10Se resumen a continuacion los procedimientos de preparacion de Nebivolol de las referencias anteriormente mencionadas.
a. Patente de EE.UU. n° 4.654.362 (y su equivalente EP 0145067) (Janssen Pharmaceutica N.V.) .
Se describe la ruta sintetica para la preparacion no estereoselectiva de Nebivolol, partiendo del acido 6fluoro-4-oxo-4H-1-benzopirano-2-carboxilico a1 (Esquema 1a)
Esquema 1a
Para la preparacion de Nebivolol segun el Esquema 1a, la patente de EE.UU. n° 4.654.362 y su equivalente EP 0145067 contienen ejemplos detallados para la sintesis de los componentes a1, a2, a3, a4 y as solo. Todos los demas ejemplos son procedimientos analogos que describen la preparacion de derivados relacionados (por ejemplo, derivados sin el sustituyente fluoro aromatico) . La estrategia general para la preparacion de Nebivolol o sus
correspondientes derivados esta basada en la sintesis de 2-oxiranilcromanos (a6 y a7) como intermedios clave para las etapas de acoplamiento final. Debido a que poseen dos atomos de carbono asimetricos, estos compuestos pueden crearse a partir de los aldehidos racemicos a5 en forma de dos racematos diastereoisomericos ("una forma A" a7 = RS/SR y "una forma 8" a6 = SS/RR) que pueden separarse mediante cromatografia. Esta referencia no proporciona descripciones del procedimiento de procesamiento, cristalizacion ni purificacion o separacion de
estereoisomeros, rendimientos, etc. para los intermedios deseados.
Los racematos a6 o a7 pueden transformarse haciendo reaccionar con bencilamina los correspondientes aminoalcoholes bencilados as y a9. Puede prepararse una mezcla de Nebivolol A8 protegida con bencilo a10 haciendo reaccionar el racemato as (RS/SR) con el racemato epoxidico a6 (RR/SS) o haciendo reaccionar el racemato a9 (RR/SS) con el racemato epoxidico a7 (RS/SR) . El grupo protector puede retirarse en la etapa final
mediante hidrogenacion catalitica, dando la mezcla de Nebivolol A8 a11.
El Esquema 1b muestra procedimientos adicionales para la sintesis de los 2-cromanilaldehidos (a14) y 2ºxiranilcromanos (a16) analogos como intermedios clave para la sintesis de derivados de Nebivolol que tienen sustituyentes diferentes en el resto aromatico.
Esquema 1b
El aldehido a14 puede obtenerse mediante una reduccion a baja temperatura de la imidazolida a12 o mediante la misma reduccion del ester a13. Se convierte entonces el aldehido a14 en 2-oxiranilcromanos a16 mediante reaccion con hidruro de sodio y yoduro de trimetilsulfoxonio en dimetilsulfoxido en una reaccion analoga a la descrita anteriormente. Es otra posibilidad para la sintesis de 2-oxiranilcromanos a16 la oxidacion del 2vinilcromano a15 con 3-clorobencenocarboperoxido (la fuente de 2-vinilcromano a15 no se describe en estas
patentes, pero segun la patente EP 0334429 (vease tambien a continuacion) , el compuesto a14 puede convertirse en el compuesto a15 mediante una reaccion de Wittig) .
El Esquema 1c demuestra que pueden producirse mezclas diastereoisomericas consistentes en diastereomeros deseados e indeseados (por ejemplo RSSS/SRRR y RSRR/SRSS) mediante el procedimiento mostrado en el Esquema 1a.
Esquema 1c
La estrategia descrita en la patente de EE.UU. n° 4.654.362 y su equivalente EP 0145067 tiene las siguientes desventajas:
1. La sintesis de los aldehidos a6 y a14 requiere temperaturas muy bajas y por lo tanto requiere un equipo especial, lo que hace al procedimiento mas complicado y caro.
2. El aldehido a5 es muy inestable tal como se afirma en la publicacion PCTWO 2004/041805.
3. La sintesis de a6/a7 a partir de a5 puede ser peligrosa debido a que es conocido que el uso de hidruro de sodio en disolventes tales como DMSO, DMF, DMA y DMI puede causar exotermia y por lo tanto causar una reaccion incontrolada (vease UK Chemical Reaction Hazards Forum: "Sodium Hydride/DMF process stopped") .
4. Los compuestos a6 y a7 se han caracterizado como sustancias oleosas (vease la publicacion PCT WO 2004/041805) . Puesto que la preparacion segun el procedimiento descrito es probable que forme una mezcla diastereoisomerica de a6 y a7, puede requerirse purificacion cromatografica, lo cual no es comercialmente viable.
5.
Reivindicaciones:
un compuesto de formula (IX') que es una forma semicetal ciclica del compuesto de formula (IX)
10 o una mezcla de los mismos, en el cual el compuesto de formula (IX) y el compuesto de formula (IX') son mezclas de diastereomeros, en las cuales PG es hidrogeno o un grupo protector de amina, en el cual el grupo protector de amina es al menos uno de un grupo alilo o un grupo arilalquilo C1; 15 (b) separar los diastereomeros del compuesto de formula (IX) o del compuesto de formula (IX') , obteniendo diastereomeros sustancialmente puros de formula (IX) o formula (IX') que presentan al menos un 50% de configuracion RSS/SRR o RRS/SSR en una etapa de epimerizacioncristalizacion simultanea, en el cual la etapa de epimerizacion-cristalizacion comprende: (1) epimerizar una configuracion RSR/SRS del compuesto de formula (IX) o (IX') , dando una mezcla de configuracion RSS/SRR y configuracion RSR/SRS de diastereomeros de formula (IX) o formula (IX') o 20 25 epimerizar una configuracion RRR/SSS del compuesto de formula (IX) o (IX') , dando una mezcla de configuracion RRS/SSR y de configuracion RRR/SSS de diastereomeros de formula (IX) o formula (IX') , a condicion de que dicha epimerizacion se realice en presencia de una base y un disolvente organico, en el cual la mezcla se enfria opcionalmente utilizando un gradiente de temperatura y en el cual la configuracion RSS/SRR o la configuracion RRS/SSR de la mezcla se obtienen en un exceso de al menos dos veces respecto a la configuracion RSR/SRS y la configuracion RRR/SSS; y (2) cristalizar diastereomeros sustancialmente puros de formula (IX) o formula (IX') que presentan la configuracion RSS/SRR o la configuracion RRS/SSR en un exceso de al menos dos veces respecto a la configuracion RSR/SRS y la configuracion RRR/SSS; 30 separar la mezcla mediante cristalizacion fraccionada opcionalmente despues de la formacion de sal o despues de la derivatizacion, obteniendo diastereomeros sustancialmente puros de formula (IX) o formula (IX') que presenten la configuracion RSS/SRR o la configuracion RRS/SSR; 35 (c) reducir los diastereomeros sustancialmente puros de formula (IX) o formula (IX') que presentan una configuracion RSS/SRR o RRS/SSR, dando un compuesto de formula (X)en forma de una mezcla diastereomerica RSSS/SRRR que presenta una relacion de configuracion diastereomerica RSSS/SRRR a una configuracion diastereomerica SRSR o RRSS en la cual dicha relacion es de al menos 1;
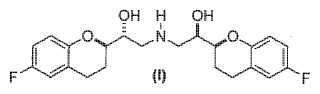
(d) desproteger el compuesto de formula (X) , a condicion de que PG no sea H y, si PG es H, omitir entonces dicha desproteccion, obteniendo un compuesto de formula (I)
o sales farmaceuticamente aceptables del mismo; y
(e) retirar una configuracion diastereomerica RSRS o RRSS del compuesto de formula (I) o sales
farmaceuticamente aceptables del mismo si esta presente mediante recristalizacion o mediante una suspension, dando racemato de [2S*[R*[R*[R*]]]]-y [2R*[S*[S*[S*]]]]- (±) -a, a'[iminobis (metilen) ]bis[6-fluoro-3, 4-dihidro-2H-1-benzopirano-2-metanol] o sales farmaceuticamente aceptables del mismo.
2. El procedimiento segun la reivindicacion 1, en el cual la etapa (b) se lleva a cabo para la configuracion 15 RSR/SRS del compuesto de formula (IX) o (IX') .
3. El procedimiento segun la reivindicacion 2, en el cual la configuracion RSS/SRR de la mezcla se obtiene en un exceso de aproximadamente nueve veces de RSR/SRS.
4. El procedimiento segun la reivindicacion 1, en el cual en la etapa (b) la mezcla se enfria usando un gradiente de temperatura de aproximadamente 70 a aproximadamente 20°C.
5. El procedimiento segun la reivindicacion 4, en el cual el gradiente de temperatura es de 70 a 40°C.
6. El procedimiento segun la reivindicacion 1, en el cual la provision del compuesto de formula (IX)
el compuesto de formula (IX') que es una forma semicetal ciclica del compuesto de formula (IX)
o la mezcla de los mismos, en la cual el compuesto de formula (IX) y el compuesto de formula (IX') son mezclas de diastereomeros, en la etapa (a) comprende:
(i) proporcionar un compuesto de formula (VIII)
en forma de un compuesto diastereoisomericamente puro que comprende al menos un 95% de configuracion RS/SR o configuracion RR/SS, en el cual PG es hidrogeno o un grupo protector de amina, en el cual el grupo protector de amina es al menos uno de un grupo alilo o un grupo arilalquilo C1;
(ii) proporcionar un compuesto racemico de formula (V)
en el cual LG es un miembro seleccionado del grupo consistente en cloro, bromo, yodo, 10 alquilsulfoniloxilo y arilsulfoniloxilo;
(iii) N-alquilar el compuesto de formula (VIII) con el compuesto de formula (V) , en el cual dicha Nalquilacion se lleva a cabo en un disolvente organico inerte en presencia de una base y opcionalmente en presencia de un catalizador.
7. El procedimiento segun la reivindicacion 6, en el cual el grupo protector es un grupo bencilo.
8. El procedimiento segun la reivindicacion 6, en el cual el grupo saliente es cloro o bromo.
9. El procedimiento segun la reivindicacion 6, en el cual en la etapa (iii) el disolvente organico es un disolvente aprotico polar seleccionado del grupo consistente en DMF, DMA y NMP.
10. El procedimiento segun la reivindicacion 6, en el cual en la etapa (iii) la base es al menos una de aminas terciarias, carbonatos de metales alcalinos o hidrogenocarbonatos de metales alcalinos.
11. El procedimiento segun la reivindicacion 6, en el cual la base es hidrogenocarbonato de sodio.
12. El procedimiento segun la reivindicacion 11, en el cual se utilizan de aproximadamente 1, 5 a aproximadamente 2, 5 equivalentes de base.
13. El procedimiento segun la reivindicacion 6, en el cual en la etapa (iii) el catalizador es al menos uno de
bromuros de metales alcalinos, yoduros de metales alcalinos, bromuros de tetraalquilamonio o yoduros de 25 tetraalquilamonio.
14. El procedimiento segun la reivindicacion 13, en el cual el catalizador es bromuro de sodio.
15. El procedimiento segun la reivindicacion 14, en el cual se utilizan de aproximadamente 0, 05 a aproximadamente 0, 25 equivalentes de catalizador.
16. El procedimiento segun la reivindicacion 15, en el cual se utilizan 0, 15 equivalentes de catalizador.
17. El procedimiento segun la reivindicacion 6, en el cual en la etapa (iii) se lleva a cabo dicha N-alquilacion a una temperatura entre aproximadamente temperatura ambiente y aproximadamente 80°C.
18. El procedimiento segun la reivindicacion 6, en el cual en la etapa (ii) se proporciona el compuesto de formula (V) en una cantidad de aproximadamente 1, 0 a aproximadamente 1, 5 equivalentes.
19. El procedimiento segun la reivindicacion 6, en el cual se lleva a cabo la etapa (b) para la configuracion 35 RSR/SRS del compuesto de formula (IX) o (IX') .
20. El procedimiento segun la reivindicacion 19, en el cual se obtiene la configuracion RSS/SRR de la mezcla en un exceso de aproximadamente nueve veces de la RSR/SRS.
21. El procedimiento segun la reivindicacion 6, en el cual en la etapa (b) se enfria la mezcla usando un gradiente de temperatura de aproximadamente 70 a aproximadamente 20°C.
22. El procedimiento segun la reivindicacion 21, en el cual el gradiente de temperatura es de 70 a 40°C.
23. El procedimiento segun la reivindicacion 6, en el cual en la etapa (b) el disolvente organico es acetonitrilo.
24. El procedimiento segun la reivindicacion 6, en el cual en la etapa (b) se lleva a cabo dicha epimerizacion en presencia de al menos 0, 1 equivalentes de la base.
25. El procedimiento segun la reivindicacion 6, en el cual se lleva a cabo dicha epimerizacion en presencia de al menos 0, 25 equivalentes de la base.
26. El procedimiento segun la reivindicacion 6, en el cual en la etapa (b) la base es un miembro seleccionado del grupo consistente en un alcoxido, una amidina, una guanidina y un fosfaceno.
27. El procedimiento segun la reivindicacion 26, en el cual la base es una amidina.
28. El procedimiento segun la reivindicacion 27, en el cual la base es diazabicicloundeceno.
29. El procedimiento segun la reivindicacion 6, en el cual en la etapa (b) el agua, si esta presente, no puede superar el 1, 0%.
30. El procedimiento segun la reivindicacion 6, en el cual en la etapa (b) el agua, si esta presente, no puede superar el 0, 1%.
31. El procedimiento segun la reivindicacion 6, en el cual en la etapa (c) se lleva a cabo dicha reduccion para la configuracion RSS/SRR del compuesto de formula (IX) o el compuesto de formula (IX') en un disolvente con borohidruro alcalino, borohidruro de tetrabutilamonio, tri (sec-butil) borohidruro alcalino o borohidruro de cinc, opcionalmente en presencia de un acido de Lewis.
32. El procedimiento segun la reivindicacion 31, en el cual el acido de Lewis es al menos uno de Ti (O-alquilo) 4, ZnCl2, haluro alcalino o haluro alcalinoterreo.
33. El procedimiento segun la reivindicacion 32, en el cual el disolvente es al menos uno de un eter, un alcohol
o un hidrocarburo halogenado.
34. El procedimiento segun la reivindicacion 33, en el cual se lleva a cabo dicha reduccion a temperaturas de entre aproximadamente -20°C y aproximadamente temperatura ambiente.
35. El procedimiento segun la reivindicacion 6, en el cual en la etapa (d) se lleva a cabo dicha desproteccion mediante hidrogenacion catalitica.
36. El procedimiento segun la reivindicacion 6, en el cual en la etapa (e) se realiza dicha purificacion del compuesto de formula (I) mediante la suspension de su sal clorhidrato en un disolvente.
37. El procedimiento segun la reivindicacion 36, en el cual se lleva a cabo la suspension en metanol como disolvente.
DOCUMENTOS INDICADOS EN LA DESCRIPCION
En la lista de documentos indicados por el solicitante se ha recogido exclusivamente para informacion del lector, y no es parte constituyente del documento de patente europeo. Ha sido recopilada con el mayor cuidado; sin embargo, la EPA no asume ninguna responsabilidad por posibles errores u omisiones.
Documentos de patente indicados en la descripcion
Literatura de patentesno citadas en ladescripcion
Patentes similares o relacionadas:
Derivados de piperidina 1,4 sustituidos, del 29 de Julio de 2020, de 89Bio Ltd: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de […]
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Derivados de bencimidazol como inhibidores Nav 1.7 (subunidad alfa del canal de sodio, dependiente del voltaje, tipo IX (SCN9A)) para tratar el dolor, la disuria y la esclerosis múltiple, del 22 de Julio de 2020, de Sumitomo Dainippon Pharma Co., Ltd: Un compuesto de fórmula (I): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, donde R1a, R1b, R1c, y R1d son independientemente hidrógeno, […]
Productos terapéuticos basados en la lantionina sintetasa 2 tipo C, del 15 de Julio de 2020, de LANDOS BIOPHARMA, INC: Un compuesto de la fórmula: **(Ver fórmula)** o una sal o éster farmacéuticamente aceptable de este, en donde: Q es piperazina-1,4-diilo; […]
Derivado de isoindolina, producto intermedio, método de preparación, composición farmacéutica y uso del mismo, del 8 de Julio de 2020, de Kangpu Biopharmaceuticals, Ltd: Un derivado de isoindolina que tiene una estructura de fórmula general (I), una sal, un solvato, un polimorfo, un estereoisómero o un compuesto isotópico farmacéuticamente aceptables […]
Derivados de piperidina en calidad de inhibidores de HDAC1/2, del 8 de Julio de 2020, de Regenacy Pharmaceuticals, Inc: Un compuesto de Fórmula IIIa: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde R1 se selecciona del grupo que consiste […]
Proceso para la producción a gran escala de oxalato de 1isopropil3{5[1(3metoxipropil) piperidin4il] [1,3,4]oxadiazol2il}1Hindazol, del 8 de Julio de 2020, de SUVEN LIFE SCIENCES LIMITED: Un proceso para la producción a gran escala del oxalato de 1-isopropil-3-{5-[1-(3-metoxipropil) piperidin- 4-il] -[1,3,4]oxadiazol-2-il}-1H-indazol […]
Compuestos de 6-heterociclil-4-morfolin-4-ilpiridin-2-ona útiles para el tratamiento del cáncer y la diabetes, del 1 de Julio de 2020, de Sprint Bioscience AB: Un compuesto de la Fórmula (I) **(Ver fórmula)** en donde R1, R2 y R3 se seleccionan independientemente de hidrógeno, haloalquiloC1-C3 […]