PROCEDIMIENTO PARA LA PREPARACIÓN DE DISPERSIONES DE NANO-PARTÍCULAS CRISTALINAS.
Un procedimiento para la preparación de una dispersión de partículas nanocristalinas en un medio acuoso,
que comprende combinar: a) una primera disolución que comprende una sustancia sustancialmente insoluble en agua en un disolvente orgánico miscible con el agua con; b) una fase acuosa que comprende agua y opcionalmente un estabilizante, para formar una dispersión de partículas amorfas; c) sonicar la dispersión de partículas amorfas durante un periodo suficiente para formar partículas nanocristalinas de la sustancia sustancialmente insoluble en agua; y opcionalmente, retirar el disolvente orgánico miscible con el agua; y d) en donde la concentración de la sustancia sustancialmente insoluble en agua en la disolución combinada y la fase acuosa después de la etapa (b) del procedimiento es 10 mM o menos
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB2003/003044.
Solicitante: ASTRAZENECA AB.
Nacionalidad solicitante: Suecia.
Dirección: 151 85 SÖDERTÄLJE SUECIA.
Inventor/es: SKANTZE,TOMMY,URBAN, LINDFORS,PER,LENNART, FORSSEN,Sara.
Fecha de Publicación: .
Fecha Solicitud PCT: 14 de Julio de 2003.
Clasificación Internacional de Patentes:
- A61K9/14H4
- A61K9/14H6
- A61K9/51H6B
Clasificación PCT:
- A61K9/10 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Dispersiones; Emulsiones.
- A61K9/14 A61K 9/00 […] › en estado especial, p. ej. polvos (microcápsulas A61K 9/50).
- A61K9/51 A61K 9/00 […] › Nanocápsulas.
Clasificación antigua:
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
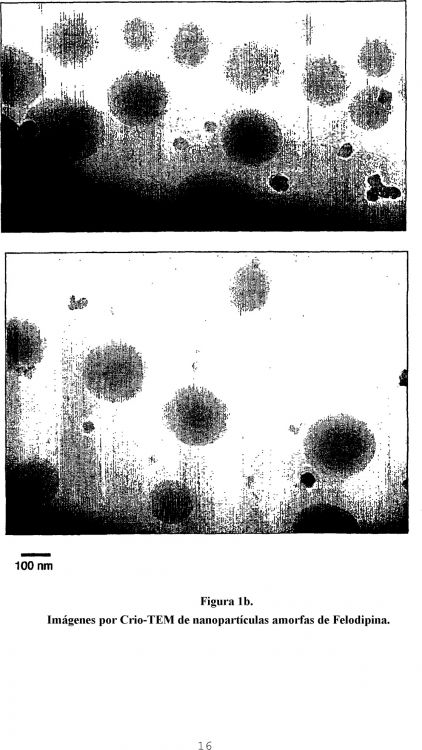
Fragmento de la descripción:
La presente invención se refiere a un procedimiento para la preparación de una dispersión de nanopartículas cristalinas, particularmente una dispersión de nanopartículas cristalinas en un medio acuoso y más particularmente a un procedimiento para la preparación de una dispersión de nanopartículas cristalinas que comprende un compuesto farmacológicamente activo sustancialmente insoluble en agua en un medio acuoso. 5
Las dispersiones de un material sólido en un medio líquido son útiles en varias aplicaciones diferentes, que incluyen pinturas, tintas, dispersiones de pesticidas y otros productos agroquímicos, dispersiones de biocidas y dispersiones de compuestos farmacológicamente activos.
En el campo farmacéutico, muchos compuestos farmacológicamente activos tienen una solubilidad muy baja en el agua, lo que puede dar como resultado una baja biodisponibilidad cuando se administran tales 10 compuestos a un paciente. De manera general, la biodisponibilidad de tales compuestos se mejora mediante la reducción del tamaño de partícula del compuesto, particularmente hasta un tamaño submicrónico, dado que esto mejora la velocidad de disolución y, en consecuencia, la absorción del compuesto.
La formulación de un compuesto farmacológicamente activo como una suspensión acuosa, particularmente una suspensión con un tamaño de partícula submicrónico, posibilita la administración intravenosa del compuesto, 15 proporcionando de este modo una ruta alternativa de administración que puede aumentar la biodisponibilidad en comparación con la administración oral.
Se conoce en la técnica que la formación de suspensiones de nanopartículas cristalinas (nanocristales) mediante la precipitación directa es problemática. La rápida precipitación necesaria para conseguir un tamaño de partícula pequeño a menudo da como resultado inicialmente una suspensión de material amorfo. Aunque las 20 partículas amorfas a menudo cristalizarán a lo largo del tiempo, el lento crecimiento de los cristales tiende a dar como resultado la formación de cristales grandes con un tamaño de partícula de >1 micrómetro. Los intentos de precipitar material cristalino por precipitación directa son generalmente difíciles de controlar y dan como resultado la formación y crecimiento de cristales grandes (>1 micrómetro).
La patente de EE.UU. 4.826.689 describe un procedimiento para la preparación de partículas amorfas de un 25 sólido mediante la infusión de un líquido precipitante acuoso en una disolución del sólido en un líquido orgánico bajo condiciones controladas de temperatura y velocidad de infusión, controlándose de este modo el tamaño de partícula. La patente de EE.UU. 4.997.454 describe un procedimiento similar para la preparación de partículas amorfas en el que el líquido precipitante no es acuoso. La patente de EE.UU. 5.118.528 también describe un procedimiento para preparar una dispersión coloidal de partículas usando un procedimiento de precipitación con 30 disolvente/antidisolvente.
La patente de EE.UU. 5.780.062 describe un procedimiento para preparar pequeñas partículas estables, en el que una disolución de una sustancia en un disolvente orgánico es precipitada en una disolución acuosa que contiene complejos de polímero/amfifilo.
De manera general, la solubilidad amorfa de una sustancia es significativamente más alta que la solubilidad 35 cristalina de la sustancia. Por consiguiente, las partículas amorfas son propensas a velocidades más altas de crecimiento de partículas mediante mecanismos de crecimiento de partículas dirigidos por la solubilidad, tales como la maduración de Ostwald, en comparación con las partículas cristalinas. Por lo tanto, las suspensiones cristalinas tienden a ser estables durante significativamente más tiempo que las dispersiones de partículas amorfas, debido a que la maduración de Ostwald se produce a una velocidad más lenta en las partículas cristalinas. Las dispersiones 40 de partículas amorfas también son propensas a recristalizar como una forma cristalina más estable, dando como resultado el crecimiento incontrolado de cristales grandes.
Las solicitudes de patente internacional WO 98/23350 y WO 99/59709 describen procedimientos en los que un fundido de un compuesto orgánico se dispersa en un líquido para formar una emulsión. Después, la emulsión se somete a ultrasonidos para dar una dispersión cristalina. Las partículas preparadas usando el procedimiento son del 45 orden de 2 a 10 micrómetros.
Se conoce en la técnica que las dispersiones cristalinas obtenidas directamente por precipitación son influenciadas por la agitación de las disoluciones. Se conocen en la técnica diversos métodos de agitación (véase, por ejemplo, la solicitud de patente internacional WO 01/92293), por ejemplo, mezcla mecánica, vibración, tratamiento con microondas y sonicación. 50
La solicitud de patente internacional WO 96/32095 describe un procedimiento para la formación directa de cristales introduciendo una disolución de una sustancia en un disolvente en la forma de gotitas o como un chorro en un antidisolvente agitado. La agitación se lleva a cabo usando varias técnicas, que incluyen agitación ultrasónica. Los cristales resultantes tienen, de manera general, un diámetro mediano de masa de 1 a 6 micrómetros.
La patente de EE.UU. 5.314.506 describe un procedimiento de cristalización en el que un chorro de una disolución que contiene una sustancia se hace chocar con un segundo chorro que contiene un antidisolvente para la sustancia. La rápida mezcla producida por los chorros que chocan da como resultado una reducción de los cristales así formados en comparación con los procedimientos de cristalización lenta convencionales. Los cristales más pequeños descritos son de aproximadamente 3 micrómetros, y la mayoría están en el intervalo de 3 a 20 5 micrómetros.
La solicitud de patente internacional WO 00/44468 describe una modificación al aparato descrito en la patente de EE.UU. 5.314.506 en la que se aplica energía de ultrasonidos en el punto de choque de los dos chorros para potenciar adicionalmente la mezcla localizada, y se afirma que da la formación directa de cristales pequeños con un diámetro menor que 1 micrómetro. De manera general, las partículas cristalinas descritas tienen un tamaño 10 medio de 0,5 micrómetros.
La solicitud de patente internacional WO 00/38811 describe un aparato y procedimiento en el que se preparan partículas cristalinas adecuadas para inhalación mediante la precipitación de una sustancia desde una disolución usando un antidisolvente en una cámara de mezcla de celda de flujo en presencia de radiación ultrasónica en el punto de mezcla del sistema disolvente y antidisolvente. Este método da como resultado la 15 cristalización directa de partículas que tienen por lo general un tamaño medio de partícula de 4 a 10 micrómetros. Las solicitudes de patente internacional WO 02/00199 y WO 03/035035 describen modificaciones al procedi- miento descrito en la solicitud de patente internacional WO 00/38811 que reducen la aglomeración de cristales y permiten un aislamiento más eficaz de los cristales así formados.
En un nuevo método de obtención de nanopartículas cristalinas, Kasai et al (Jpn. J. Appl. Phys., 31, L1132 20 (1992)) precipitaron partículas mediante la adición gota a gota de una disolución en etanol de un compuesto orgánico (por lo general 50 µl con una concentración de 30 mM) en 10 ml de agua vigorosamente agitada, dando una concentración total de aproximadamente 0,15 mM. Después se continuó la agitación durante unos minutos y el tamaño de partícula obtenido fue aproximadamente 300 nm. Estos autores encontraron que el tamaño de partícula podría ser reducido mediante la precipitación a concentraciones aún más bajas. Mediante el mismo procedimiento, 25 Kasai et al (Bull Chem Soc Jpn, 71, 2597 (1998)) formaron suspensiones acuosas de nanocristales de perileno a concentraciones entre 2,5 y 20 µM. Sin embargo, tales bajas concentraciones requieren, de manera general, que la muestra sea concentrada, p.ej. por ultrafiltración, antes de su uso. Además, si la concentración inicial total de compuestos orgánicos es aumentada, entonces el tamaño de las partículas obtenidas por tales métodos es >1 µm. (véase p.ej. F. Ruch, E. Matijevic, Journal of Colloid and Interface Science, 229, 207 (2000)). 30
La patente europea EP 275 607 describe un procedimiento en el que se aplica energía de ultrasonidos a una suspensión de cristales en una fase líquida, siendo...
Reivindicaciones:
1. Un procedimiento para la preparación de una dispersión de partículas nanocristalinas en un medio acuoso, que comprende combinar:
a) una primera disolución que comprende una sustancia sustancialmente insoluble en agua en un disolvente orgánico miscible con el agua con;
b) una fase acuosa que comprende agua y opcionalmente un estabilizante, para formar una dispersión 5 de partículas amorfas;
c) sonicar la dispersión de partículas amorfas durante un periodo suficiente para formar partículas nanocristalinas de la sustancia sustancialmente insoluble en agua; y opcionalmente, retirar el disolvente orgánico miscible con el agua; y
d) en donde la concentración de la sustancia sustancialmente insoluble en agua en la disolución 10 combinada y la fase acuosa después de la etapa (b) del procedimiento es 10 mM o menos.
2. Un procedimiento según la reivindicación 1, en el que las partículas nanocristalinas tienen un tamaño medio de partícula de 50 a 250 nm.
3. Un procedimiento según la reivindicación 1 ó 2, en el que la sustancia sustancialmente insoluble en agua es un compuesto farmacológicamente activo sustancialmente insoluble en agua. 15
4. Un procedimiento según la reivindicación 1, en el que la concentración de la sustancia sustancialmente insoluble en agua en la disolución y la fase acuosa combinadas después de la etapa (b) es de 0,5 a 3 mM.
5. Un procedimiento según una cualquiera de las reivindicaciones precedentes, en el que la fase acuosa contiene un estabilizante.
6. Un procedimiento según la reivindicación 5, en el que el estabilizante comprende un dispersante polimérico y un 20 tensioactivo amfifílico.
7. Un procedimiento según la reivindicación 6, en el que el estabilizante comprende un dispersante polimérico y un tensioactivo aniónico.
8. Un procedimiento según la reivindicación 7, en el que el dispersante polimérico es polivinilpirrolidona y el tensioactivo aniónico es dodecilsulfato de sodio. 25
9. Un procedimiento según una cualquiera de las reivindicaciones 6 a 8, en el que el tensioactivo amfifílico está en una concentración por debajo de la concentración de asociación crítica entre el amfifílico-polímero.
10. Un procedimiento según una cualquiera de las reivindicaciones precedentes, en el que la combinación de la primera disolución y la fase acuosa se lleva a cabo con una mezcla rápida.
11. Un procedimiento según la reivindicación 10, en el que la mezcla rápida comprende sonicación durante la 30 combinación.
12. Un procedimiento según una cualquiera de las reivindicaciones precedentes, en el que la combinación de la primera disolución y la fase acuosa se lleva a cabo en menos que 30 segundos.
13. Un procedimiento según una cualquiera de las reivindicaciones precedentes, en el que la primera disolución se añade a la fase acuosa. 35
14. Un procedimiento según una cualquiera de las reivindicaciones precedentes, en el que la dispersión de partículas amorfas formadas después de la combinación de la primera disolución y la fase acuosa es sonicada durante al menos 10 minutos.
15. Un procedimiento según una cualquiera de las reivindicaciones precedentes, en el que la dispersión de partículas amorfas formadas después de la combinación de la primera disolución y la fase acuosa es sonicada 40 de 20 a 100 minutos.
16. Un procedimiento según una cualquiera de las reivindicaciones precedentes, en el que la sonicación tiene lugar a una temperatura por debajo de 50ºC.
17. Un procedimiento según una cualquiera de las reivindicaciones precedentes, que comprende además aislar las partículas nanocristalinas del medio acuoso. 45
Patentes similares o relacionadas:
NANOPARTÍCULAS DE ISOFLAVONAS Y SU UTILIZACIÓN, del 9 de Diciembre de 2011, de DSM IP ASSETS B.V.: Composición de isoflavona en nanopartículas, la cual comprende una isoflavona, un soporte y opcionalmente, agua, caracterizada porque, la isoflavona tiene un tamaño de partícula […]
FORMULACION FARMACEUTICA QUE COMPRENDE UN COMPUESTO RECEPTOR CB1 EN UNA SOLUCION SOLIDA Y/O DISPERSION SOLIDA, del 8 de Septiembre de 2011, de LABORATORIOS DEL DR. ESTEVE, S.A.: La presente invención se refiere a una formulación farmacéutica que comprende piperidin-1-ilamida del ácido 5-(4-cloro-fenil)-1-(2,4-dicloro-feniD-4,5-dihidro-1H-pirazol-3-carboxílico […]
 DISPOSITIVO POLIMÉRICO IMPLANTABLE PARA LIBERACIÓN SOSTENIDA DE AGONISTA DE DOPAMINA, del 30 de Mayo de 2011, de TITAN PHARMACEUTICALS, INC.: Un dispositivo implantable para la administración de un agonista de dopamina a un mamífero que lo necesita, que comprende un agonista de dopamina y una matriz polimérica […]
DISPOSITIVO POLIMÉRICO IMPLANTABLE PARA LIBERACIÓN SOSTENIDA DE AGONISTA DE DOPAMINA, del 30 de Mayo de 2011, de TITAN PHARMACEUTICALS, INC.: Un dispositivo implantable para la administración de un agonista de dopamina a un mamífero que lo necesita, que comprende un agonista de dopamina y una matriz polimérica […]
 AEROSOLES QUE COMPRENDEN FÁRMACOS EN NANOPARTÍCULAS, del 20 de Mayo de 2011, de ELAN PHARMA INTERNATIONAL LIMITED: Una composición en aerosol de polvo seco que comprende agregados de partículas de fármaco nanoparticulado, en la que: (a) los agregados […]
AEROSOLES QUE COMPRENDEN FÁRMACOS EN NANOPARTÍCULAS, del 20 de Mayo de 2011, de ELAN PHARMA INTERNATIONAL LIMITED: Una composición en aerosol de polvo seco que comprende agregados de partículas de fármaco nanoparticulado, en la que: (a) los agregados […]
 SISTEMAS LIQUISÓLIDOS Y PROCEDIMIENTOS DE PREPARACIÓN DE LOS MISMOS, del 31 de Marzo de 2011, de Spireas, Spiridon
Bolton, Sanford M: LOS SISTEMAS LIQUISOLIDOS CONSISTEN EN FORMAS PULVERULENTAS DE UNA FLUIDEZ Y DE UNA COMPRESIBILIDAD ACEPTABLES DE MEDICAMENTOS LIQUIDOS. SEGUN […]
SISTEMAS LIQUISÓLIDOS Y PROCEDIMIENTOS DE PREPARACIÓN DE LOS MISMOS, del 31 de Marzo de 2011, de Spireas, Spiridon
Bolton, Sanford M: LOS SISTEMAS LIQUISOLIDOS CONSISTEN EN FORMAS PULVERULENTAS DE UNA FLUIDEZ Y DE UNA COMPRESIBILIDAD ACEPTABLES DE MEDICAMENTOS LIQUIDOS. SEGUN […]
COMPOSICIONES DE AGENTE ACTIVO EN NANOPARTÍCULAS ESTABILIZADAS EN GEL, del 30 de Marzo de 2011, de ELAN PHARMA INTERNATIONAL LIMITED: Una composición de gelatina sólida o semisólida, que comprende: (a) partículas de al menos un agente activo que tienen un tamaño de partícula promedio […]
COMPOSICIONES NANOPARTICULADAS QUE TIENEN LISOZIMA COMO UN ESTABILIZADOR DE SUPERFICIE, del 30 de Julio de 2010, de ELAN PHARMA INTERNATIONAL LTD: Una composición nanoparticulada que comprende por lo menos un agente diagnóstico o terapéutico que tiene lisozima adsorbida en la superficie de la misma en una cantidad suficiente […]
PROTEÍNAS DEPOSITADAS SOBRE PARTÍCULAS BIOCOMPATIBLES POCO SOLUBLES PARA LA LIBERACIÓN CONTROLADA DE PROTEÍNAS HACIA UN ENTORNO BIOLÓGICO DESDE UNA MATRIZ POLIMÉRICA, del 14 de Febrero de 2012, de PROTHERICS SALT LAKE CITY, INC: Un sistema de transporte de fármacos para la liberación controlada de proteínas hacia un entorno biológico, que comprende: a) una partícula […]