PROCEDIMIENTO PARA LA PREPARACION DE COMBINACIONES DE VALSARTAN Y SIMVASTATINA.
Procedimiento para la preparación de combinaciones de valsartán y simvastatina.
La presente invención se refiere a un nuevo procedimiento para la preparación de combinaciones amorfas de valsartán y simvastatina en forma de partículas micrónicas, que comprende introducir en un recipiente de formación de partículas una solución con los principios activos, y un fluido comprimido en condiciones supercríticas, en donde el recipiente en el que se forman las partículas se encuentra a una presión comprendida entre la presión atmosférica y 10 bares. También se refiere a las combinaciones amorfas obtenibles de acuerdo con el procedimiento de la invención, a su utilización para la preparación de formas farmacéuticas sólidas para su administración por vía oral, y también a dichas formas farmacéuticas sólidas. Dichas combinaciones amorfas presentan una humectabilidad mejorada y se mantienen en estado amorfo tras períodos largos de almacenamiento
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P200802836.
Solicitante: ACTIVERY BIOTECH, S.L.
Nacionalidad solicitante: España.
Provincia: NAVARRA.
Inventor/es: KORDIKOWSKI,ANDREAS, VENTOSA RULL,CARLES, SAEZ MUÑOZ,CRISTINA.
Fecha de Solicitud: 7 de Octubre de 2008.
Fecha de Publicación: .
Fecha de Concesión: 11 de Enero de 2011.
Clasificación Internacional de Patentes:
- A61K31/366 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › teniendo ciclos de seis eslabones, p. ej. delta-lactonas.
- A61K31/41 A61K 31/00 […] › que tienen ciclos con cinco eslabones con varios heteroátomos, uno al menos nitrógeno, p. ej. tetraazoles.
- A61K9/20P
- B01J2/04 TECNICAS INDUSTRIALES DIVERSAS; TRANSPORTES. › B01 PROCEDIMIENTOS O APARATOS FISICOS O QUIMICOS EN GENERAL. › B01J PROCEDIMIENTOS QUÍMICOS O FÍSICOS, p. ej. CATÁLISIS O QUÍMICA DE LOS COLOIDES; APARATOS ADECUADOS. › B01J 2/00 Procedimientos o dispositivos para la granulación de sustancias, en general; Tratamiento de materiales particulados para hacer que fluyan libremente, en general, p. ej. haciéndolos hidrófobos. › en un medio gaseoso.
Clasificación PCT:
- A61K31/366 A61K 31/00 […] › teniendo ciclos de seis eslabones, p. ej. delta-lactonas.
- A61K31/41 A61K 31/00 […] › que tienen ciclos con cinco eslabones con varios heteroátomos, uno al menos nitrógeno, p. ej. tetraazoles.
- A61K9/20 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Píldoras, pastillas o comprimidos.
- B01J2/04 B01J 2/00 […] › en un medio gaseoso.
Fragmento de la descripción:
Procedimiento para la preparación de combinaciones de valsartán y simvastatina.
Campo de la técnica
La presente invención se refiere a un nuevo procedimiento para la preparación de combinaciones amorfas de valsartán y simvastatina.
Estado de la técnica anterior
En la solicitud de patente PCT WO-A-95/26188 se describe la combinación de inhibidores de HMG-CoA reductasa (3-hidroxi-3-metilglutaril coenzima A reductasa) y antagonistas de angiotensina II para el tratamiento de la arterioesclerosis y la reducción de los niveles de colesterol. En el estado de la técnica figuran numerosas publicaciones sobre los efectos terapéuticos de dicha combinación como por ejemplo en el artículo de Chatzizisis et al., Role of valsartan alone or in combination with simvastatin in reducing inflammation of thin cap fibroatheromas, Circulation, 2007, 116, II, 2, o en el artículo de Ledingham et al., Effect of simvastatin given alone and in combination with valsartan or enalapril on blood pressure and the sfrucfure of mesenteric resistance arteries and the basilar artery in the genetically hypertensive rat model, Clin. Exp. Pharm. Phys., 2005, 32, 76-85.
La simvastatina es un principio activo que pertenece al grupo de los inhibidores de HMG-CoA reductasa, y responde a la estructura:

La simvastatina se utiliza como agente terapéutico hipolipemiantes, porque disminuyen el nivel en la sangre de colesterol perjudicial (LDL) así como de otros lípidos metabólicos (triglicéridos).
Según los datos que figuran en el Merck Index, la simvastatina presenta una solubilidad en agua de 0,03 mg/ml, y por ello puede considerarse como un principio activo con una baja solubilidad en agua.
En la solicitud de patente norteamericana US-A-2006/0223882 se describe simvastatina en forma amorfa, que se obtiene a partir del secado de una solución de simvastatina en un disolvente orgánico. También se describe simvastatina amorfa en combinación con excipientes farmacéuticamente aceptables.
En la solicitud de patente europea EP-A-1905424 se describe un procedimiento para preparar partículas estabilizadas de "statinas", entre ellas la simvastatina. El procedimiento comprende la disolución o dispersión de un agente estabilizante en un disolvente, la pulverización de dicha solución- dispersión sobre la simvastatina amorfa y la eliminación del disolvente. También se indica que la oxidación, el calor, la luz, la humedad, y valores bajos de pH pueden afectar la estabilidad de formas farmacéuticas que incluyan formas amorfas del principio activo.
El artículo Patel et al., Preparation, Characterization, and Dissolution Behavior of a Solid Dispersión of Simvastatin with Polyethylene Glycol 4000 and Polyvinylpyrrolidone K30, J. Disp. Sci. Technol., 2008, 29, 193-204, se refiere a un estudio para mejorar la solubilidad y la velocidad de disolución de la simvastatina, que es un principio activo que presenta una baja solubilidad en agua. En el mismo artículo se describen dispersiones sólidas de simvastatina con PEG 4000 y con PVP K30 para incrementar la solubilidad y la velocidad de disolución del principio activo. Dichas dispersiones sólidas se preparan por fusión del excipiente polimérico, o por evaporación de una disolución etanólica que contiene el principio activo y el excipiente polimérico.
El valsartán pertenece a un grupo de compuestos denominados antagonistas del receptor de la angiotensina II, que se emplea en medicina como agente antihipertensivo y en casos de insuficiencia cardiaca.
El valsartán responde a la estructura:

Según el artículo C. J. Mhab, Physicochemical properties of valsartan and the effect of ethyl alcohol, propylene glycol and pH on its solubility, Pharmazie, 2005, 60 (11), 849-850, el valsartán presenta una solubilidad en agua de 0,12 mg/ml a pH 2,3 y de 0,63 mg/ml a pH 7, y por ello puede ser considerado como un principio activo poco soluble en agua.
En el artículo de Cappello et al., Improvement of Solubility and Stability of Valsarían by Hydroxypropyl-β-Cyclodextrin, J. Inclusión Phenom. Macroc. Chem., 2006, 54, 289-294, se describe que el valsartán presenta una baja biodisponibilidad, probablemente asociada a su baja solubilidad en agua. En dicho artículo se describe el aumento de la solubilidad en agua y de la velocidad de disolución de valsartán cuando se emplea en forma de un complejo de inclusión en una ciclodextrina.
La solicitud de patente PCT WO-A-2008/076780 se refiere a composiciones de valsartán que presentan una biodisponibilidad aumentada. En ella se describe una composición en forma de dispersión sólida que comprende valsartán amorfo y un polímero potenciador de la solubilidad. También se describe un procedimiento para preparar dicha composición mediante la atomización de un sistema disolvente que comprende valsartán, un polímero potenciador de la solubilidad como por ejemplo polivinilpirrolidona (PVP) o hidroximetilcelulosa (HMC) entre otros, y eventualmente un excipiente farmacéuticamente aceptable adicional.
En la solicitud de patente PCT WO-A-02/06253 se describe un procedimiento para obtener sales amorfas de valsartán, y también se indica que el valsartán en forma de ácido libre es prácticamente amorfo y que, dadas sus características físicas, presenta inconvenientes para ser empleado en la preparación de composiciones farmacéuticas.
En la solicitud de patente PCT WO-A-2004/083192 se describen procedimientos para preparar valsartán amorfo por precipitación de disoluciones de valsartán en distintos disolventes orgánicos mediante la evaporación del disolvente o por la adición de un anti-solvente.
En la solicitud de patente PCT WO-A-2004/087681 se describen procedimientos para preparar valsartán amorfo por evaporación bajo vacío o por atomización de soluciones de valsartán en un alcohol o mezclas de alcoholes.
En la solicitud de patente PCT WO-A-2006/076561 se describen procedimientos para preparar valsartán amorfo por evaporación del disolvente de una disolución de valsartán en un disolvente orgánico seleccionado de un grupo que consiste en alcoholes C1-C3, esteres C2-C4, éteres C3-C5, cetonas, amidas C1-C5, DMSO, acetonitrilo, tolueno, y sus mezclas con agua. La eliminación del disolvente se puede efectuar bajo vacío o por atomización.
En la solicitud de patente europea EP-A-1586310 se describe que en los procesos para preparar valsartán amorfo por precipitación se obtienen frecuentemente productos heterogéneos, esto es, mezclas con partes de productos amorfos y cristalinos, y que no se puede excluir una transformación de durante el almacenaje o en el procesamiento posterior.
En la solicitud de patente PCT WO-A-2007/017897 se describe un procedimiento para preparar valsartán amorfo a partir del enfriamiento de una suspensión de valsartán en xileno o tolueno preparada a 50ºC. Se indica también que el valsartán amorfo tiende a formar un sólido vitrificado y pegajoso, que presenta una dispersabilidad deficiente cuando se pone en contacto con disolventes acuosos o polares.
En la solicitud de patente PCT WO-A-2008/035364 se describe un procedimiento para preparar valsartán micronizado por atomización de una solución de valsartán en un disolvente orgánico. Se indica que el producto obtenido está en estado amorfo.
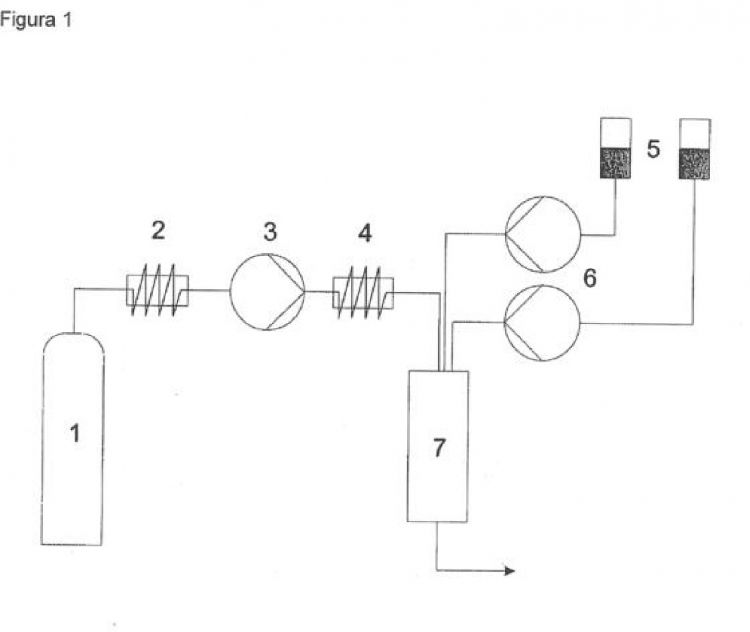
En la solicitud de patente española ES-A-2170008 se describe un procedimiento para la precipitación de partículas sólidas finamente divididas en el que se emplea un fluido en condiciones supercríticas. En dicho procedimiento se forma una solución de la sustancia objetivo en una mezcla de un disolvente y un fluido supercrítico, que actúa como co-solvente, en unas condiciones de temperatura y presión determinadas. Las partículas se forman al despresurizar la solución a presión atmosférica, debido a la evaporación del fluido supercrítico y al consiguiente enfriamiento brusco de la solución. Esta solicitud de patente se refiere al procedimiento conocido como DELOS (Depressurization of an Expended Liquid Organic Solution).
En la solicitud de patente WO03/008082-A1,...
Reivindicaciones:
1. Procedimiento para la preparación de una combinación amorfa de valsartán y simvastatina caracterizado porque comprende:
a) introducir en un recipiente de formación de partículas, a través de conductos separados, un flujo de un fluido comprimido en condiciones de presión y temperatura supercríticas, y un flujo de una solución de una mezcla de valsartán y simvastatina en un disolvente, y
b) recoger las partículas formadas,
en donde la entrada de la solución de fármacos tiene lugar dentro de la línea central del flujo del fluido comprimido, y
en donde el recipiente de formación de partículas se encuentra a una presión comprendida entre la presión atmosférica y 10 bares y a una temperatura comprendida entre 0,80 y 1,25 veces la temperatura crítica del fluido comprimido expresada en grados Kelvin.
2. Procedimiento según la reivindicación 1, caracterizado porque el fluido comprimido es anhídrido carbónico.
3. Procedimiento según cualquiera de las reivindicaciones 1 ó 2, caracterizado porque la presión de entrada del fluido comprimido en el recipiente de formación de partículas está comprendida entre 1,01 y 9 veces su presión crítica expresada en bares.
4. Procedimiento según cualquiera de las reivindicaciones anteriores, caracterizado porque la solución de la mezcla de valsartán y simvastatina en un disolvente contiene un excipiente farmacéuticamente aceptable adicional.
5. Procedimiento según cualquiera de las reivindicaciones anteriores, caracterizado porque en el punto donde se encuentran el flujo de la solución de valsartán y simvastatina con el flujo del fluido comprimido, el ángulo formado por los ejes de cada uno de los flujos está comprendido entre 0º y 180º.
6. Procedimiento según cualquiera de las reivindicaciones anteriores, caracterizado porque la presión en el recipiente de formación de partículas está comprendida entre la presión atmosférica y 5 bares.
7. Procedimiento según la reivindicación 6, caracterizado porque la presión en el recipiente de formación de partículas es la presión atmosférica.
8. Procedimiento según cualquiera de las reivindicaciones anteriores, caracterizado porque la proporción ponderal entre el valsartán y la simvastatina está comprendida entre 1:100 y 100:1.
9. Procedimiento según la reivindicación 8, caracterizado porque la proporción ponderal entre el valsartán y la simvastatina es 1:2.
10. Procedimiento según la reivindicación 8, caracterizado porque la proporción ponderal entre el valsartán y la simvastatina es 64:1.
11. Una combinación amorfa de valsartán y simvastatina obtenible de acuerdo con el procedimiento de cualquiera de las reivindicaciones 1 a 10.
12. Utilización de una combinación amorfa según la reivindicación 11 para la preparación de formas farmacéuticas sólidas para la administración por vía oral.
13. Una forma farmacéutica sólida para la administración por vía oral que comprende una cantidad terapéuticamente efectiva de una combinación amorfa de la reivindicación 11 y al menos un excipiente farmacéuticamente aceptable.
14. Forma farmacéutica sólida según la reivindicación 13, caracterizada porque es un comprimido.
Patentes similares o relacionadas:
Composiciones que contienen un material biológicamente activo y un óxido inorgánico no ordenado, del 22 de Julio de 2020, de W.R. GRACE & CO.-CONN.: Una composición que comprende un material biológicamente activo y un material de óxido inorgánico, en donde el material de óxido inorgánico comprende […]
Moduladores de la indolamina 2,3-dioxigenasa, del 24 de Junio de 2020, de Glaxosmithkline Intellectual Property (No. 2) Limited: Un compuesto que tiene la estructura de Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: X es **(Ver fórmula)** […]
Compuestos de benzaldehído sustituidos y métodos para su uso en el aumento de la oxigenación tisular, del 27 de Mayo de 2020, de Global Blood Therapeutics, Inc: Un compuesto de Fórmula (I): **(Ver fórmula)** o un tautómero o una sal farmacéuticamente aceptable del mismo, para su uso en el tratamiento […]
Compuesto heterocíclico, del 13 de Mayo de 2020, de TAKEDA PHARMACEUTICAL COMPANY LIMITED: Un compuesto **(Ver fórmula)** en donde el Anillo A es un anillo opcionalmente sustituido adicionalmente, el Anillo D es un anillo opcionalmente sustituido […]
Derivados de naftofurano para uso como agentes antineoplásicos, del 18 de Marzo de 2020, de KYOTO PHARMACEUTICAL INDUSTRIES, LTD.: Un compuesto representado por la fórmula (IA): **(Ver fórmula)** en donde R1 en el número de n son cada uno en forma independiente […]
Ácidos de carbamoiloximetil triazol ciclohexilo como antagonistas de LPA, del 11 de Marzo de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de acuerdo con la fórmula (I): **(Ver fórmula)** o estereoisómeros, tautómeros, sales farmacéuticamente aceptables o solvatos de los mismos, en donde […]
Derivado de la clorina de utilidad en terapia y diagnóstico fotodinámico, del 19 de Febrero de 2020, de RMW Cho Group Limited: Clorina e4 de sodio, que tiene la estructura: **(Ver fórmula)**
AGENTES PARA EL TRATAMIENTO DEL TRASTORNO POR USO DE ALCOHOL, del 13 de Febrero de 2020, de SERVICIO ANDALUZ DE SALUD: La presente invención se refiere al uso de compuestos agonistas PPAR¿ para la prevención, alivio, mejora y/o tratamiento del trastorno por uso de alcohol.