Procedimiento para recubrimiento en seco.
Procedimiento para recubrimiento en seco, para sustratos sólidos,
en especial para la fabricación de formas deadministración farmacéutica dotadas de recubrimiento, caracterizado porque:
(i) se hace uso exclusivamente de componentes sin disolvente, que consisten en (a) como mínimo, unpolímero de recubrimiento y (b) como mínimo, un plastificante que es líquido a la temperatura derecubrimiento;
(ii) ambos componentes (a) y (b) son aplicados separadamente sobre los núcleos en las proporciones decantidad previamente determinadas y con los grosores de capa previamente determinados y con latemperatura y tiempo de aplicación previamente determinados para la formación de película coherente,manteniéndolos el tiempo suficiente hasta que se forma una película coherente; de manera que
(iii) el polímero de recubrimiento es seleccionado del grupo que contiene derivados de celulosa, poliacrilatoy derivados de polivinilo, y
(iv) el plastificante es seleccionado del grupo que contiene glicéridos de ácidos grasos acetilados, citratos,ftalatos, sebacatos, glicerina y derivados de glicerina, copolímeros de polioxietileno-polioxipropileno,propilenglicoles y aceite de ricino, y
(v) se aplica un máximo de 20% de disolvente con respecto al peso del núcleo, con el plastificante oseparadamente como recubrimiento.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/CH2005/000264.
Solicitante: Mepha Schweiz AG.
Nacionalidad solicitante: Suiza.
Dirección: Dornacherstrasse 114, Postfach 445 4147 Aesch SUIZA.
Inventor/es: BETZING, JURGEN, DR., ENGELMANN,STEPHAN.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K9/32 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › que contienen polímeros sintéticos sólidos.
- A61K9/58 A61K 9/00 […] › que contienen polímeros sintéticos sólidos.
PDF original: ES-2400186_T3.pdf
Fragmento de la descripción:
Procedimiento para recubrimiento en seco La presente invención se refiere a un procedimiento para recubrimiento en seco para sustratos sólidos, en especial para la fabricación de formas de administración farmacéutica dotadas de recubrimiento, por ejemplo, para la fabricación de tabletas y pastillas recubiertas, en las que se utilizan exclusivamente componentes de recubrimiento libres de disolventes.
El recubrimiento o bien recubrimiento con un film de diferentes sustratos es conocido. Así, por ejemplo, es conocida la fabricación de formas de administración o formas farmacéuticas de medicamentos en las que los sustratos, también llamados núcleos, son recubiertos con componentes de recubrimiento, en los que, como mínimo, uno de estos componentes está disuelto o dispersado en un disolvente orgánico o inorgánico, preferentemente agua, por ejemplo en forma de látex. También es conocido aplicar en primer lugar dos “componentes secos”, por ejemplo un polímero y un producto plastificante, y finalmente un tercer componente que contiene el disolvente sobre el sustrato o bien elaborar el componente que contiene el disolvente en el producto plastificante y fabricar de esta manera el recubrimiento regular. Sin el añadido de un disolvente adecuado y en las cantidades necesarias no parece posible la constitución de un film estable, coherente y regular tal como es necesario, por ejemplo, para la constitución de un film que actúa de forma entérica y/o retardante y/o protectora o bien films cosméticos.
La utilización de disolventes tiene múltiples inconvenientes. Así, por ejemplo, los tiempos de proceso son prolongados, puesto que se debe separar el disolvente, en especial en sistemas basados en agua. En la utilización de disolventes orgánicos deben permanecer adicionalmente solamente hasta los pequeños límites de disolventes restantes, previstos por la Ley, en el preparado. La utilización de disolventes orgánicos es también dudosa desde el punto de vista de protección ambiental. Frecuentemente, las formas de medicamentos con recubrimiento son también inestables con respecto al disolvente. También, para otros procedimientos de recubrimiento tal como, por ejemplo, el recubrimiento libre de disolvente mediante “Hotmelt”, que es conocido, con una temperatura de proceso de más de 80º C, o mediante un procedimiento electrostático, obliga a contar con la inestabilidad del producto medicamentoso dotado de recubrimiento a causa del estrés térmico.
En la actualidad ha sido descubierto que la combinación de polímeros escogidos (en lo que sigue llamados también polímeros de recubrimiento) y productos plastificantes escogidos por otra, facilitan films de masa regular y coherentes sin añadidura de un disolvente para temperaturas de proceso reducidas y que son muy apropiados para recubrimiento o bien aplicación de film en sustancias sensibles, tales como núcleos farmacéuticos, y son muy apropiados para la fabricación libre de disolvente, entérica y/o retardante y /o protectora y/o cosmética en forma de films. Para ello es necesario, según la invención, para cada combinación de polímero de recubrimiento y producto plastificante determinar previamente las condiciones de temperatura y de tiempo óptimas para el recubrimiento, tal como se describe en detalle en este descubrimiento. Realizar estas medidas, según la invención, no representa problema alguna para el experto.
El procedimiento, según la invención, facilita tiempos de proceso muy cortos, un recubrimiento con film eficaz y seguro de los núcleos, especialmente de los productos medicamentosos que con respecto al disolvente son inestables. De esta forma, no se producen restos de disolvente en el producto medicamentoso ni emisiones perjudiciales para el medio ambiente del disolvente.
La presente invención está definida en las reivindicaciones. La presente invención se refiere a un procedimiento de recubrimiento en seco para sustratos sólidos, en especial para la fabricación de formas de administración farmacéuticas dotadas de recubrimiento, tales como productos medicamentosos, preferentemente para la fabricación de tabletas, microtabletas, soluciones sólidas, cápsulas y pastillas dotadas de recubrimiento, que se caracteriza porque
(i) se tienen en cuenta exclusivamente componentes de recubrimiento libres de disolventes para la utilización en el procedimiento, los cuales comprenden (a) como mínimo, un polímero de recubrimiento y (b) como mínimo, un producto plastificante que es líquido a la temperatura de recubrimiento;
(ii) ambos componentes (a) y (b) son aplicados separadamente sobre el núcleo en las relaciones de cantidades previamente determinadas y con los grosores de capa previamente determinados y serán mantenidos a la temperatura y tiempo previamente determinados para la formación de films coherentes en el tiempo suficiente hasta que sea constituido un film coherente; en el que
(iii) en polímero de recubrimiento se escoge entre el grupo que contiene derivados de celulosa, poliacrilato y derivados de polivinilo, y
(iv) el producto plastificante es escogido del grupo que contiene glicéridos de ácidos grasos acetilados, citratos, talatos, sebacatos, glicerina y derivados de glicerina, copolímeros de polioxietileno-polioxipropileno, propilenglicol y aceite de ricino.
Los componentes de recubrimiento pueden contener desde luego “otras sustancias auxiliares”, las cuales pueden ser “materiales auxiliares sólidos” o “materiales auxiliares líquidos”. Otros materiales auxiliares son, por ejemplo, aglomerantes, separadores/antiadhesivos, agentes de sabor y colorantes. Estos materiales auxiliares adicionales son conocidos en sí mismos.
Son ejemplos para medios aglomerantes HPMC, PVP, PVA, por ejemplo, en cuanto a medios separadores/medios antiadhesivos, son conocidos talco y siloides, ejemplos para agentes de sabor son conocidos son sabores sintéticos o naturales de naranja, limón, etcétera. Por ejemplo, en cuanto a colorantes, se dispone de sustancias de color naturales o sintéticas tales como cucurmina, lactoflovina, amarillo de quinolina o amaranto.
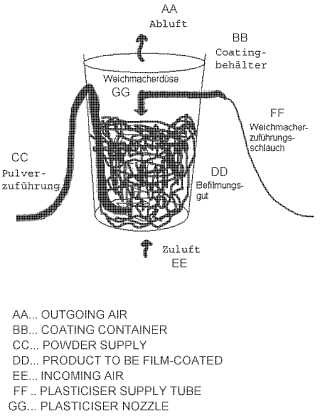
Los materiales auxiliares sólidos pueden ser añadidos separadamente, aparte del polímero de recubrimiento, o previamente pueden ser introducidos (compuestos) en el mismo. Preferentemente, los materiales auxiliares adicionales sólidos son preparados conjuntamente con el polímero de recubrimiento. Los otros materiales líquidos auxiliares adicionales son aplicados preferentemente con el plastificante, por ejemplo, mediante una tobera, sobre la superficie del sustrato, o bien, del núcleo, de manera que se tiene que tener en cuenta que la combinación del plastificante y de los otros materiales auxiliares adicionales sean líquidos a la temperatura del procedimiento.
Libre de disolvente, en el sentido de la presente invención, significa que como máximo el 20% en peso de disolvente, preferentemente como máximo, 15% en peso de disolvente, 10% en peso de disolvente, 5% en peso de disolvente, 2% en peso de disolvente, 1-1, 5% en peso de disolvente, referido de manera correspondiente al peso del comprimido, o bien del núcleo, es aplicado preferentemente de forma conjunta con el plastificante, o bien de forma separada, preferentemente al final del proceso de recubrimiento, a efectos de recubrimiento. Preferentemente, no se añadirán disolventes a los componentes de recubrimiento y no se aplicará ningún disolvente finalmente en el recubrimiento. El disolvente es preferentemente agua. El contenido natural de agua del polímero “seco” (habitualmente comercial) , o bien del plastificante “seco” no actúa como disolvente en el sentido de la presente invención.
Son derivados celulósicos preferentes éteres de celulosa y ésteres de celulosa, en especial, metilcelulosa (MC) , hidroxipropilmetilcelulosa (HPMC) , acetatoftalato de celulosa (CAP) , metilftalato de hidroxipropilmetilcelulosa (HPMCMP) , etilcelulosa (EC) , hidroxipropilcelulosa (HPC) , hidroxipropilmetilcelulosa (HPMC) , hidroxietilmetilcelulosa (HEC) , carboximetiletilcelulosa y sus sales (CMEC) , carboximetilcelulosa y sus sales (CMC) , hidroxietilcelulosa (HEC) , ftalato de hidroxipropilmetilcelulosa (HPMCP) , acetato succinato de hidroxipropilmetilcelulosa (HPMCAS) .
Son poliacrilatos preferentes o polímeros de ácido metacrílico, aminoalquilmetacrilatos, y copolímeros de metaril éster, tales como poli (acrilato de etilo, ácido metacrílico) (poli-MA-EA) , poli (metilmetacrilato, ácido metacrílico) [poli- (MA-MMA) ], poli[butilmetacrilato, (2-dimetilaminoetil) metacrilato, metilmetacrilato] [poli (BMA-DAEM-MMA) ], poli (acrilato de etilo, metacrilato de metilo, cloruro de trimetilaminoetilmetacrilato)... [Seguir leyendo]
Reivindicaciones:
1. Procedimiento para recubrimiento en seco, para sustratos sólidos, en especial para la fabricación de formas de administración farmacéutica dotadas de recubrimiento, caracterizado porque:
(i) se hace uso exclusivamente de componentes sin disolvente, que consisten en (a) como mínimo, un polímero de recubrimiento y (b) como mínimo, un plastificante que es líquido a la temperatura de recubrimiento;
(ii) ambos componentes (a) y (b) son aplicados separadamente sobre los núcleos en las proporciones de cantidad previamente determinadas y con los grosores de capa previamente determinados y con la temperatura y tiempo de aplicación previamente determinados para la formación de película coherente, manteniéndolos el tiempo suficiente hasta que se forma una película coherente; de manera que
(iii) el polímero de recubrimiento es seleccionado del grupo que contiene derivados de celulosa, poliacrilato y derivados de polivinilo, y
(iv) el plastificante es seleccionado del grupo que contiene glicéridos de ácidos grasos acetilados, citratos, ftalatos, sebacatos, glicerina y derivados de glicerina, copolímeros de polioxietileno-polioxipropileno, propilenglicoles y aceite de ricino, y
(v) se aplica un máximo de 20% de disolvente con respecto al peso del núcleo, con el plastificante o separadamente como recubrimiento.
2. Procedimiento, según la reivindicación 1, para la fabricación de formas de administración dotadas de recubrimiento con acción entérica y/o retardante y/o protectora y/o cosmética, preferentemente de tabletas dotadas de recubrimiento, microtabletas, soluciones sólidas, cápsulas y pastillas.
3. Procedimiento, según la reivindicación 1 ó 2, caracterizado porque los componentes de recubrimiento contienen otros excipientes seleccionados del grupo que contiene agentes aglomerantes, agentes separadores/antiadherentes, agentes de sabor y colorantes.
4. Procedimiento, según una de las reivindicaciones 1-3, caracterizado porque los agentes aglomerantes utilizados están constituidos preferentemente por HPMC, PVP o PVA; los agentes separadores/antiadhesivos están constituidos preferentemente por talco o siloides; los aditivos de sabor sintéticos o naturales están constituidos preferentemente por sabores de naranja, menta o limón, y los colorantes naturales o sintéticos están constituidos preferentemente por curcumina, lactoflavina, amarillo de quinolina o amaranto.
5. Procedimiento, según una de las reivindicaciones 1-4, caracterizado porque los demás excipientes sólidos son añadidos separadamente junto con el polímero de recubrimiento o son incorporados previamente y el resto de excipientes líquidos son aplicados junto con el plastificante a la superficie del sustrato.
6. Procedimiento, según una de las reivindicaciones 1-5, caracterizado porque un máximo de 15% en peso de disolvente, preferentemente agua, preferentemente un máximo de 10% en peso de disolvente, preferentemente un máximo de 5% en peso de disolvente, preferentemente un máximo de 2% en peso de disolvente, y preferentemente un máximo de 1-1, 5% en peso de disolvente, referidos en cada caso al peso del núcleo, son aplicados en el procedimiento de recubrimiento, con el plastificante o separadamente, para formar un recubrimiento, preferentemente al final del procedimiento de recubrimiento.
7. Procedimiento, según una de las reivindicaciones 1-5, caracterizado porque no se añade disolvente a los componentes de recubrimiento ni se aplica después del recubrimiento.
8. Procedimiento, según una de las reivindicaciones 1-7, caracterizado porque los derivados de celulosa son seleccionados del grupo que contiene éter de celulosa y éster de celulosa, preferentemente metilcelulosa (MC) , hidroxipropilmetilcelulosa (HPMC) , acetatoftalato de celulosa (CAP) , metilftalato de hidroxipropilmetilcelulosa (HPMC) , etilcelulosa (EC) , hidroxipropilcelulosa (HPC) , hidroxipropilmetilcelulosa (HPMC) , hidroxietilmetilcelulosa (HEC) , carboximetiletilcelulosa y sus sales (CMEC) , carboximetilcelulosa y sus sales (CMC) , hidroxietilcelulosa (HEC) , ftalato de hidroxipropilmetilcelulosa (HPMCP) , acetato succinato de hidroxipropilmetilcelulosa (HPMCAS) .
9. Procedimiento, según una de las reivindicaciones 1-7, caracterizado porque los poliacrilatos son seleccionados del grupo que contiene copolímeros del ácido metacrílico, aminoalquilmetacrilatos y copolímeros de éster metacrílico, preferentemente poli (etilacrilato, ácido metilacrílico) (poli-MA-EA) , poli (metilmetacrilato, ácido metacrílico) [poli- (MA-MMA) ], poli[butilmetacrilato, (2-dimetilaminoetil) metacrilato, metilmetacrilato] [poli (BMA-DAEM-MMA) ], poli (etilacrilato, metilmetacrilato, cloruro de trimetilamonioetilmetacrilato) [poli (EA-MMA-TAMCl) ] y poli (etilacrilato, metilmetacrilato) [poli (EA-MMA) ].
10. Procedimiento, según una de las reivindicaciones 1-7, caracterizado porque los derivados de polivinilo son seleccionados del grupo que contiene copolímeros de acetato de polivinilo y polivinilpirrolidona, preferentemente copolímero de acetato de vinilo-vinilpirrolidona (PVAc) , lactatoftalato de polivinilo (PVAP) y polivinilpirrolidona (PVP) .
11. Procedimiento, según una de las reivindicaciones 1-10, caracterizado porque los plastificantes son seleccionados del grupo que contiene glicéridos de ácidos grasos acetilados, preferentemente Myvacet K-9-45; citratos, preferentemente citrato de acetiltributilo (ATBC) , citrato de acetiltrietilo (ATEC) , citrato de tributilo (TBC) y citrato de trietilo (TEC) ; ftalatos, preferentemente dibutilftalato (DBP) , dietilftalato (DEP) y dimetilftalato (DMP) ;
sebacatos, preferentemente dietilsebacato (DES) y dibutilsebacato (DBS) ; glicerina; acetato de glicerina; y polietilenglicolpropoxilato.
12. Procedimiento, según una de las reivindicaciones 1-11, caracterizado porque se aplican 1-50 mg/cm2 de polímero de recubrimiento, preferentemente 4-25 mg/cm2 y la proporción en peso de plastificante al polímero de 10 recubrimiento es de 1:50 a 1:1, preferentemente 1:40 a 2:5.
13. Procedimiento, según una de las reivindicaciones 1-12, caracterizado porque la proporción en peso de la suma de los demás excipientes con respecto al polímero de recubrimiento es de 1:50 a 1:1, preferentemente 1:40 a 2:5.
14. Procedimiento, según una de las reivindicaciones 1-12, caracterizado porque la temperatura de los componentes de recubrimiento en su aplicación a los núcleos se encuentra en el rango d.
4. 70ºC, preferentemente en un rango d.
5. 65ºC, preferentemente e.
5. 60ºC.
15. Procedimiento, según una de las reivindicaciones 1-14, caracterizado porque la temperatura de los núcleos a recubrir en el lecho fluidizado se encuentra en el rango d.
2. 55ºC, preferentemente en el rango d.
4. 55ºC y en especial en el rango d.
4. 50ºC.
16. Procedimiento, según una de las reivindicaciones 1-15, caracterizado porque el recubrimiento, después de la aplicación de la cantidad total de añadido, se deja a la temperatura de aplicación durante un tiempo de 30 minutos a 25 120 minutos, preferentemente 60 minutos a 90 minutos.
17. Procedimiento, según una de las reivindicaciones 1-16, caracterizado porque las proporciones de cantidades optimizadas para los componentes requeridos para la etapa (ii) , según la reivindicación 1, el grosor de recubrimiento de formación y la temperatura óptima y duración para la formación de película coherente, o el procedimiento para la producción de la muestra y determinación de MVT, son determinados antes de la aplicación del material para determinar la temperatura mínima de formación de película y el tiempo mínimo de formación de película.
Patentes similares o relacionadas:
Nanopartículas de circulación prolongada para la liberación sostenida de agentes terapéuticos, del 26 de Febrero de 2020, de PFIZER INC.: Una composición de nanopartículas biocompatibles que comprende una pluralidad de nanopartículas de circulación prolongada, comprendiendo cada una: copolímero […]
Preparación farmacéutica que comprende un derivado de fenilalanina, del 20 de Noviembre de 2019, de EA Pharma Co., Ltd: Una preparación farmacéutica que comprende el compuesto representado por la fórmula química (A) o una sal farmacéuticamente aceptable del mismo, […]
Formulaciones farmacéuticas estables que contienen un antihistamínico, del 16 de Abril de 2019, de LABORATORIOS LESVI, S.L.: Composición farmacéutica estable oral sólida de desloratadina, caracterizada porque comprende un núcleo de comprimido que contiene: i) desloratadina […]
Formulación para el control de piojos y garrapatas en el ganado, del 27 de Febrero de 2019, de Elanco US Inc: Una formulación para su uso en el control de piojos o garrapatas en el ganado, incluyendo dicha formulación una cantidad eficaz de una composición sistémicamente activa […]
Tableta entérica, del 30 de Enero de 2019, de TAKEDA PHARMACEUTICAL COMPANY LIMITED: Una tableta entérica que comprende: 1) una tableta núcleo compuesta de 4-[2-(4-metilfenilsulfanil) fenil]piperidina o una de sus sales, y 2) […]
Polímeros de unión a ion y usos de los mismos, del 30 de Enero de 2019, de RELYPSA, INC: Uso de un polímero de unión a potasio que tiene grupos ácidos seleccionados de entre el grupo que consiste en grupos sulfónico (-SO3-), sulfúrico […]
Agente de recubrimiento para una preparación sólida farmacéutica, formulación de película farmacéutica y preparación sólida farmacéutica recubierta, del 30 de Enero de 2019, de TORAY INDUSTRIES, INC.: Agente de recubrimiento para una preparación sólida farmacéutica, que comprende un polietilenglicol que tiene un peso molecular promedio de 950 a 25.000 y una arcilla expansiva […]
Formas farmacéuticas de multimicropartículas que resisten a la descarga inmediata del principio activo en presencia de alcohol, del 3 de Diciembre de 2018, de Flamel Ireland Limited: Forma farmacéutica o dietética oral que comprende micropartículas de tipo depósito de liberación prolongada de al menos un principio activo (PA) y al […]