Procedimiento para la preparación de nebivolol.
Procedimiento para la preparaciáon del compuesto nebivolol en forma de mezcla racémica de los dos enantiómeros [2S[2R[R[R]]]]-α
,α'-[imino-bis(metilén)]bis[6-fluoro-cromán-2-metanol] y [2R[2S[S[S]]]]-α,α'-[imino-bis(metilén)]bis[6-fluoro-cromán-2-metanol], que presentan las fórmulas siguientes: **Fórmula**
que comprende las etapas siguientes:
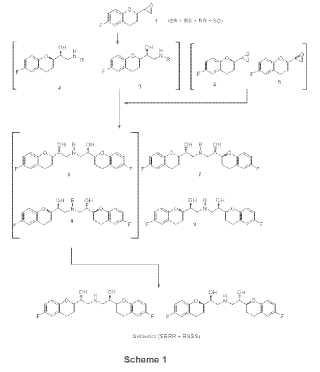
a. hacer reaccionar una mezcla de los cuatro isómeros SR, RS, RR y SS del epóxido de fórmula (1): **Fórmula**
con una amina R-NH2, en la que R es un grupo protector seleccionado de entre metilo, alilo, t-butilo, bencilo, difenilmetilo, trifenilmetilo, fluorenilo, 9,1-dihidroantracén-9-ilo, dibencilo, en los que los anillos aromáticos posiblemente pueden mono- o di-sustituirse con un grupo seleccionado de entre: halógeno, nitro, una cadena de alquilo C1-C4, CF3, CHF2, un grupo OR2 en el que R2 es un hidrógeno, un alquilo C1-C4, en un solvente representado por un alcohol estéricamente restringido seleccionado de entre iPrOH, sec-BuOH, terc-BuOH, isoamilo, 2-metil-2-butanol, 2-metil-2-pentanol, utilizado solo o en una mezcla con un solvente apolar seleccionado de entre el grupo de éter de petróleo, pentano, hexano, ciclohexano, metilciclohexano, heptano, benceno y tolueno, con el fin de obtener una mezcla de los cuatro compuestos 2, 3, 4 y 5, de la que la pareja 2/3 se separa de la pareja 4/5, **Fórmula**
b. haciendo reaccionar las aminas 2 y 3, en una mezcla, con la pareja de epóxidos 4 y 5, en una mezcla, con el fin de obtener una mezcla de 4 compuestos (6, 7, 8 y 9), **Fórmula**
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2011/051876.
Solicitante: MENARINI INTERNATIONAL OPERATIONS LUXEMBOURG S.A..
Inventor/es: FATTORI, DANIELA, BARTOLI,SANDRA, CIPOLLONE,AMALIA.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07D311/58 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 311/00 Compuestos heterocíclicos que contienen ciclos de seis miembros que contienen un átomo de oxígeno como único heteroátomo, condensados con otros ciclos. › con sustituyentes diferentes a los átomos de oxígeno o azufre en las posiciones 2 ó 4.
PDF original: ES-2445543_T3.pdf
Fragmento de la descripción:
Procedimiento para la preparación de nebivolol
CAMPO DE LA INVENCIÓN
La presente invención se refiere a un nuevo procedimiento para la síntesis de nebivolol. El nebivolol es una mezcla racémica de los dos enantiómeros [2S[2R[R[R]]]] α, α’-[imino-bis (metilén) ]bis[6-fluoro-cromán-2-metanol] y [2R[2S[S[S]]]]-α, α’-[imino-bis (metilén) ]bis[6-fluoro-cromán-2-metanol] (Esquema 2)
En particular, se informa que la resolución cinética de las dos parejas diastereoisoméricas de los epóxidos RS/SR y SS/RR (Esquema 1, mezcla 1) mediante el tratamiento con una amina en un solvente adecuado.
ESTADO DE LA TÉCNICA
El nebivolol es conocido como un antagonista adrenérgico de receptores beta, un agente antihipertensivo, un inhibidor de la agregación plaquetaria y un agente vasodilatador.
El nebivolol presenta propiedades básicas y puede convertirse en una forma de sal farmacéutica aceptable mediante el tratamiento con un ácido. La sal hidrocloruro es la forma comercializada.
El nebivolol contiene cuatro centros asimétricos y por lo tanto son teóricamente posibles 16 estereoisómeros. Sin embargo, debido a la particular estructura de la molécula (la presencia de un eje de simetría) , en la práctica sólo pueden formarse 10 estereoisómeros (Esquema 3) .
De hecho, debido a la simetría de la molécula, RSSS = SSSR, RRSS = SSRR, SRSS = SSRS, RRSR = RSRR, SRSR = RSRS y RRRS = SRRR.
La patente US nº 4.654.362 (patente EP nº 0145067, Janssen) describe la preparación de nebivolol mediante la utilización de isómeros epóxido (Esquema 1, mezcla 1: RS, SR, RR y SS) como intermediarios clave en la síntesis. Estos se separan, con una columna cromatográfica, en los dos racematos epóxido (RS/SR) y (RR/SS) .
La patente EP nº 334429 (Janssen) describe el mismo procedimiento informado en la patente EP nº 0145067, aunque con más datos experimentales. La patente EP nº 0334449 describe una síntesis estereoselectiva del isómero [2R, αS, 2’S, α’S]-α, α’-[iminobis (metilén) ]bis[6-fluoro-3, 4-dihidro-2H-1-benzopirán-2-metanol].
El documento WO nº 2006/016373 (Hetero Drugs Limited) describe métodos de cristalización fraccionada aplicados al nivel de la mezcla diastereoisomérica de bencil-nebivolol en forma de sal hidrocloruro, pero no contiene enseñanza alguna sobre métodos de apertura o separación de epóxidos.
Además, el documento WO nº 2006/025070 (Torrent Pharmaceutical) se mantiene en la síntesis clásica descrita por la patente US nº 4.654.362 y meramente introduce un método de separación de las parejas diastereoisoméricas al nivel del bencilnebivolol en la forma de sal hidrocloruro. En el documento WO nº 2007/083318 posterior se reivindica la utilización de éter diisopropílico para la cristalización del intermediario bencil-nebivolol en forma de base libre.
El documento WO nº 2007/041805 (Egis Gyógyszergyár) describe un procedimiento para la preparación de [2S*[R*[R*[R*]]]] y [2R* [S*[S*[S*]]]]- (6) -α, α’-[iminobis (metilén) ]bis[6-fluoro-3, 4-dihydro-2H-1-benzopirán-2-metanol] y sus enantiómeros individuales puros [2S*[R*[R*[R*]]]] y [2R*[S*[S*[S*]]]].
En los documentos WO nº 2008/010022 (Cimex Pharma) y nº 2008/064826 (Zach System) , se proporcionan otros métodos sintéticos, en los que, sin embargo, deben utilizarse procedimientos más o menos complejos de separación de isómeros.
El documento WO nº 2008/064827 describe la síntesis separada y enantioselectiva de d- e I-nebivolol.
Según la literatura disponible hasta la actualidad, la síntesis de nebivolol todavía entraña numerosos problemas sintéticos. La síntesis de Janssen original que pasa por epóxidos (Esquema 1, mezcla 1) seguramente es la más corta, pero requiere una separación mediante HPLC preparativa de las dos parejas diastereoisoméricas de epóxido. Los demás métodos generalmente contemplan muchas más etapas sintéticas.
Por lo tanto, se percibe marcadamente una necesidad de desarrollo de un nuevo procedimiento sintético adecuado para el uso industrial y que posiblemente evite la utilización de HPLC preparativa, aunque manteniendo un número limitado de etapas sintéticas.
DESCRIPCIÓN RESUMIDA DE LA INVENCIÓN
Ahora inesperadamente se ha encontrado un procedimiento más eficaz para la síntesis de nebivolol, que se resumen en el Esquema 1. Este procedimiento permite eliminar las desventajas subrayadas en la presente memoria para las vías de síntesis conocidas previamente, es decir,
a) evita la separación mediante HPLC preparativa de las parejas (4RR/SS RS/SR) de enantiómeros epóxidos) .
b) No contempla la síntesis separada y paralela de los diversos enantiómeros. La reacción de la mezcla 1 con una amina en alcoholes primarios tales como metanol, etanol, propanol, etc. se produce rápida y limpiamente,
aunque prácticamente sin ninguna diastereoselectividad, es decir, las dos parejas de epóxidos contenidas en 1,
(SR + RS) y (RR + SS) muestran velocidades de reacción muy similares. Según los estudios informados en la literatura [Can. J. Chem. 45:1597-1600, 1967] aparentemente la función del alcohol en la apertura de los epóxidos por una amina no es meramente la de un solvente, sino también la de proporcionar catálisis ácida.
Mediante estudios de análisis conformacional los presentes solicitantes pudieron demostrar que los dos epóxidos presentan diferentes preferencias de conformación. En consecuencia, una interacción específica con un alcohol puede verse influida por la restricción estérica del alcohol mismo. Inesperadamente, los presentes solicitantes demostraron que mediante la utilización de alcoholes estéricamente restringidos, resulta modificada la cinética de la reacción de apertura de epóxidos 1 por aminas, de manera que la reacción es selectiva para uno de los dos epóxidos. Este tipo de resolución cinética puede obtenerse también con otros nucleófilos nitrogenados, tales como amonio, el ión azida (N3-) y las hidroxilaminas.
El epóxido restante y el producto de la apertura muestran características físicoquímicas muy diferentes, permitiendo una fácil separación de los mismos extractivamente, cromatográficamente o mediante cristalización.
Por lo tanto, el objetivo de la presente invención es un procedimiento para la preparación de nebivolol, comprendiendo el procedimiento:
a. hacer reaqccionar la mezcla de epóxidos 1 (RS, SR, RR y SS) de fórmula:
con una amina R-NH2, en la que:
- R es un grupo protector seleccionado de entre metilo, alilo, t-butilo, bencilo, difenilmetilo, trifenilmetilo, fluorenilo, 9, 10-dihidroantracén-9-ilo, dibencilo, en los que los anillos aromáticos presentes en los grupos posiblemente pueden mono- o di-sustituirse con un grupo seleccionado de entre: halógeno, nitro, una
cadena alquilo C1-C4, CF3, CHF2, un grupo OR2, en el que R2 es un hidrógeno, un alquilo C1-C4, y preferentemente un grupo bencilo,
en un solvente adecuado representado por un alcohol estéricamente restringido, solo o en una mezcla con un solvente apolar, con el fin de obtener una mezcla de los cuatro compuestos 2, 3, 4 y 5, a partir de la cual se separa 20 la pareja 2/3 de la pareja 4/5,
b. haciendo reaccionar las aminas 2 y 3, en mezcla, con la pareja de epóxidos 4 y 5, en mezcla, con el fin de obtener una mezcla de 4 compuestos (6, 7, 8 y 9) ,
c. separar 6 y 8 (RSSS + SRRR) en mezcla, de 7 y 9 mediante cristalización fraccionada, con un primer solvente
seleccionado de entre etanol, propanol, isopropanol, terc-butanol, 2-metil-2-butanol (preferentemente 2-metil-2butanol) y posteriormente con una mezcla de un solvente aprótico polar seleccionado de entre acetato de etilo, acetato de metilo, acetato de isopropilo, acetona, metil-etil-cetona y un solvente apolar seleccionado de entre pentano, hexano, ciclohexano, metilciclohexano, heptano, benceno, tolueno (preferentemente una mezcla de acetato de etilo/ciclohexano) .
d. eliminar el grupo protector R, con la formación concomitante o posterior de la sal hidrocloruro.
A modo de alternativa, puede llevarse a cabo la reacción descrita en el punto a., mediante:
e. la reacción de la mezcla de epóxidos 1 con amonio o el ión azida, seguido, en el caso de la azida, de la reducción (Esquema 7) ,
f. la separación de la amina primaria de los epóxidos 4/5 mediante extracción en un solvente adecuado o mediante cromatografía,
g. la realización de una aminación reductora de las aminas 10/11 con un aldehído R1CHO, en el que R1 es H, vinilo, fenilo, fenilo mono- o di-sustituido... [Seguir leyendo]
Reivindicaciones:
1. Procedimiento para la preparaciáon del compuesto nebivolol en forma de mezcla racémica de los dos enantiómeros [2S[2R[R[R]]]]-α, α’-[imino-bis (metilén) ]bis[6-fluoro-cromán-2-metanol] y [2R[2S[S[S]]]]-α, α’-[iminobis (metilén) ]bis[6-fluoro-cromán-2-metanol], que presentan las fórmulas siguientes:
que comprende las etapas siguientes:
a. hacer reaccionar una mezcla de los cuatro isómeros SR, RS, RR y SS del epóxido de fórmula (1) :
con una amina R-NH2, en la que R es un grupo protector seleccionado de entre metilo, alilo, t-butilo, bencilo, difenilmetilo, trifenilmetilo, fluorenilo, 9, 1-dihidroantracén-9-ilo, dibencilo, en los que los anillos aromáticos posiblemente pueden mono- o di-sustituirse con un grupo seleccionado de entre: halógeno, nitro, una cadena de alquilo C1-C4, CF3, CHF2, un grupo OR2 en el que R2 es un hidrógeno, un alquilo C1-C4, en un solvente representado por un alcohol estéricamente restringido seleccionado de entre iPrOH, sec-BuOH, terc-BuOH,
isoamilo, 2-metil-2-butanol, 2-metil-2-pentanol, utilizado solo o en una mezcla con un solvente apolar seleccionado de entre el grupo de éter de petróleo, pentano, hexano, ciclohexano, metilciclohexano, heptano, benceno y tolueno, con el fin de obtener una mezcla de los cuatro compuestos 2, 3, 4 y 5, de la que la pareja 2/3
b. haciendo reaccionar las aminas 2 y 3, en una mezcla, con la pareja de epóxidos 4 y 5, en una mezcla, con el fin de obtener una mezcla de 4 compuestos (6, 7, 8 y 9) ,
c. separar los compuestos 6 y 8 (RSSS + SRRR) en mezcla, de 7 y 9 mediante cristalización fraccionada, con un primer solvente seleccionado de entre etanol, isopropanol, butanol, terc-butanol, 2-metil-2-butanol y posteriormente con una mezcla de un solvente aprótico polar seleccionado de entre acetato de metilo, acetato de
etilo, acetato de isopropilo, acetona, metil-etil-cetona, acetonitrilo, éter isopropílico, con un solvente apolar seleccionado de entre pentano, hexano, ciclohexano, metilciclohexano, heptano, benceno y tolueno,
d. eliminar el grupo protector R, y opcionalmente formar después la sal hidrocloruro, con el fin de obtener el producto final nebivolol o hidrocloruro de nebivolol.
3. Procedimiento según la reivindicación 1, en el que las aminas 2 y 3 se separan de los epóxidos 4 y 5 mediante precipitación y filtración.
5. Procedimiento según la reivindicación 1, en el que el solvente apolar, definido en el punto (a) , es ciclohexano.
6. Procedimiento según la reivindicación 1, en el que los solventes para la cristalización fraccionada definidos en el punto c) son 2-metil-2-butanol y posteriormente una mezcla de acetato de etilo/ciclohexano.
7. Procedimiento según la reivindicación 1, que comprende, a modo de alternativa a la etapa sintética descrita 25 en el punto a) , las etapas siguientes:
e. hacer reaccionar la mezcla de SR, RS, RR y SS de epóxido 1 con amonio o con una azida, seguido de, en el caso de la azida, la reducción para formar la amina primaria correspondiente:
f. la separación de la amina primaria de los epóxidos 4/5 mediante extracción en un solvente adecuado o mediante cromatografía,
g. llevar a cabo una aminación reductora de las aminas 10/11 con un aldehído R1CHO, en el que R1 se
selecciona de entre el grupo: H, vinilo, fenilo, fenol mono- o di-sustituido con un grupo seleccionado de entre: halógeno, nitro, cadena alquilo C1-C4, CF3, CHF2, OR2, en el que R2 es un hidrógeno, un alquilo C1-C4, con el fin de obtener la mezcla de aminas 2/3.
8. Procedimiento según la reivindicación 7, en el que R1 es un grupo fenilo.
9. Procedimiento según la reivindicación 7, que comprende, a modo de alternativa a la etapa sintética descrita en el punto e., la etapa siguiente:
h. hacer reaccionar la mezcla de SR, RS, RR y SS del epóxido 1 con hidroxilamina, seguido de la hidrogenación 45 del enlace N-O y la obtención de las aminas 10/11.
10. Procedimiento según la reivindicación 1, que comprende, como alternativa parcial al punto a., tras la reacción de la amina RNH2 con la mezcla de SR, RS, RR y SS del epóxido, las etapas siguientes:
k. eliminación del exceso de amina RNH2 no reaccionada,
i. se añade un solvente alcohólico seleccionado de entre metanol o etanol, y se deja que los compuestos 2/3 reaccionen directamente con los compuestos 4/5 tal como se contempla en el punto b.
11. Procedimiento según la reivindicación 1, que comprende, a modo de alternativa parcial al punto a., las etapas siguientes:
m. la mezcla SR, RS, RR y SS del epóxido 1 se hace reaccionar con una amina secundaria del tipo RR3NH, en la que R presenta el significado indicado anteriormente, y R3 es un grupo bencilo, posiblemente mono- o disustituido con un grupo seleccionado de entre: halógeno, nitro, una cadena de alquilo C1-C4, CF3, CHF2, un grupo OR2, en el que R2 es un hidrógeno, un alquilo C1-C4, con el fin de obtener una mezcla de los cuatro compuestos 12, 13, 4 y 5, a partir de la que se separa la pareja 12/13 de la pareja 4/5,
n. eliminación del grupo R3, con el fin de obtener una mezcla de los compuestos 2/3.
12. Procedimiento según la reivindicación 11, en el que R3 es un grupo bencilo.
13. Procedimiento según la reivindicación 1, en el que la desprotección contemplada en el punto d. se lleva a cabo mediante hidrogenación catalítica con Pd (OH) 2.
Patentes similares o relacionadas:
Derivado de urea o sal farmacológicamente aceptable del mismo, del 8 de Abril de 2020, de KYORIN PHARMACEUTICAL CO., LTD.: Un compuesto representado por la fórmula general (I) o un hidrato, un solvato o una sal farmacológicamente aceptable del mismo: **(Ver fórmula)** […]
Compuestos isoflavonoides y métodos para el tratamiento del cáncer, del 8 de Enero de 2020, de MEI Pharma, Inc: Una composición farmacéutica que comprende 3-(4-hidroxifenil)-4-(4-hidroxifenil)-8-metilcroman-7-ol: **(Ver fórmula)** en la que los […]
Composiciones de isoflavonoides y procedimientos para el tratamiento del cáncer, del 8 de Enero de 2020, de MEI Pharma, Inc: Composición farmacéutica que comprende: i) un compuesto de fórmula (II) o una sal farmacéuticamente aceptable del mismo: **(Ver fórmula)** en la que: […]
Derivado de cromano, del 31 de Julio de 2019, de TMS Co., Ltd: Un derivado de cromano que es un compuesto representado por la siguiente Fórmula (Ia):**Fórmula** donde, en la Formula (Ia), cada una de las Y1 […]
(6R,10R)-6,10,14-Trimetilpentadecan-2-ona preparada a partir de 6,10-dimetilundec-5-en-2-ona o 6,10-dimetilundeca-5,9-dien-2-ona, del 24 de Julio de 2019, de DSM IP ASSETS B.V.: Un proceso de fabricación de (6R,10R)-6,10,14-trimetilpentadecan-2-ona en una síntesis de múltiples etapas a partir de 6,10-dimetilundec-5-en-2-ona o 6,10-dimetilundeca-5,9-dien-2-ona […]
Compuestos de cromano sustituidos como moduladores de receptores sensores de calcio, del 12 de Junio de 2019, de LUPIN LIMITED: Un compuesto que tiene la Fórmula (V):**Fórmula** o una de sus sales farmacéuticamente aceptables; en la que, R1 se selecciona entre halógeno, alquilo […]
Agentes de contraste para obtención de imágenes de perfusión miocárdica, del 12 de Junio de 2019, de LANTHEUS MEDICAL IMAGING, INC: Un agente de contraste que tiene la fórmula:**Fórmula** en donde n, m, yo son independientemente 1, 2, 3 o 4; Z es O, S o NR46; R45 es alquilo […]
Un nuevo método de producción de clorhidrato de nebivolol de alta pureza, del 4 de Junio de 2019, de Corden Pharma International GmbH: Un procedimiento de producción de clorhidrato de nebivolol de fórmula I,**Fórmula** que comprende las etapas de: a. proporcionar un clorhidrato de nebivolol […]