PROCEDIMIENTO PARA LA FABRICACION DE INTERMEDIARIOS EPOXIBUTANOL.
Procedimiento para la preparación de un compuesto de fórmula (I):
** ver fórmula** en la que, Hal representa flúor o cloro, y R 1 y R 2 representan, independientemente, hidrógeno o uno de los significados de Hal, en el que un compuesto de fórmula (II): ** ver fórmula** se convierte en un éster de ácido alquilsulfónico, fluoroalquilsulfónico o arilsulfónico correspondiente, que seguidamente se hace reaccionar con un nitrito de metal alcalino en presencia de un éter corona adecuado en un solvente no nucleofílico polar a una temperatura comprendida entre -10ºC y 50ºC, proporcionando el compuesto de fórmula (I)
Tipo: Resumen de patente/invención. Número de Solicitud: W06000671CH.
Solicitante: BASILEA PHARMACEUTICA AG.
Nacionalidad solicitante: Suiza.
Dirección: GRENZACHERSTRASSE 487,4005 BASEL.
Inventor/es: MULLER, MARC, XU, LIN.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07D309/12 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 309/00 Compuestos heterocíclicos que contienen ciclos de seis miembros que tienen un átomo de oxígeno como único heteroátomo del ciclo, no condensados con otros ciclos. › solamente átomos de hidrógeno y un átomo de oxígeno directamente unidos a los átomos de carbono del ciclo, p. ej. éteres tetrahidropiranilo.
Clasificación PCT:
- A61K31/336 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › teniendo ciclos de tres eslabones, p. ej. oxirano, fumagilina.
- C07D303/08 C07D […] › C07D 303/00 Compuestos que contienen ciclos de tres miembros que tienen un átomo de oxígeno como único heteroátomo del ciclo. › con radicales hidrocarbonados sustituidos por átomos de halógeno, radicales nitro o nitroso.
Fragmento de la descripción:
Procedimiento para la fabricación de intermediarios epoxibutanol.
La presente invención se refiere a un procedimiento para la fabricación de derivados (2R,3R)-3-(halogenofenil)-3,4-epoxi-2-butanol que resultan útiles en la síntesis de compuestos antifúngicos azol tales como, por ejemplo, (1R,2R)-4-[2-[2-(2,4-difluorofenil)-2-hidroxi-1-metil-3-[1,2,4]triazol-1-il-propil]-tiazol-4-il]-benzonitrilo o, en particular, (1R,2R)-4-[2-[2-(2,5-difluorofenil)-2-hidroxi-1-metil-3-[1,2,4]triazol-1-il-propil]-tiazol-4-il]-benzonitrilo (BAL4815) y a un procedimiento para fabricar dichos compuestos antifúngicos azol utilizando el procedimiento anteriormente indicado.
Son conocidos de la técnica procedimientos para la preparación de derivados (2R,3R)-3-(halogenofenil)-3,4-epoxi-2-butanol. Los procedimientos conocidos habitualmente parten de ácido R-láctico o ácido D-(-)-láctico, que son bastante caros. Por ejemplo, el documento US nº 2003/0236419 A1 da a conocer un procedimiento para fabricar (2R,3R)-3-(2',4'-difluorofenil)-3,4-epoxi-2-butanol, en el que se convierte D-metil-lactato en (2R)-2',4'-difluoro-2-hidroxi-propiofenona, que seguidamente se hace reaccionar con bromuro de trimetiloxosulfonio/hidruro sódico, proporcionando una mezcla 12:1 de (2R,3R)-3-(2',4'-difluorofenil)-3,4-epoxi-2-butanol y el compuesto (2R,3S) correspondiente. Se describe una reacción similar en la patente WO nº 99/45008 para la fabricación de (2R,3R)-3-(2',5'-difluorofenil)-3,4-epoxi-2-butanol.
El documento WO nº 9952840 A1, por otra parte, da a conocer la utilización del ácido S-láctico (ácido L-(+)-láctico), que es mucho menos caro, en lugar de ácido R-láctico como el material de partida básico para los derivados (2R,3R)-3-(2',4'-dihalogenofenil)-3,4-epoxi-2-butanol. Sin embargo, resulta necesario modificar la configuración del átomo de carbono nº 2 del esqueleto butanol durante el curso de dicho procedimiento para llegar a la configuración R deseada en dicho átomo de carbono. Lo anterior se consigue según el documento WO nº 9952840 A1 mediante la bien conocida reacción de Mitsunobu, en la que el intermediario (2S,3R)-3-(2',4'-dihalogenofenil)-3,4-epoxi-2-butanol se hace reaccionar con ácido p-nitrobenzoico en presencia de trifenilfosfina y dietilazodicarboxilato (DEAD), proporcionando éster de ácido (2R,3R)-3-(2',4'-dihalogenofenil)-3,4-epoxi-2-butanol p-nitrobenzoico, que después se saponifica, formando el derivado butanol correspondiente.
Sin embargo, dicha etapa de reacción de Mitsunobu presenta varias desventajas, en particular en el caso de que deba aplicarse a una escala técnica. Proporciona sólo rendimientos insatisfactorios del derivado (2R,3R) deseado, produce una cantidad inaceptable de residuos y dicha etapa de procedimiento resulta escalable sólo con dificultad, en caso de resultar posible, debido a que surgen problemas sustanciales durante la purificación del producto a escalas mayores.
En particular, si se aplican las condiciones clásicas de Mitsunobu, dadas a conocer en el documento WO nº 9952840 A1 en relación a la fabricación de (2R,3R)-3-(2',4'-difluorofenil)-3,4-epoxi-2-butanol, al análogo 2',5'-difluoro respectivo, únicamente puede obtenerse un rendimiento insatisfactorio de sólo aproximadamente 50%. Además, el exceso enantiomérico observado sólo es de aproximadamente 90%, por lo tanto no se consigue una reversión completa de la conversión.
Sin embargo, ahora se ha encontrado que, por el contrario, la utilización de una alternativa específica de la etapa de Mitsunobu en la fabricación de (2R,3R)-3-(halogenofenil)-3,4-epoxi-2-butanol proporciona rendimientos mucho mejores, y no presenta las desventajas asociadas a dicha etapa de reacción.
Por lo tanto, un primer objetivo de la presente invención es un procedimiento para la preparación de un compuesto de fórmula (I):
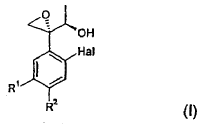
en la que,
Hal representa flúor o cloro, y
R1 y R2 representan, independientemente, hidrógeno, o presentan uno de los significados de Hal,
convirtiendo en dicho procedimiento un compuesto de fórmula (II):
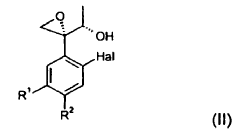
en un éster alquilsulfónico, fluoroalquilsulfónico o arilsulfónico, que seguidamente se hace reaccionar con un nitrito de metal alcalino en un solvente no nucleofílico polar a una temperatura de entre -10ºC y 50ºC y en presencia de un éter corona adecuado, proporcionando el compuesto que presenta la fórmula (I).
Entre los ésteres de ácido alquilsulfónico o arilsulfónico adecuados se incluyen, por ejemplo, éster de ácido p-toluensulfónico, éster de ácido metilsulfónico y, en particular, éster de ácido trifluorometilsulfónico. La conversión del compuesto de fórmula (II) en los ésteres de ácido alquilsulfónico o arilsulfónico correspondientes puede conseguirse de una manera conocida per se, por ejemplo haciendo reaccionar el compuesto que presenta la fórmula (II) con un haluro de ácido alquilsulfónico o arilsulfónico, por ejemplo el cloruro, o preferentemente el anhídrido, en presencia de una base tal como, por ejemplo, piridina, preferentemente a temperaturas comprendidas entre -10ºC y 50ºC, más preferentemente entre -10ºC y 10ºC, por ejemplo a 0ºC, en un solvente no polar tal como, por ejemplo, cloruro de metileno. La proporción entre el derivado ácido alquilsulfónico o arilsulfónico, por ejemplo el haluro o anhídrido respectivo, en particular el anhídrido de ácido trifluorometilsulfónico, y el compuesto de fórmula (II) preferentemente se encuentra comprendido entre 1:1 y 3:1, más preferentemente entre 1,5:1 y 2,5:1. La base, por ejemplo piridina, se utiliza en aproximadamente las mismas cantidades que el derivado ácido alquilsulfónico o arilsulfónico. Los tiempos de reacción adecuados se encuentran comprendidos entre aproximadamente 15 minutos y varias horas, por ejemplo 10 horas, preferentemente entre 1 y 3 horas.
Tras la purificación opcional del producto de reacción y/o la eliminación del solvente, el éster de ácido alquilsulfónico, fluoroalquilsulfónico o arilsulfónico del compuesto de fórmula (II) se disuelve en un solvente no nucleofílico polar tal como, por ejemplo, dimetilsulfóxido (DMSO), N,N-dimetilformamida (DMF), 1,3-dimetil-3,4,5,6-tetrahidro-2(1H)-pirimidinona (DMPU), tetrahidrofurano (THF), dioxano o formamida, y se hace reaccionar con un exceso de un nitrito de metal alcalino, por ejemplo nitrito de sodio, potasio o cesio, en presencia de un éter corona adecuado como catalizador.
Preferentemente se utiliza un exceso de dos a diez veces del nitrito de metal alcalino, más preferentemente un exceso de cuatro a seis veces. Los éteres corona adecuados pueden ser fácilmente seleccionados por el experto en la materia, dependiendo principalmente de qué nitrito de metal alcalino se aplique, y entre ellos se incluyen 18-corona-6-éter, 15-corona-5-éter, 12-corona-4-éter. Resulta especialmente preferente 18-corona-6-éter, en particular al utilizarlo con nitrito de potasio. Tal como se ha indicado, se utiliza en cantidades catalíticas, por ejemplo en una cantidad comprendida entre un milésimo y un décimo de la cantidad molar del nitrito de metal alcalino. La reacción preferentemente se lleva a cabo a una temperatura comprendida entre 10ºC y 30ºC, más preferentemente a una temperatura comprendida entre 15ºC y 25ºC, por ejemplo a temperatura ambiente.
Tras completar la reacción, la mezcla preferentemente se trata con hidróxido sódico acuoso diluido, preferentemente durante un periodo de tiempo de aproximadamente una hora. A continuación, el compuesto preferentemente se extrae con un solvente o mezcla de solventes apropiado. Entre los solventes utilizados se incluyen, por ejemplo, acetato de etilo, alcanos C5-8 lineales o ramificados, acetato de metilo, acetato de etilo, que resulta especialmente preferente, acetato de propilo y éteres dialquílicos simétricos o asimétricos, los grupos alquilo de los cuales comprenden entre 1 y 5 átomos de carbono. Tras la extracción y lavado apropiados (solución hipersalina), el compuesto (I) puede utilizarse sin modificación, directamente sin necesidad de purificación adicional.
De acuerdo con lo anteriormente expuesto, entre las realizaciones particularmente preferentes del procedimiento según la presente invención se incluye un procedimiento tal como se ha descrito anteriormente,...
Reivindicaciones:
1. Procedimiento para la preparación de un compuesto de fórmula (I):

en la que,
Hal representa flúor o cloro, y
R1 y R2 representan, independientemente, hidrógeno o uno de los significados de Hal,
en el que un compuesto de fórmula (II):

se convierte en un éster de ácido alquilsulfónico, fluoroalquilsulfónico o arilsulfónico correspondiente, que seguidamente se hace reaccionar con un nitrito de metal alcalino en presencia de un éter corona adecuado en un solvente no nucleofílico polar a una temperatura comprendida entre -10ºC y 50ºC, proporcionando el compuesto de fórmula (I).
2. Procedimiento según la reivindicación 1, en el que dicho éster de ácido alquilsulfónico o arilsulfónico es el éster de ácido trifluorometilsulfónico.
3. Procedimiento según la reivindicación 1 ó 2, en el que el nitrito de metal alcalino es nitrito de sodio o de potasio.
4. Procedimiento según cualquiera de las reivindicaciones 1 a 3, en el que el éter corona es 18-corona-6-éter en el caso de que se utilice nitrito de potasio y 15-corona-5-éter en el caso de que se utilice nitrito de sodio.
5. Procedimiento según la reivindicación 3 ó 4, en el que el nitrito de metal alcalino es nitrito de potasio.
6. Procedimiento según cualquiera de las reivindicaciones 1 a 5, en el que se utiliza un solvente seleccionado de entre dimetilsulfóxido (DMSO), N,N-dimetilformamida (DMF), 1,3-dimetil-3,4,5,6-tetrahidro-2(1H)-pirimidinona (DMPU), tetrahidrofurano (THF), dioxano, formamida y mezclas de los mismos, como el solvente no nucleofílico polar.
7. Procedimiento según cualquiera de las reivindicaciones 1 a 6, en el que Hal representa flúor en la fórmula (I) y uno de entre R1 y R2 representa hidrógeno y el otro, flúor.
8. Procedimiento según la reivindicación 7, en el que R1 representa flúor y R2, hidrógeno.
9. Procedimiento según la reivindicación 8, en el que el compuesto de fórmula (II) se obtiene mediante un procedimiento que incluye la reacción de 1,4-difluorobenceno con un compuesto de fórmula (III),
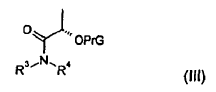
en la que,
PrG representa un grupo protector de hidroxilos,
R3 representa metilo o etilo, y
R4 representa metilo, etilo o metoxi, o
R3 y R4 conjuntamente con el átomo de nitrógeno al que se encuentran unidos representan un grupo heterocíclico de 4 a 6 elementos que presenta cero, uno o dos heteroátomos adicionales seleccionados de entre nitrógeno u oxígeno,
en presencia de una base, rindiendo un compuesto de fórmula (IV),
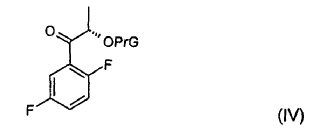
en la que PrG presenta el mismo significado que en la fórmula (III).
10. Procedimiento según cualquiera de las reivindicaciones 1 a 8, en el que un compuesto de fórmula (V),
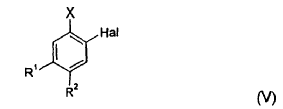
en la que,
Hal representa flúor o cloro,
X representa yodo o bromo, y
R1 y R2 representan, independientemente, hidrógeno, flúor o cloro, se hace reaccionar en primer lugar con magnesio, y el producto obtenido se hace reaccionar con un compuesto de fórmula (III):

en la que:
PrG representa un grupo protector de hidroxilos,
R3 representa metilo o etilo, y
R4 representa metilo, etilo o metoxi, o
R3 y R4 conjuntamente con el átomo de nitrógeno al que se encuentran unidos representan un grupo heterocíclico de 4 a 6 elementos que presenta cero, uno o dos heteroátomos adicionales seleccionados de entre nitrógeno u oxígeno,
rindiendo un compuesto de fórmula (VI):
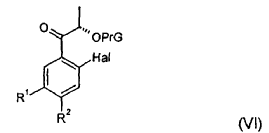
en la que:
PrG presenta el mismo significado que en la fórmula (III), y
R1 y R2 presentan el mismo significado que en la fórmula (V).
11. Procedimiento según la reivindicación 9 ó 10, en el que R3 y R4 conjuntamente con el átomo de nitrógeno al que se encuentran unidos representan un residuo morfolín-4-ilo.
12. Procedimiento según cualquiera de las reivindicaciones 1 a 11, que comprende la etapa de procedimiento en la que el compuesto de fórmula (VI):
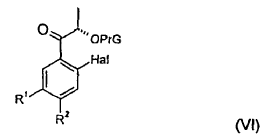
en la que:
Hal, R1 y R2 presentan los significados definidos en la reivindicación 1, y
PrG representa un grupo protector de hidroxilos,
se convierte en un compuesto de fórmula (VII):

en la que:
Hal, R1 y R2 presentan el mismo significado que en la fórmula (VI), y
R6 representa PrG o hidrógeno.
13. Procedimiento según la reivindicación 12, en el que el compuesto de fórmula (VII) se desprotege en el caso de que R6 represente un grupo PrG protector de hidroxilos y/o se convierta en el compuesto de fórmula (II) mediante epoxidación de Sharpless:

en la que:
Hal, R1 y R2 presentan el mismo significado que en la fórmula (VI).
14. Procedimiento según cualquiera e las reivindicaciones 1 a 13, en el que se hace reaccionar un compuesto de fórmula (I) tal como se muestra en la reivindicación 1, con 1,2,4-triazol en presencia de una base, proporcionando un compuesto de fórmula (VIII):
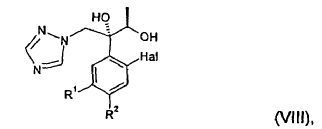
en la que Hal, R1 y R2 presentan el mismo significado que en la fórmula (I),
compuesto que después se convierte en un compuesto de fórmula (IX):
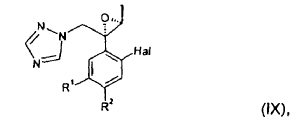
en la que Hal, R1 y R2 presentan el mismo significado que en la fórmula (I).
15. Procedimiento según la reivindicación 14, en el que el compuesto de fórmula (IX) se convierte en un compuesto de fórmula (X):
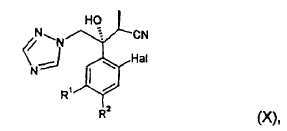
en la que Hal, R1 y R2 presentan el mismo significado que en la fórmula (IX), dicho compuesto de fórmula (X) se hace reaccionar con O,O-dietil éster de ácido ditiofosfórico o sulfuro de amonio, proporcionando un compuesto de fórmula (XI):

en la que Hal, R1 y R2 presentan el mismo significado que en la fórmula (X), y dicho compuesto de fórmula (XI) se hace reaccionar adicionalmente con 2-bromo-4'-ciano-acetofenona, proporcionando un compuesto de fórmula (XII):

en la que Hal, R1 y R2 presentan el mismo significado que en la fórmula (XI).
16. Procedimiento según la reivindicación 15, para la preparación de un compuesto de fórmula (XII-a):
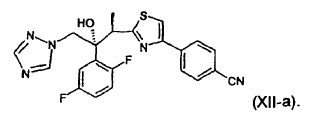
17. Utilización de un procedimiento según cualquiera de las reivindicaciones 1 a 16, para la preparación de un compuesto de fórmula (XII-a):
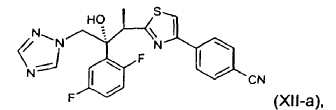
o de una sal, hidrato o solvato farmacéuticamente aceptable del mismo.
Patentes similares o relacionadas:
Métodos para preparar ligandos biaromáticos con enlace puente, del 23 de Octubre de 2019, de UNIVATION TECHNOLOGIES LLC: Un método para preparar un ligando de fenol biaromático con enlace puente de fórmula (I) que comprende al menos una etapa de directamente di-orto litiar […]
Nuevo derivado de ácido hidroxámico o sal del mismo, del 8 de Mayo de 2019, de FUJIFILM Toyama Chemical Co., Ltd: Un compuesto representado por la fórmula general [1]:**Fórmula** en donde R1 representa un átomo de hidrógeno, un grupo alquilo C1-C6 opcionalmente […]
Método de síntesis de entecavir y compuesto intermedio del mismo, del 20 de Marzo de 2019, de Zhejiang Ausun Pharmaceutical Co., Ltd: Un método para preparar el compuesto de fórmula 1:**Fórmula** que comprende las siguientes etapas c) La reacción de Mitsunobu del compuesto […]
Proceso mejorado para la preparación de derivados de ácido 2-(7-metilbenzo[d][1,3]dioxol-4-il 6-(sustituido))acético 2-sustituido, del 11 de Marzo de 2019, de Natco Pharma Limited (100.0%): Un proceso para la preparación de derivados de ácido 2-(7-metilbenzo[d][1,3]dioxol-4-il 6-(sustituido))acético 2-sustituido de fórmula-I, **(Ver […]
Compuestos novedosos que tienen actividad inhibidora frente a transportador de glucosa dependiente de sodio, del 6 de Septiembre de 2017, de MITSUBISHI TANABE PHARMA CORPORATION: Uso de un compuesto de fórmula (IA):**Fórmula** RA es un átomo de halógeno, un grupo alquilo C1-6 o un grupo alcoxilo C1-6; RB es un grupo fenilo opcionalmente […]
Compuestos de hidroxilo y composiciones para el control del colesterol y utilizaciones correspondientes, del 26 de Julio de 2017, de ESPERION THERAPEUTICS INC.: Compuesto de la fórmula I:**Fórmula** o sal farmacéuticamente aceptable, hidrato, solvato o mezcla del mismo, en el que: (a) cada existencia de […]
Derivados heterocíclicos que contienen grupos amino primarios y diazeniodiolatos, del 19 de Abril de 2017, de MERCK SHARP & DOHME CORP: Un compuesto que tiene la fórmula I:**Fórmula** o una sal farmacéuticamente aceptable del mismo, en la que X es O o NR7;**Fórmula** está unido a cualquier […]
Compuestos de hidroxilo y composiciones para el control del colesterol y utilizaciones correspondientes, del 22 de Febrero de 2017, de ESPERION THERAPEUTICS INC.: Compuesto de la fórmula I: **Fórmula** o sal farmacéuticamente aceptable, hidrato, solvato o mezcla del mismo, en el que: (a) cada existencia de m es independientemente […]