Procedimiento para la obtención a gran escala de inóculo miceliar de basidiomicetos mejorado.
Adición a la patente de invención P200930246, que describe la aplicación del procedimiento patentado a la producción de Ascomicetos.
La producción a gran escala de Ascomicetos resulta de gran interés comercial, y en particular de importantes especies pertenecientes a los géneros Tuber, Terfezia o Morchella, como son, entre otras, Tuber melanosporum "trufa negra" o "trufa de Périgord", Tuber magnatum "trufa blanca del Piamonte", Terfezia arenaria "trufa del desierto" o Morchella esculenta "colmenilla".
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P201231240.
Solicitante: UNIVERSIDAD POLITECNICA DE MADRID.
Nacionalidad solicitante: España.
Inventor/es: JIMÉNEZ AGUILAR,Mª de la Consolación.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C12N1/14 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 1/00 Microorganismos, p.ej. protozoos; Composiciones que los contienen (preparaciones de uso médico que contienen material de protozoos, bacterias o virus A61K 35/66, de algas A61K 36/02, de hongos A61K 36/06; preparación de composiciones de uso médico que contienen antígenos o anticuerpos bacterianos, p. ej. vacunas bacterianas, A61K 39/00 ); Procesos de cultivo o conservación de microorganismos, o de composiciones que los contienen; Procesos de preparación o aislamiento de una composición que contiene un microorganismo; Sus medios de cultivo. › Microorganismos fúngicos (cultivo de setas A01G 18/00; como novedades vegetales A01H 15/00 ); Sus medios de cultivo.
Descripción:
La presente invención proporciona un procedimiento para la obtención in vitro de micelio fúngico en cultivo puro, aislado, tanto de los cuerpos fructíferos de especies fúngicas de interés, como de secciones de raicillas de plantas micorrizadas con dichas especies fúngicas.
La invención es una adición a la Patente de Invención P200930246 por “Procedimiento para la Obtención a Gran Escala de Inóculo Miceliar de Basidiomicetos”, que comprende las etapas: aislamiento del micelio fúngico de especies de hongos Ascomicetos, preferiblemente de los géneros Tuber, Terfezia, o Morchella y más preferiblemente a partir de cuerpos fructíferos de los hongos; inoculación del micelio aislado en la etapa anterior en un medio de cultivo sólido de avena modificado (MOM) ; purificación del micelio en medio de cultivo sólido de avena modificado (MOM) ; desarrollo del micelio purificado en la etapa anterior en un medio de cultivo BiotinaAneurina-Ácido Fólico (BAF) modificado y obtención del micelio fúngico purificado.
En una realización preferible de la invención, dicho hongo del género Tuber es Tuber melanosporum, y en otra realización preferible dicho hongo del género Terfezia es Terfezia arenaria. En una realización preferible más de la invención dicho medio líquido BAF modificado presenta un pH de 6, 5.
Los resultados de los ejemplos muestran un extraordinario desarrollo y una gran cantidad de micelio obtenido. A los 5 días de cultivo se obtuvo por término medio un crecimiento de 1:103 del micelio en cultivo puro, ya dispuesto para la inoculación de las plantas a micorrizar.
Descripción de las figuras
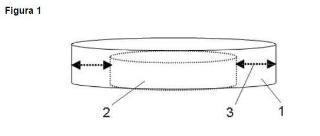
Las figuras muestran dos perspectivas diferentes del sistema utilizado para la purificación del micelio fúngico.
La figura 1 corresponde a una placa de Petri de un diámetro de 9 cm (1) en cuyo fondo se coloca de forma centrada una placa (2) de 5 cm de diámetro, que se muestra con trazo discontinuo. Como resultado de esta configuración entre ambas placas se crea un espacio circular de 2 cm de ancho (3) en el que se deposita el medio de cultivo fundido.
La figura 2 muestra el espacio central (4) que queda cuando, una vez enfriado el medio, se retira la placa interpuesta. En dicho espacio vacío central es donde se sitúa el inóculo del micelio, que se desarrolla hasta alcanzar la sección periférica (3) donde se encuentra el medio para la purificación, liberándose así de la posible presencia de bacterias, las cuales quedan retenidas en la sección central de las placas, al no poder desarrollarse por ausencia de nutrientes.
Ejemplos
Con la intención de mostrar la presente invención de un modo ilustrativo aunque en ningún modo limitante, se aportan los siguientes ejemplos.
Ejemplo 1: Preparación del inóculo miceliar de Tuber melanosporum, Terfezia arenaria y Morchella esculenta.
Se aislaron en cámara de flujo laminar pequeñas secciones de la parte más interna del himenio del píleo de carpóforos maduros de cada especie por separado, a los que se les había eliminado previamente la pellis. Seguidamente, se inocularon dichas secciones en condiciones de máxima asepsia en cámara de flujo laminar en placas Petri de plástico de 5 cm de diámetro, previamente esterilizadas en autoclave. A estas placas Petri se les había adicionado con anterioridad medio de cultivo sólido de avena modificado (MOM) con composición/litro de medio de 0, 5 g de Ca (NO3) 2 4H2O; 0, 2 g de PO4KH2 ; 0, 1 g de SO4Mg 7H2O; 0, 1g de KCl; 5, 0 g de sacarosa; 3, 5 g de avena en polvo; 0, 1 g de extracto de levadura y 8, 0 g de agar. Las placas inoculadas se mantuvieron en cámara a 20ºC hasta que el micelio se desarrolló llegando a ocupar toda la superficie de la placa. Posteriormente, el micelio obtenido en ambos casos se sometió a un proceso de purificación con objeto de eliminar la posibilidad de existencia de contaminación bacteriana, utilizando para ello placas Petri de 9 cm de diámetro en las que el medio de cultivo MOM tal cual anteriormente descrito se dispuso solamente en una sección circular periférica de 2 cm (placas de 5 cm de diámetro introducidas dentro de las placas Petri de 9 cm) . En la parte central de estas placas se colocaron secciones de 1x1cm del medio sólido de crecimiento MOM conteniendo el micelio fúngico. Estas placas se mantuvieron en cámara a 20ºC hasta que el micelio se desarrolló ocupando toda la superficie de la placa.
Ejemplo 2: Cultivo del inóculo miceliar
Una vez purificado el micelio de cada especie según el Ejemplo 1 se transfirió una pequeña porción para su desarrollo a gran escala a medio de cultivo líquido BAF 5 modificado. En todos los experimentos se partió de un inóculo micelial de tamaño similar con un peso medio de unos 10 mg, que se incubó en matraces erlenmeyer conteniendo medio de cultivo líquido BAF modificado con una composición/litro de medio: 0, 1 g de Cl2Ca; 0, 5 g de PO4KH2; 0, 5 g de SO4Mg 7H2O; 0, 005 g de SO4Mn; 0, 001 g de SO4Zn; 0, 01 g de Cl3Fe 7H2O; 2, 0 g de peptona; 0, 0005 g de tiamina;
0, 00001 g de biotina; 0, 05 g de inositol; 0, 0001 g de ácido fólico; 5, 0-20, 0 g de glucosa, y 0, 2 g de extracto de levadura; el cultivo se mantuvo bajo condiciones controladas: 25 ºC, oscuridad, pH 6, 5 y agitación constante a 120 rpm durante todos los días del cultivo ininterrumpidamente.
15 Ejemplo 3: Obtención de micelio de Tuber melanosporum en cultivo puro
Los resultados del crecimiento miceliar en medio nutritivo líquido BAF de la especie Tuber melanosporum durante catorce días sin nuevos aportes de medio nutritivo, se muestran en la tabla I. El crecimiento se mantiene hasta el día 14 en que, a causa del agotamiento de los nutrientes del medio de cultivo, se observa un cierto descenso del
mismo, que evidencia el inicio de procesos de lisis celular. Por ello, después de estos 14 días se requirió un nuevo aporte de medio nutritivo para la reanudación del crecimiento del micelio.
Tabla I
Peso medio del micelio (gr) Especie día 0 día 3 día 5 día 8 día 12 día 14 T.melanosporum 0, 0081 5, 1681 7, 9722 10, 9754 12, 1732 11, 7312De estos datos se deduce que a los cinco días el crecimiento del micelio en cultivo puro fue de 1:103, lo que se corresponde con una producción a gran escala.
Ejemplo 4: Obtención de micelio de Terfezia arenaria en cultivo puro
El crecimiento miceliar en medio nutritivo líquido BAF de la especie Terfezia arenaria durante catorce días sin nuevos aportes de medio nutritivo, se muestra en la tabla II.
En este ejemplo también se mantiene el crecimiento constante hasta el día 14 en que se observa un cierto descenso del mismo, que evidencia el inicio de los procesos de lisis celular. A partir de los 14 días se requirió un nuevo aporte de medio nutritivo para la reanudación del crecimiento del micelio.
Tabla II
Peso medio del micelio (gr) Especie día 0 día 3 día 5 día 8 día 12 día 14 T.arenaria 0, 0111 4, 9051 7, 6351 9, 2431 10, 3065 10, 0271Al igual que en la especie anterior, de los datos expuestos en la tabla se deduce que a los cinco días el crecimiento fue de 1:7x102, lo que indica también un extraordinario
desarrollo, si bien, un poco menor que en el ejemplo anterior.
Ejemplo 5: Obtención de micelio de Morchella esculenta en cultivo puro
El crecimiento miceliar en medio nutritivo líquido BAF de la especie Morchella esculenta. El crecimiento se mantiene, asimismo, hasta el día 14 en que se observa un
cierto descenso del mismo, que evidencia el inicio de procesos de lisis celular. Después de estos 14 días se requirió, igualmente, un nuevo aporte de medio nutritivo para la reanudación del crecimiento del micelio.
Tabla III
Peso medio del micelio (gr) Especie día 0 día 3 día 5 día 8 día 12 día 14 M.esculenta 0, 0078 4, 6273 7, 6895 10, 7395 12, 6912 12, 0161De los datos expuestos en la tabla se deduce que a los cinco días el crecimiento fue de 1:103, lo que se corresponde igualmente con una producción a gran escala similar a la del Ejemplo 3.
Reivindicaciones:
1. Adición a la Patente de Invención P200930246 por “Procedimiento para la Obtención a Gran Escala de Inóculo Miceliar de Basidiomicetos”, que comprende las etapas:
a) aislamiento del micelio fúngico de especies de hongos ascomicetos, b) inoculación del micelio aislado en la etapa a) en un medio de cultivo sólido de avena modificado (MOM) , c) purificación del micelio en medio de cultivo sólido de avena modificado (MOM) , d) desarrollo del micelio purificado en la etapa c) en un medio de cultivo Biotina-Aneurina-Ácido Fólico (BAF) modificado, y e) obtención del micelio fúngico purificado.
2. Adición a la Patente de Invención P200930246 según la reivindicación 1, caracterizada por que dicho aislamiento del micelio fúngico de la etapa a) se realiza a partir de cuerpos fructíferos de hongos.
3. Adición a la Patente de Invención P200930246 según la reivindicación 2, caracterizado por que el hongo de ascomicetos a partir del cual se obtiene el micelio es de los géneros Tuber, Terfezia, o Morchella.
4. Adición a la Patente de Invención P200930246 según la reivindicación 3, caracterizado por que dicho hongo del género Tuber es Tuber melanosporum.
5. Adición a la Patente de Invención P200930246 según la reivindicación 3, caracterizado por que dicho hongo del género Terfezia es Terfezia arenaria.
6. Adición a la Patente de Invención P200930246 según la reivindicación 1, caracterizado por que dicho medio líquido BAF modificado de la etapa d) presenta un pH de 6, 5.
Figura 1
Figura 2
Patentes similares o relacionadas:
Preparación de aceite microbiano que contiene ácidos grasos poliinsaturados, del 10 de Junio de 2020, de DSM IP ASSETS B.V.: Un aceite microbiano que comprende al menos el 50% de ácido araquidónico (ARA) basado en el aceite y que tiene un contenido en triglicéridos de al menos el 90%.
Método para la producción de material de siembra para microorganismos optimizado como catalizador para una realización de mineralización paralela compleja, del 11 de Marzo de 2020, de National Agriculture and Food Research Organization: Un método para producir un inóculo que tiene las siguientes características (F); (F) una característica tal que el inóculo mantiene su función como inóculo de […]
Procedimiento de producción de un cóctel enzimático a partir de mosto de hongo, del 19 de Febrero de 2020, de IFP ENERGIES NOUVELLES: Procedimiento para aumentar el nivel de β-glucosidasa y/o β-xilosidasa en un cóctel de enzimas de un microorganismo celulolítico que produce celulasas y/o hemicelulasas, […]
Extracto de fermento de Eupenicillium crustaceum y uso cosmético del mismo, del 19 de Febrero de 2020, de LUBRIZOL ADVANCED MATERIALS, INC.: Un extracto de fermento de una cepa de la especie Eupenicillium crustaceum, en el que el extracto de fermento comprende del 31 al 79 % en peso de péptidos, del 1 al 8 […]
Métodos de cultivo semicontinuo repetido, del 5 de Febrero de 2020, de Mara Renewables Corporation: Un método de cultivo semicontinuo repetido de un microorganismo Thraustochytrid productor de aceite que comprende las etapas de: (a) proporcionar un recipiente que comprende […]
Medios químicamente definidos para la detección de microorganismos, del 25 de Diciembre de 2019, de MERCK PATENT GMBH: Método para el cultivo de procariotas, levaduras y hongos en un medio de cultivo celular químicamente definido, caracterizado porque las células se incuban en un medio de cultivo […]
Proceso para la hidrólisis enzimática de material lignocelulósico y fermentación de azúcares, del 4 de Diciembre de 2019, de DSM IP ASSETS B.V.: Un proceso integrado para la producción de alcohol a partir de material lignocelulósico, en donde el proceso comprende: - pretratamiento […]
Cepas microbianas, composiciones y métodos para aumentar el fosfato disponible para las plantas, del 11 de Septiembre de 2019, de Novozymes Bio AG A/S: Cepa de Penicillium bilaiae aislada con el número de registro de depósito NRRL B-50788.