UN PROCEDIMIENTO DE OBTENCION DE UN COMPUESTO POR FORMACION DE UN POLIMERO A PARTIR DE UN FARMACO MODELO.
LA PRESENTE INVENCION SE REFIERE A UN PROCEDIMIENTO DE FORMACION DE POLIMEROS EN PRESENCIA DE ACIDO NUCLEICO,
UTILIZANDO UNA POLIMERIZACION POR MATRIZ. ESTA INVENCION SE REFIERE TAMBIEN A UN PROCEDIMIENTO QUE PERMITE QUE SE PRODUZCA LA POLIMERIZACION EN SISTEMAS HETEROFASICOS. DICHOS PROCEDIMIENTOS SE PUEDEN USAR PARA CANALIZAR ACIDOS NUCLEICOS, PARA CONDENSAR EL ACIDO NUCLEICO, PARA FORMAR POLIMEROS QUE UNEN EL ACIDO NUCLEICO, PARA FORMAR COMPLEJOS SUPRAMOLECULARES QUE CONTIENEN ACIDO NUCLEICO Y POLIMEROS Y PARA FORMAR UN COMPLEJO INTERPOLIELECTROLITA
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US97/24089.
Solicitante: MIRUS CORPORATION.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 545 SCIENCE DRIVE,MADISON, WI 53711.
Inventor/es: WOLFF, JON, A., BUDKER,VLADIMIR,G, HAGSTROM,JAMES,E, TRUBETSKOY,VLADIMER,S, SLATTUM,PAUL,M, HANSON,LISA,J.
Fecha de Publicación: .
Fecha Concesión Europea: 14 de Abril de 2010.
Clasificación Internacional de Patentes:
- A61K47/48K6
- A61K47/48R2T
- A61K48/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen material genético que se introduce en las células del cuerpo vivo para tratar enfermedades genéticas; Terapia génica.
- A61K48/00B
- A61K48/00B4
- A61K48/00B4B
- C12N15/87 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Introducción de material genético extraño utilizando procedimientos no previstos en otro lugar, p. ej. cotransformación.
Clasificación PCT:
- A01N43/04 A […] › A01 AGRICULTURA; SILVICULTURA; CRIA; CAZA; CAPTURA; PESCA. › A01N CONSERVACION DE CUERPOS HUMANOS O ANIMALES O DE VEGETALES O DE PARTES DE ELLOS (conservación de alimentos o productos alimenticios A23 ); BIOCIDAS, p. ej. EN TANTO QUE SEAN DESINFECTANTES, PESTICIDAS O HERBICIDAS (preparaciones de uso médico, dental o para el aseo que eliminan o previenen el crecimiento o la proliferación de organismos no deseados A61K ); PRODUCTOS QUE ATRAEN O REPELEN A LOS ANIMALES; REGULADORES DEL CRECIMIENTO DE LOS VEGETALES. › A01N 43/00 Biocidas, productos que atraen o repelen a los animales perjudiciales, o reguladores del crecimiento de los vegetales, que contienen compuestos heterocíclicos (que contienen anhídridos cíclicos, imidas cíclicas A01N 37/00; que contienen compuestos de fórmula , que no tienen más que un heterociclo en los que m≥1 y n≥0 y es una pirrolidina, una piperidina, una morfolina, una tiomorfolina, una piperazina o una polimetilenoimina, no sustituida o sustituida por un alcoilo, que tiene al menos cuatro grupos CH 2 A01N 33/00 - A01N 41/12; que contienen ácidos ciclopropanocarbhoxílicos o sus derivados, p. ej. ésteres con heterociclos, A01N 53/00). › con un heteroátomo.
- A61K45/00 A61K […] › Preparaciones medicinales que contienen ingredientes activos no previstos en los grupos A61K 31/00 - A61K 41/00.
- C12N15/00 C12N […] › Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K).
Clasificación antigua:
- A01N43/04 A01N 43/00 […] › con un heteroátomo.
- A61K45/00 A61K […] › Preparaciones medicinales que contienen ingredientes activos no previstos en los grupos A61K 31/00 - A61K 41/00.
- C12N15/00 C12N […] › Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K).
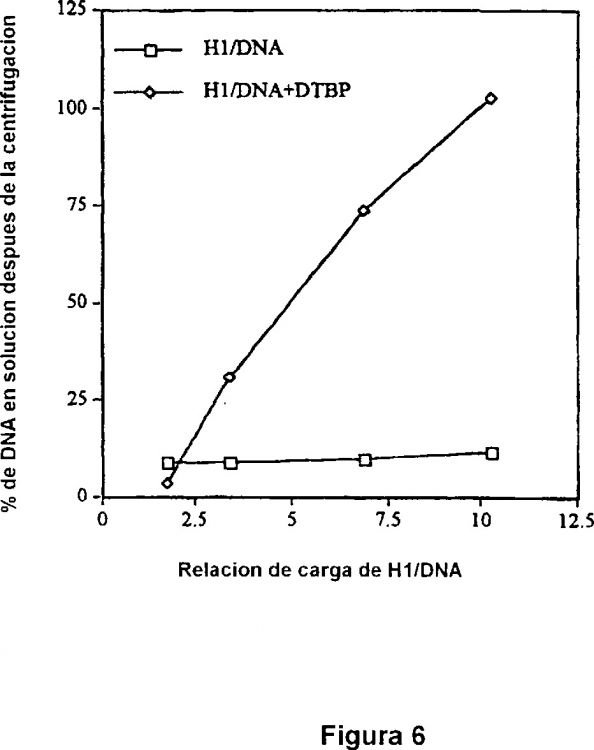
Fragmento de la descripción:
Un procedimiento de obtención de un compuesto por formación de un polímero a partir de un fármaco modelo.
Fundamento
Se usan polímeros para el suministro de fármacos para una diversidad de fines terapéuticos. También se han usado polímeros para el suministro de ácidos nucleicos (polinucleótidos y oligonucleótidos) a las células con fines terapéuticos, que han sido denominados terapia génica o terapia antisentido. Uno de los varios métodos de suministro de ácidos nucleicos a las células es el uso de complejos de DNA - policationes. Se ha demostrado que proteínas catiónicas como las histonas y las protaminas, o polímeros sintéticos como la polilisina, la poliarginina, la poliornitina, el DEAE dextrano, el polibreno y la polietilenimina, eran eficaces agentes de suministro intracelular, mientras que los policationes pequeños, como la espermina, eran ineficaces. (Felgner, P.L. (1990) Advanced Drug Delivery Rev. 5, 163-187; Boussif, O., Lezoualch, F., Zanta, M.A., Mergny, M. D., Scherman, D., Demeneix, B., y Behr, J. P. (1995) Proc. Natl. Acad. Sci. USA 92, 7297-7301). El mecanismo por el cual los policationes facilitan la absorción de DNA no está dilucidado del todo, pero los siguientes son algunos principios importantes:
1) Los policationes proporcionan la fijación del DNA a la superficie de la célula diana: El polímero forma un puente entre los ácidos nucleicos polianiónicos y las superficies polianiónicas de las células. Como resultado, el mecanismo principal de la translocación de DNA al espacio intracelular podría ser endocitosis adsortiva no específica, que puede ser más efectiva que la endocitosis de líquidos o endocitosis mediada por un receptor. Además, los policationes son un enlazador muy conveniente para fijar receptores específicos al DNA y, como resultado, los complejos DNA - policatión pueden ser dirigidos a tipos de células específicos (Perales, J.C., Ferkol, T. Molas, M. y Hanson, W. (1994) Eur. J. Biochem. 226, 255-266; Cotten, M., Wagner,E. y Birnstiel, M.L. (1993) Methods in Enzymology 217, 618-644; Wagner, E., Curiel, D., y Cotten, M. (1994) Advanced Drug Delivery Rev. 114, 113-135).
2) Los policationes protegen el DNA en complejos contra la degradación por nucleasa (Chiou, H. C., Tangco, M. V. Levina, S. M., Robertson, D., Kormis, K., Wu, C. H., y Wu, G. Y. (1994) Nucleic Acids Res. 22, 5439-5446). Esto es importante para la preservación tanto extracelular como intracelular del DNA. La etapa endocítica en la absorción intracelular de los complejos de DNA - policatión está sugerida por resultados en los que la expresión del DNA se obtiene solamente incorporando una etapa de lisis hipertónica suave (bien sea por glicerol o DMSO) (Lopata, M. A., D. Clevland, W., y Sollner-Webb, B. (1984) Nucleic Acids Res. 12, 5707-5717; Golub, E. I., Kim, H. y Volsky, D. J. (1989) Nucleic Acid Res. 17, 4902). La expresión génica es también posibilitada o incrementada evitando la acidificación del endosoma con NH4Cl o cloroquina (Luthman, H. y Magnusson, G. (1983) Nucleic Acids Res. 11, 1295-1300). La polietilenimina que facilita la expresión génica sin tratamientos adicionales probablemente rompe la propia función endosomal (Boussif, O., Lezoualch, F., Zanta, M. A., Mergny, M. D., Scherman, D., Demeneix, B., y Behr, J.P. (1995) Proc. Natl. Acad. Sci. USA 92, 7297-7301). La rotura de la función endosomal se ha realizado también por unión con los agentes rompedores endosomales de policatión tales como la fusión de péptidos o adenovirus (Zauner, W., Blaas, D., Kuechler, E., Wagner, E., (1995) J. Virology 69, 1085-1092; Wagner, E., Plank, C., Zatloukal, K., Cotten, M., y Birnstiel, M.L. (1992) Proc. Natl. Acad. Sci. 89, 7934-7938) (Fisher, K.J., y Wilson, J.M. (1994) Biochemical J. 299, 49-58).
3) Los policationes generan condensación de DNA: El volumen que ocupa una molécula de DNA en complejo con policationes es radicalmente más pequeño que el volumen de una molécula de DNA libre. El tamaño del complejo de DNA/polímero es crítico para el suministro de genes in vivo. En términos de inyección intravenosa, el DNA necesita cruzar la barrera endotelial y llegar a las células parenquimales de interés. Las más grandes ventanas endoteliales (endotelia fenestrae; orificios en la barrera endotelial) se presentan en el hígado y tienen un diámetro medio de 100 nm. El tamaño de las ventanas (fenestrae) en otros órganos es mucho menor. El tamaño de los complejos de DNA es también importante para el proceso de absorción celular. Después de la unión a las células diana el complejo de DNA - policatión debe ser absorbido por endocitosis. Como las vesículas endocíticas tienen un diámetro interno homogéneo de aproximadamente 100 nm en hepatocitos de tamaño similar en otros tipos de célula, los complejos de DNA necesitan ser menores que 100 nm (Geuzze, H.J., Slot, J. W., Strous, G. J., Lodish, H. F., y Schwartz, A. L. (1982) J. Cell Biol. 92, 865-870).
Condensación del DNA
Se ha demostrado que un número significativo de cationes polivalentes con estructuras moleculares muy diferentes inducen la condensación del DNA. Estos incluyen espermidina, espermina, Co(NH3)63+, protamina, histona H1, y polilisina (Gosule, L. C. y Schellman, J. A. (1976) Nature 259, 333-335; Chattoraj, D. K., Gosule, L. C. y Schellman, J. A. (1978) J. Mol. Biol. 121, 327-337; Had, N.V., Downing, K. H. y Balhorn, R. (1993) Biochem. Biophys. Res. Commun. 193, 1347-1354; Hsiang, M. W y Cole, R. D. (1977) Proc. Natl. Acad. Sci. USA 74, 4852-4856; Haynes, M., Garret, R. A. y Gratzer, W. B. (1970) Biochemistry 9, 4410-4416; Widom, J. y Baldwin, R. L. (1980) J. Mol. Biol. 144, 431-453). El análisis cuantitativo ha demostrado que la condensación del DNA es favorecida cuando el 90% o más de las cargas a lo largo del esqueleto de azúcar-fosfato están neutralizadas (Wilson, R. W. y Bloomfield, V. A. (1979) Biochemistry 18, 2192-2196). Dependiendo de la concentración de DNA, la condensación conduce a tres tipos de estructuras principales:
1) En solución extremadamente diluida (aproximadamente 1 µg/ml o inferior), las moléculas de DNA largas pueden experimentar un colapso monomolecular y formar estructuras descritas como toroides.
2) En solución muy diluida (aproximadamente 10 µg/ml) se forman microagregados con moléculas cortas o largas y permanecen en suspensión. Los toroides, varillas y pequeños agregados pueden observarse en tal solución.
3) En solución diluida (aproximadamente 1 mg/ml), se forman grandes agregados que sedimentan fácilmente. (Sicorav, J. L., Pelta, J., y Livolant, F (1994) Biophysical Journal 67, 1387-1392).
Los toroides se han considerado una forma atractiva para el suministro de genes porque tienen el tamaño más pequeño. Aunque se ha encontrado que el tamaño de toroides de DNA producidos dentro de preparados simples varía considerablemente, el tamaño del toroide no es afectado por la longitud del DNA que se condensa. Las moléculas de DNA de 400 pb a la longitud genómica producen toroides similares en tamaño (Bloomfield, V. A. (1991) Biopolymers 31, 1471-1481). Por consiguiente un toroide puede incluir de una a varias moléculas de DNA. La cinética del colapso del DNA por policationes que tuvo por resultado toroides, es muy lenta. Por ejemplo la condensación del DNA por Co(NH3)6Cl3 necesita 2 horas a temperatura ambiente (Arscott, P. G., Ma, C., y Bloomfield, V. A. (1995) Biopolymers 36, 345-364).
El mecanismo de la condensación del DNA no es evidente. Las fuerzas electrostáticas entre las hélices no perturbadas proceden principalmente de un mecanismo de fluctuación de ion contrario que requiere cationes polivalentes y desempeña el principal papel en la condensación del DNA (Riemer, S. C. y Bloomfield, V. A. (1978) Biopolymers 17, 789-794; Marquet, R. y Houssier, C. (1991) J. Biomol. Struct. Dynam. 9, 159-167; Nilsson, L. G., Guldbrand, L. y Nordenskjold L. (1991) Mol. Phys. 72, 177-192). La fuerzas de hidratación predominan sobre las fuerzas electrostáticas cuando las hélices de DNA se acercan más de unos cuantos diámetros del agua (Leikin, S., Parsegian, V. A., Rau, D.C. y Rand, R. P. (1993) Ann. Rev. Phys. Chem. 44, 369-395). En el caso de interacciones DNA - policatión polimérico, la condensación del DNA es un proceso más complicado que en el caso de policationes de bajo peso molecular. Diferentes proteínas policatiónicas pueden generar la formación de toroides y varillas con DNA de diferente tamaño a una relación de carga positiva a negativa de 0,4 (Garciaramirez, M., y Subirana, J. A. (1994) Biopolymers 34, 285-292). Se demostró por...
Reivindicaciones:
1. Un método para preparar un complejo para suministrar a una célula, que comprende formar covalentemente un polímero, a partir de monómeros, en presencia de un ácido nucleico, y en el que el polímero es modificado covalentemente en presencia del ácido nucleico.
2. El método según la reivindicación 1ª, en el que uno o más de los monómeros tiene afinidad por el ácido nucleico.
3. El método según la reivindicación 2ª, en el que dichos uno o más monómeros interaccionan con el ácido nucleico mediante interacción electrostática, enlace de H, transferencia de carga o fuerzas de van der Waals.
4. El método según la reivindicación 3ª, en el que los monómeros consisten en policationes o polianiones.
5. El método según la reivindicación 4ª, en el que el policatión comprende una poliamina.
6. El método según la reivindicación 1ª, en el que la formación del polímero condensa el DNA.
7. El método según la reivindicación 1ª, en el que los monómeros condensan el ácido nucleico.
8. El método según las reivindicaciones 1ª a 5ª, en el que modificar covalentemente el polímero comprende unir una molécula al polímero.
9. El método según la reivindicación 8ª, en el que uno o más de los monómeros comprenden un estabilizante estérico.
10. El método según la reivindicación 9ª, en el que el estabilizante estérico comprende polietilenglicol (PEG).
11. El método según la reivindicación 8ª, en el que la molécula comprende una señal de potenciación de la transferencia génica.
12. El método según la reivindicación 11ª, en el que la señal de potenciación de la transferencia génica se elige entre el grupo que consiste en una señal de localización nuclear, un ligando que se une a una célula, y una señal de liberación.
13. El método según la reivindicación 8ª, en el que en el que la molécula cambia la carga del polímero.
14. El método según la reivindicación 8ª, en el que la molécula se elige entre el grupo que consiste en compuestos anfipáticos, hidrófobos e hidrófilos.
15. El método según la reivindicación 8ª, en el que la molécula altera la carga neta del complejo.
16. El método según la reivindicación 5ª, que comprende además asociar no covalentemente una molécula con el complejo.
17. El método según la reivindicación 16ª, en el que la molécula comprende una señal de potenciación de la transferencia génica.
18. El método según la reivindicación 16ª, en el que la molécula comprende un polímero.
19. El método según la reivindicación 16ª, en el que la molécula se elige entre el grupo que consiste en: estabilizante estérico, PEG, compuesto anfipático, compuesto hidrófobo y compuesto hidrófilo.
20. El método según la reivindicación 16ª, en el que la molécula altera la carga neta del complejo.
21. El método según la reivindicación 1ª, en el que el polímero contiene un enlace disulfuro.
22. El método según la reivindicación 5ª, en el que el complejo adopta un tamaño para que pase a través de las ventanas endoteliales.
23. Un complejo para suministrar un ácido nucleico a una célula, preparado mediante el procedimiento que comprende:
a) asociar un policatión con el ácido nucleico condensando así el ácido nucleico.
b) hacer reaccionar un agente de entrecruzamiento con el complejo entrecruzando así el policatión en presencia del ácido nucleico.
24. El complejo según la reivindicación 23ª, en el que el policatión comprende una poliamina.
25. El complejo según la reivindicación 23ª, que comprende además una molécula unida covalentemente al policatión.
26. El complejo según la reivindicación 25ª, en el que la molécula comprende un estabilizante estérico.
27. El complejo según la reivindicación 26ª, en el que el estabilizante estérico comprende polietilenglicol (PEG).
28. El complejo según la reivindicación 25ª, en el que la molécula se elige entre el grupo que consiste en una señal de localización nuclear, un ligando que se une a una célula, y una señal de liberación.
29. El complejo según la reivindicación 25ª, en el que la molécula altera el potencial zeta del complejo.
30. El complejo según la reivindicación 25ª, en el que la molécula se elige entre el grupo que consiste en un compuesto anfipático, un compuesto hidrófobo y un compuesto hidrófilo.
31. El complejo según la reivindicación 23ª, que comprende además una molécula asociada no covalentemente con el complejo.
32. El complejo según la reivindicación 31ª, en el que la molécula se elige entre el grupo que consiste en polianión, estabilizante estérico, PEG, compuesto anfipático, compuesto hidrófobo y compuesto hidrófilo.
33. El complejo según la reivindicación 31ª, en el que la molécula altera el potencial zeta del complejo.
34. El complejo según la reivindicación 23ª, en el que el polímero o el agente de entrecruzamiento contiene un enlace disulfuro.
35. El complejo según la reivindicación 23ª, en el que el complejo adopta un tamaño para que pase a través de las ventanas endoteliales.
36. El uso para el suministro in vitro del complejo según cualquiera de las reivindicaciones 23ª a 35ª a una célula, en el que el suministro comprende transfectar la célula con un ácido nucleico.
37. El uso según la reivindicación 36ª, en el que el suministro comprende el suministro a una célula, a la membrana de la célula, dentro del citoplasma de la célula, el núcleo de la célula u otro orgánulo de la célula.
38. El uso según la reivindicación 36ª, en el que el suministro es mezclando el ácido nucleico con las células en cultivo.
39. El uso del complejo según cualquiera de las reivindicaciones 23ª a 35ª para la preparación de un medicamento para el tratamiento o la profilaxis de un mamífero por terapia génica, que comprende suministrar el complejo a una célula, en donde el ácido nucleico comprendido por el complejo produce proteína terapéutica o una molécula antisentido.
40. El uso según la reivindicación 39ª, en el que la proteína terapéutica es una hormona, una citocina, un factor de crecimiento o una enzima.
41. El uso según las reivindicaciones 39ª o 40ª, en el que la enzima, tal como se produce, es deficitaria o carencial en pacientes con un fallo innato de metabolismo.
42. El uso según cualquiera de las reivindicaciones 39ª a 41ª, en el que la enzima es fenilalanina hidrolasa y el paciente tiene fenilcetonuria.
43. El uso según cualquiera de las reivindicaciones 39ª a 42ª, en el que la molécula antisentido es terapéutica en pacientes con tumor, cáncer o infección.
44. El uso según cualquiera de las reivindicaciones 39ª a 43ª, en el que el suministro es intravenoso, intraarterial, intra ducto biliar, intramuscular, subcutáneo o intraperitoneal; por suministro en los vasos sanguíneos, vasos linfáticos, vasos biliares, vasos renales o ventrículos cerebrales; o por inyecciones directas en los tejidos.
45. El uso según cualquiera de las reivindicaciones 39ª a 44ª, en el que las inyecciones directas son en el hígado, cerebro, timo, riñones, corazón, ojos, piel, ganglios linfáticos, huesos o tubo digestivo.
Patentes similares o relacionadas:
Composiciones útiles en el tratamiento de la deficiencia de ornitina transcarbamilasa (OTC), del 8 de Julio de 2020, de THE TRUSTEES OF THE UNIVERSITY OF PENNSYLVANIA: Un vector vírico recombinante que comprende una secuencia de ácido nucleico que codifica la proteína ornitina transcarbamilasa humana (hOTC) y secuencias […]
Terapia génica para la diabetes, del 8 de Julio de 2020, de UCL Business Ltd: Una molécula de ácido nucleico que comprende una secuencia de nucleótidos que codifica una proteína preproinsulina funcional en donde la secuencia de nucleótidos tiene al menos […]
Vacuna de ADN que contiene un epítopo específico de VEGF y/o un epítopo específico de angiopoyetina-2, del 1 de Julio de 2020, de OSAKA UNIVERSITY: Un vector de expresión que codifica un polipéptido del antígeno del núcleo del virus de la hepatitis B quimérico con una inserción para uso en el tratamiento o la profilaxis […]
Composiciones para modular la expresión de SOD-1, del 24 de Junio de 2020, de Biogen MA Inc: Un compuesto antisentido según la siguiente fórmula: mCes Aeo Ges Geo Aes Tds Ads mCds Ads Tds Tds Tds mCds Tds Ads mCeo Aes Geo mCes Te (secuencia […]
Ácido nucleico antisentido, del 24 de Junio de 2020, de NIPPON SHINYAKU CO., LTD.: Un oligómero antisentido de 14 a 32 bases de longitud, que comprende dos unidades de oligómeros conectadas seleccionadas del grupo que consiste […]
Plekhg5 como diana farmacéutica para trastornos neurológicos, del 15 de Junio de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC): Plekhg5 como diana farmacéutica para trastornos neurológicos. La invención hace referencia al uso del gen Plekhg5 como diana farmacológica para el cribado, […]
Vectores de AAV dirigidos a oligodendrocitos, del 10 de Junio de 2020, de THE UNIVERSITY OF NORTH CAROLINA AT CHAPEL HILL: Un ácido nucleico que codifica una cápside de AAV, comprendiendo el ácido nucleico una secuencia codificante de la cápside de AAV que es al menos el 96 % idéntica […]
Método para activar células T auxiliares, del 10 de Junio de 2020, de OTSUKA PHARMACEUTICAL CO., LTD.: Una composición para su uso en el tratamiento o prevención del cáncer mediante la activación de células T auxiliares en un sujeto, en donde dicha composición […]