PROCEDIMIENTO NOVEDOSO DE PREPARACION DE INTERMEDIARIOS DE NEBIVOLOL.
Un procedimiento para la preparación de sales de adición de ácido de compuestos de la fórmula I:
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IN2004/000241.
Solicitante: HETERO DRUGS LIMITED.
Nacionalidad solicitante: India.
Dirección: HETERO HOUSE 8-3-166/7/1, ERRAGADDA,HYDERABAD, ANDHRAPRADESH. HYDE.
Inventor/es: PARTHASARADHI REDDY,BANDI,HETERO HOUSE, RATHNAKAR REDDY,KURA,HETERO DRUGS LIMITED R & D, RAJI REDDY,RAPOLU,HETERO DRUGS LIMITED R & D, MURALIDHARA REDDY,DASARI HETERO DRUGS LIMITED, SRINIVAS REDDY,ITIYALA HETERO HOUSE.
Fecha de Publicación: .
Fecha Concesión Europea: 21 de Abril de 2010.
Clasificación Internacional de Patentes:
- C07D311/58 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 311/00 Compuestos heterocíclicos que contienen ciclos de seis miembros que contienen un átomo de oxígeno como único heteroátomo, condensados con otros ciclos. › con sustituyentes diferentes a los átomos de oxígeno o azufre en las posiciones 2 ó 4.
Clasificación PCT:
- C07D311/58 C07D 311/00 […] › con sustituyentes diferentes a los átomos de oxígeno o azufre en las posiciones 2 ó 4.
Clasificación antigua:
- C07D31/158
Fragmento de la descripción:
Procedimiento novedoso de preparación de intermediarios de nebivolol.
Campo de la invención
La presente invención se refiere a un procedimiento para la preparación del par diastereómero deseado a partir de una mezcla de pares diastereómeros para la obtención, de este modo, de productos intermedios de nebivolol.
Antecedentes de la invención
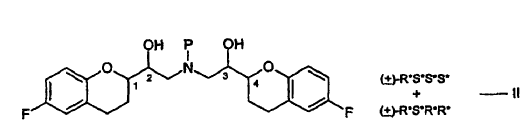
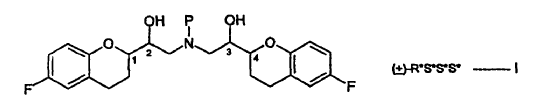
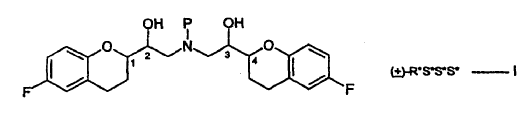
La Patente EP No. 0145067 divulga derivados de 2,2'-iminobisetanol. Los compuestos son agentes antihipertensores. Entre ellos, el nebivolol, químicamente (+)-[2R*[1S*,5S*(S*)]]-a,a'-[iminobis(metileno)]bis[6-fluoro-3,4-dihidro-2H-1-benzopiran-2-metanol], es el agente antihipertensor el más importante. El nebivolol se representa por la estructura siguiente:
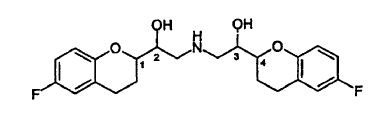
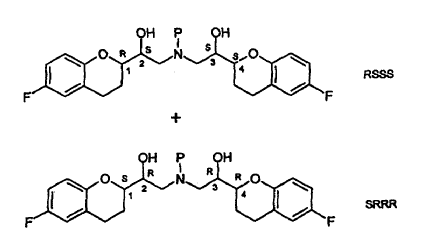
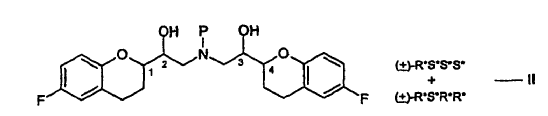
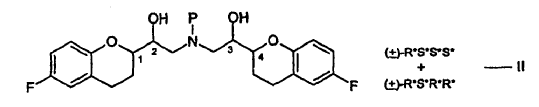
La estructura anterior tiene cuatro centros estereogénicos, los cuales se indican con el No. 1, 2, 3 y 4. El nebivolol es una mezcla de cantidades iguales de 2 enantiómeros que tienen la configuración SRRR y la RSSS, respectivamente.
Los procedimientos para la preparación de nebivolol y compuestos relacionados han sido descritos en las Patentes EP No. 0145067 y EP No. 0334429. De acuerdo con los procedimientos descritos en estas patentes, se requieren separaciones cromatográficas para la separación de pares diastereómeros en la etapa de producto intermedio o en la etapa final. Las separaciones cromatográficas implican operaciones adicionales, puestas a punto costosas adicionales que se suman al coste de producción. La Patente de EE.UU. No. 5.759.580 describe la separación de hidrocloruro de (
Los autores de la presente invención han descubierto que cuando el compuesto N-protegido de fórmula:
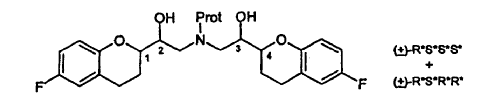
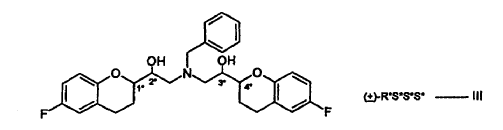
en la que -Prot es un grupo de protección, se convierte en una sal del mismo, las sales pueden someterse a cristalización fraccionada del par diastereómero deseado a partir de la mezcla de pares diastereómeros. La separación de los diastereómeros de estos compuestos N-protegidos mediante cristalización no ha sido divulgada en la técnica anterior. El par diastereómero separado es un producto intermedio útil para la preparación de nebivolol.
La cristalización fraccionada permite igualmente la purificación de los compuestos N-protegidos a partir de la masa de reacción, evitándose, de este modo, múltiples purificaciones del nebivolol bruto.
Descripción detallada de la invención
La presente invención proporciona un nuevo procedimiento para la preparación de sales de adición de ácido de compuestos de la fórmula I:
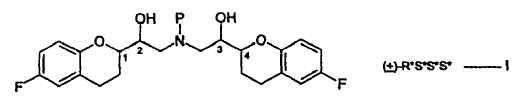
en la que:
P es -alilo o
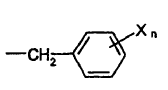
en la que:
cada X independientemente es halo, nitro o alquilo de C1-C3 y n es 0 - 5;
que comprende:
a) tratar una mezcla que contiene diastereómeros racémicos de un compuesto de la fórmula II:
en la que P es tal como se ha definido en la fórmula I;
con un ácido adecuado para formar la sal de adición de ácido correspondiente:
b) someter la sal de adición de ácido obtenida en la etapa (a) a la cristalización fraccionada a partir de un disolvente alcohólico, disolvente cetónico, acetonitrilo, dimetilformamida, dimetilsulfóxido y tetrahidrofurano o una mezcla de los mismos, para obtener el par diastereómero de compuestos de la fórmula I.
La descripción estereoquímica que describe las configuraciones en los centros quirales usadas en la presente memoria están en el orden (1, 2, 3 y 4) mencionado en la estructura. Así, por ejemplo, la descripción estereoquímica R*S*S*S* mostrada en la fórmula I, se refiere a configuraciones R* en el carbono "1", la configuración S* en el 2, etc., y R*S*S*S* tiene el significado mostrado a continuación.
Los disolventes alcohólicos están seleccionados entre el grupo constituido por alcoholes de C1 a C5. Los disolventes alcohólicos preferibles son metanol, etanol, propanol y alcohol isopropílico.
Los disolventes cetónicos están seleccionados entre el grupo de cetonas de C3 a C8. Los disolventes cetónicos preferibles son acetona, metil isobutil cetona y metil terc-butil cetona.
Las sales de adición de ácido se preparan tratando la mezcla que contiene compuestos de fórmula II con los ácidos correspondientes en un disolvente por medios convencionales. Los ácidos adecuados son ácidos inorgánicos, por ejemplo, haluros de hidrógeno, ácido nítrico, ácido fosfórico; y ácidos orgánicos tales como ácidos carboxílicos, ácidos sulfónicos. Los ejemplos para ácidos carboxílicos que pueden mencionarse son ácido acético, ácido propanóico, ácido fórmico, ácido hidroxiacético, ácido 2-hidroxi propanóico, ácido 2-oxipropanóico, ácido propanodioico, ácido butanodioico, ácido (Z)-2-butenodioico, ácido (E)-2-butenodioico, ácido 2-hidroxi butanodioico. Los ejemplos para ácidos sulfónicos que pueden mencionarse son ácido metano sulfónico, ácido tolueno sulfónico y ácido benceno sulfónico.
La etapa (a) se lleva a cabo preferiblemente en un disolvente orgánico. La selección del disolvente no es crítica. Los disolventes pueden seleccionarse entre el grupo constituido por alcoholes de C1 a C5, cetonas de C3 a C8, ésteres de C2 a C8, acetonitrilo, tetrahidrofurano, dimetilformamida, dimetilsulfóxido, dioxano, hidrocarburos aromáticos, hidrocarburos halogenados de C1 a C5 y éteres de C2 a C8 y una mezcla de los mismos. Los disolventes alcohólicos preferibles son metanol, etanol, propanol y alcohol isopropílico; los disolventes cetónicos preferibles son acetona, metil etil cetona, metil isobutil cetona, metil terc-butil cetona y dietil cetona; los disolventes ésteres preferibles son acetato de etilo, acetato de metilo, acetato de isopropilo, acetato de terc-butil metilo y formiato de etilo; los disolventes hidrocarburos aromáticos preferibles son benceno, tolueno y xileno; los disolventes hidrocarburos halogenados preferibles son cloruro de metileno, cloroformo, tetracloruro de carbono y dicloruro de etileno; y los disolventes éter preferibles son terc-butil metil éter y éter dietílico. Los disolventes los más preferidos son metanol, etanol, propanol, alcohol isopropílico, acetona, metil etil cetona, metil isobutil cetona, metil terc-butil cetona, dietil cetona, acetonitrilo, dimetilformamida, dimetilsulfóxido y tetrahidrofurano.
Preferiblemente, la cristalización fraccionada puede llevarse a cabo en condiciones esencialmente anhidras. El mantenimiento de las condiciones anhidras durante la cristalización no es esencial, pero es para evitar la incompleta cristalización de algunas sales de adición de ácido.
La cristalización puede llevarse a cabo mediante procedimientos comúnmente conocidos tales como enfriamiento, adición de un anti-disolvente, siembra y eliminación parcial del disolvente o una combinación de los mismos. La cristalización fraccionada puede llevarse a cabo, preferiblemente, a aproximadamente 0ºC hasta 45ºC y más preferiblemente a aproximadamente 0ºC hasta 35ºC.
Las sales de adición de ácido de las fórmulas I y II son nuevas e igualmente forman parte de la invención.
Las sales de adición de ácido preferidas de la fórmula I preparadas de acuerdo con la presente invención son sales de haluros de hidrógeno, sulfatos de hidrógeno, sulfatos y ácido sulfónico.
Las...
Reivindicaciones:
1. Un procedimiento para la preparación de sales de adición de ácido de compuestos de la fórmula I:
en la que:
P es -alilo o
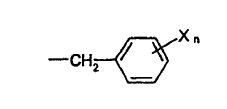
en la que:
cada X independientemente es halo, nitro o alquilo de C1-C3 y n es 0 - 5;
que comprende:
a) tratar una mezcla que contiene diastereómeros racémicos de un compuesto de la fórmula II:
en la que P es tal como se ha definido en la fórmula I;
con un ácido adecuado para forma la sal de adición de ácido correspondiente:
b) someter la sal de adición de ácido obtenida en la etapa (a) a la cristalización fraccionada a partir de un disolvente alcohólico, disolvente cetónico, acetonitrilo, dimetilformamida, dimetilsulfóxido y tetrahidrofurano o una mezcla de los mismos, para obtener el par diastereómero de compuestos de la fórmula I.
2. El procedimiento de acuerdo con la reivindicación 1, en el que el disolvente alcohólico está seleccionado entre el grupo constituido por alcoholes de C1 a C5.
3. El procedimiento de acuerdo con la reivindicación 2, en el que el disolvente alcohólico está seleccionado entre metanol, etanol, propanol y alcohol isopropílico.
4. El procedimiento de acuerdo con la reivindicación 3, en el que el disolvente alcohólico es etanol.
5. El procedimiento de acuerdo con la reivindicación 1, en el que el disolvente cetónico está seleccionado entre el grupo constituido por cetonas de C3 a C8.
6. El procedimiento de acuerdo con la reivindicación 5, en el que el disolvente cetónico está seleccionado entre acetona, metil isobutil cetona y metil terc-butil cetona.
7. El procedimiento de acuerdo con la reivindicación 6, en el que el disolvente cetónico es acetona.
8. El procedimiento de acuerdo con la reivindicación 1, en el que la sal de adición de ácido se prepara tratando el mezcla que contiene compuestos de la fórmula II con el ácido correspondiente en un disolvente.
9. El procedimiento de acuerdo con la reivindicación 8, en el que el ácido es un ácido inorgánico o un ácido orgánico.
10. El procedimiento de acuerdo con la reivindicación 9, en el que el ácido inorgánico es un haluro de hidrógeno, ácido nítrico o ácido fosfórico.
11. El procedimiento de acuerdo con la reivindicación 10, en el que el haluro de hidrógeno es cloruro de hidrógeno.
12. El procedimiento de acuerdo con la reivindicación 9, en el que el ácido orgánico es un ácido carboxílico o un ácido sulfónico.
13. El procedimiento de acuerdo con la reivindicación 12, en el que el ácido carboxílico está seleccionado entre ácido acético, ácido propanóico, ácido fórmico, ácido hidroxiacético, ácido 2-hidroxi propanóico, ácido 2-oxopropanóico, ácido propano dioico, ácido butanodioico, ácido (Z)-2-butenodioico, ácido (E)-2-butenodioico y ácido 2-hidroxi butanodioico.
14. El procedimiento de acuerdo con la reivindicación 12, en el que el ácido sulfónico está seleccionado entre ácido metano sulfónico, ácido tolueno sulfónico y ácido benceno sulfónico.
15. El procedimiento de acuerdo con la reivindicación 8, en el que el disolvente es un disolvente orgánico.
16. El procedimiento de acuerdo con la reivindicación 15, en el que el disolvente orgánico está seleccionado entre el grupo constituido por alcoholes de C1 a C5, cetonas de C3 a C8, ésteres de C2 a C8, acetonitrilo, tetrahidrofurano, dimetilformamida, dimetilsulfóxido, dioxano, hidrocarburos aromáticos, hidrocarburos halogenados de C1 a C5 y éteres de C2 a C8 y mezclas de los mismos.
17. El procedimiento de acuerdo con la reivindicación 16, en el que los disolventes alcohólicos son metanol, etanol, propanol y alcohol isopropílico; los disolventes cetónicos son acetona, metil etil cetona, metil isobutil cetona, metil terc-butil cetona y dietil cetona; los disolventes éster son acetato de etilo, acetato de metilo, acetato de isopropilo, acetato de terc-butil metilo y formiato de etilo; los disolventes hidrocarburados aromáticos son benceno, tolueno y xileno; los disolventes hidrocarburados halogenados son cloruro de metileno, cloroformo, tetracloruro de carbono y dicloruro de etileno; y los disolventes éter son terc-butil metil éter y éter dietílico.
18. El procedimiento de acuerdo con la reivindicación 16, en el que el disolvente orgánico está seleccionado entre metanol, etanol, propanol, alcohol isopropílico, acetona, metil etil cetona, metil isobutil cetona, metil terc-butil cetona, dietil cetona, acetonitrilo, dimetilformamida, dimetilsulfóxido y tetrahidrofurano.
19. El procedimiento de acuerdo con la reivindicación 18, en el que el disolvente orgánico es metanol, etanol o acetona.
20. El procedimiento de acuerdo con la reivindicación 1, en el que la cristalización fraccionada se lleva a cabo en condición anhidra.
21. El procedimiento de acuerdo con las reivindicaciones 1 y 20, en el que la cristalización se lleva a cabo mediante enfriamiento, adición de anti-disolventes, siembra o eliminación parcial de los disolventes o combinación de los mismos.
22. El procedimiento de acuerdo con la reivindicación 21, en el que la cristalización se lleva a cabo a aproximadamente 0ºC hasta 45ºC.
23.El procedimiento de acuerdo con la reivindicación 22, en el que la cristalización se lleva a cabo a aproximadamente 0ºC hasta 35ºC.
24. El procedimiento de acuerdo con la reivindicación 1, en el que las etapas (a) y (b) se realizan en el mismo disolvente o diferente disolvente.
25. El procedimiento de acuerdo con la reivindicación 24, en el que las etapas (a) y (b) se realizan en diferentes disolventes.
26. El procedimiento de acuerdo con la reivindicación 1, en el que las sales de adición de ácido de la fórmula I se preparan a partir de la masa de reacción obtenida como una parte de la síntesis de los compuestos de la fórmula II.
27. El procedimiento de acuerdo con las reivindicaciones 1 y 26, en el que las sales de adición de ácido del compuesto de la fórmula I preparado de acuerdo con la presente invención son sales de adición de haluro de hidrógeno de la fórmula III:
28. El procedimiento de acuerdo con la reivindicación 27, en el que la sal de haluro de hidrógeno de la fórmula III es sal de cloruro de hidrógeno.
29. Un procedimiento para la preparación de nebivolol o una sal aceptable farmacéuticamente del mismo, que comprende las etapas de:
a) hacer reaccionar 6-fluoro-3,4-dihidro-a-[[(fenilmetil)amino]metil]-2H-1-benzopiran-2-metanol con 6-fluoro-3,4-dihidro-2-oxiranil-2H-1-benzopirano en un disolvente de alcohol de C1 a C5 o de cetona de C3 a C8 para producir (
b) tratar el (
c) basificar la sal de (
d) someter la base libre de (
30. El procedimiento de acuerdo con la reivindicación 29, en el que el disolvente alcohólico está seleccionado entre el grupo constituido por alcoholes de C1 a C5.
31. El procedimiento de acuerdo con la reivindicación 30, en el que el disolvente alcohólico está seleccionado entre metanol, etanol, propanol y alcohol isopropílico.
32. El procedimiento de acuerdo con la reivindicación 31, en el que el disolvente alcohólico es etanol.
33. El procedimiento de acuerdo con la reivindicación 29, en el que el disolvente cetónico está seleccionado entre el grupo constituido por cetonas de C3 a C8.
34. El procedimiento de acuerdo con la reivindicación 33, en el que el disolvente cetónico está seleccionado entre acetona, metil isobutil cetona y metil terc-butil cetona.
35. El procedimiento de acuerdo con la reivindicación 34, en el que el disolvente cetónico es acetona.
36. El procedimiento de acuerdo con la reivindicación 29, en el que el haluro de hidrógeno es cloruro de hidrógeno.
37. El procedimiento de acuerdo con la reivindicación 36, en el que el tratamiento en la etapa (b) se lleva a cabo pasando cloruro de hidrógeno gas a través de la masa que contiene (
38. Sales de adición de ácido de las fórmulas I y II:
en la que:
P es -alilo o

en la que:
cada X independientemente es halo, nitro o alquilo de C1-C3 y n es 0 - 5;
en la que P es tal como se ha definido en la fórmula I.
39. Las sales de adición de ácido de la reivindicación 38, en las que dichas sales son sales de haluros de hidrógeno, sulfatos de hidrógeno, sulfatos y ácidos sulfónicos.
40. Las sales de adición de ácido de la reivindicación 39, en las que dichas sales son haluros de hidrógeno.
41. Las sales de adición de ácido de la reivindicación 40, en las que dichas sales son cloruro de hidrógeno, yoduro de hidrógeno y bromuro de hidrógeno.
42. Las sales de adición de ácido de la reivindicación 41, en la que dicha sal es cloruro de hidrógeno.
Patentes similares o relacionadas:
Derivado de urea o sal farmacológicamente aceptable del mismo, del 8 de Abril de 2020, de KYORIN PHARMACEUTICAL CO., LTD.: Un compuesto representado por la fórmula general (I) o un hidrato, un solvato o una sal farmacológicamente aceptable del mismo: **(Ver fórmula)** […]
Compuestos isoflavonoides y métodos para el tratamiento del cáncer, del 8 de Enero de 2020, de MEI Pharma, Inc: Una composición farmacéutica que comprende 3-(4-hidroxifenil)-4-(4-hidroxifenil)-8-metilcroman-7-ol: **(Ver fórmula)** en la que los […]
Composiciones de isoflavonoides y procedimientos para el tratamiento del cáncer, del 8 de Enero de 2020, de MEI Pharma, Inc: Composición farmacéutica que comprende: i) un compuesto de fórmula (II) o una sal farmacéuticamente aceptable del mismo: **(Ver fórmula)** en la que: […]
Derivado de cromano, del 31 de Julio de 2019, de TMS Co., Ltd: Un derivado de cromano que es un compuesto representado por la siguiente Fórmula (Ia):**Fórmula** donde, en la Formula (Ia), cada una de las Y1 […]
(6R,10R)-6,10,14-Trimetilpentadecan-2-ona preparada a partir de 6,10-dimetilundec-5-en-2-ona o 6,10-dimetilundeca-5,9-dien-2-ona, del 24 de Julio de 2019, de DSM IP ASSETS B.V.: Un proceso de fabricación de (6R,10R)-6,10,14-trimetilpentadecan-2-ona en una síntesis de múltiples etapas a partir de 6,10-dimetilundec-5-en-2-ona o 6,10-dimetilundeca-5,9-dien-2-ona […]
Compuestos de cromano sustituidos como moduladores de receptores sensores de calcio, del 12 de Junio de 2019, de LUPIN LIMITED: Un compuesto que tiene la Fórmula (V):**Fórmula** o una de sus sales farmacéuticamente aceptables; en la que, R1 se selecciona entre halógeno, alquilo […]
Agentes de contraste para obtención de imágenes de perfusión miocárdica, del 12 de Junio de 2019, de LANTHEUS MEDICAL IMAGING, INC: Un agente de contraste que tiene la fórmula:**Fórmula** en donde n, m, yo son independientemente 1, 2, 3 o 4; Z es O, S o NR46; R45 es alquilo […]
Un nuevo método de producción de clorhidrato de nebivolol de alta pureza, del 4 de Junio de 2019, de Corden Pharma International GmbH: Un procedimiento de producción de clorhidrato de nebivolol de fórmula I,**Fórmula** que comprende las etapas de: a. proporcionar un clorhidrato de nebivolol […]