PROCEDIMIENTO PARA LA LIMPIEZA DE CAPSULAS DE GELATINA DURA.
Procedimiento para la limpieza de la pared interna de cápsulas de gelatina dura para su uso en la terapia de inhalación,
caracterizado porque las cápsulas se limpian mediante sacudimiento con una formulación en polvo
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP02/06423.
Solicitante: BOEHRINGER INGELHEIM PHARMA GMBH & CO.KG.
Nacionalidad solicitante: Alemania.
Dirección: BINGER STRASSE 173,55216 INGELHEIM AM RHEIN.
Inventor/es: FREUDENBERGER, VOLKER, DR., WACHTEL,HERBERT, SCHMIDT-JOERG,PETRA.
Fecha de Publicación: .
Fecha Concesión Europea: 16 de Diciembre de 2009.
Clasificación Internacional de Patentes:
- A61J3/07B2
- A61K31/46 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Aza-8-biciclo[3.2.1]octano; Sus derivados, p. ej. atropina, cocaína.
Clasificación PCT:
- A61J3/07 A61 […] › A61J RECIPIENTES ESPECIALMENTE ADAPTADOS PARA USOS MEDICOS O FARMACEUTICOS; DISPOSITIVOS O METODOS ESPECIALMENTE CONCEBIDOS PARA CONFERIR A LOS PRODUCTOS FARMACEUTICOS UNA FORMA FISICA O DE ADMINISTRACION PARTICULAR; DISPOSITIVOS PARA ADMINISTRAR ALIMENTOS O MEDICINAS VIA ORAL; CHUPETES PARA BEBES; ESCUPIDERAS. › A61J 3/00 Dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular (aspectos químicos ver las clases correspondientes). › en forma de cápsulas o de pequeños recipientes similares que se administran vía oral.
Clasificación antigua:
Fragmento de la descripción:
Procedimiento para la limpieza de cápsulas de gelatina dura.
La invención se refiere a un procedimiento para la limpieza de la pared interna de cápsulas de gelatina dura.
Antecedentes de la invención
Condicionado por la producción de cápsulas de gelatina dura, la pared interna de estas cápsulas está cubierta de agentes lubricantes y/o de separación. Esto conduce a una adherencia incrementada de polvo en sus paredes internas el cual, en el caso de cápsulas para inhalación, no puede ser aportado al paciente. Adicionalmente, los parámetros "masa expulsada" y "proporción inhalable" se ven sometidos a una elevada gama de oscilación. El documento WO 96/01105 describe un procedimiento que comprende el revestimiento de la pared interna de la cápsula con polvo para la formación de una capa de adherencia sobre la capa de agentes lubricantes y de separación y la subsiguiente retirada del polvo en exceso. El uso de las cápsulas, así preparadas, en el inhalador de polvos conduce a una expulsión incrementada de la dosis de sustancia activa.
A partir del estado conocido de la técnica se sabe asimismo que cápsulas especiales, por ejemplo cápsulas CONI-SNAP® (razón social Capsugel), que presentan un revestimiento reducido de agentes lubricantes o de separación, son empleadas para fines de inhalación. Sin embargo, a escala técnica, la limpieza con disolventes es muy compleja y, por lo tanto, es adecuada sólo con condiciones. Además, se requiere un subsiguiente control del contenido en disolventes residuales. Es misión de la presente invención poner a disposición un procedimiento que posibilite la limpieza sencilla de la pared interna de cápsulas de gelatina dura para empleo en la terapia de inhalación.
Descripción detallada de la invención
Sorprendentemente, se encontró que en el caso de utilizar polvos adecuados como agentes de limpieza sin aditivos disolventes se puede eliminar de manera sencilla la capa de agente lubricante o de separación de las paredes internas de las cápsulas.
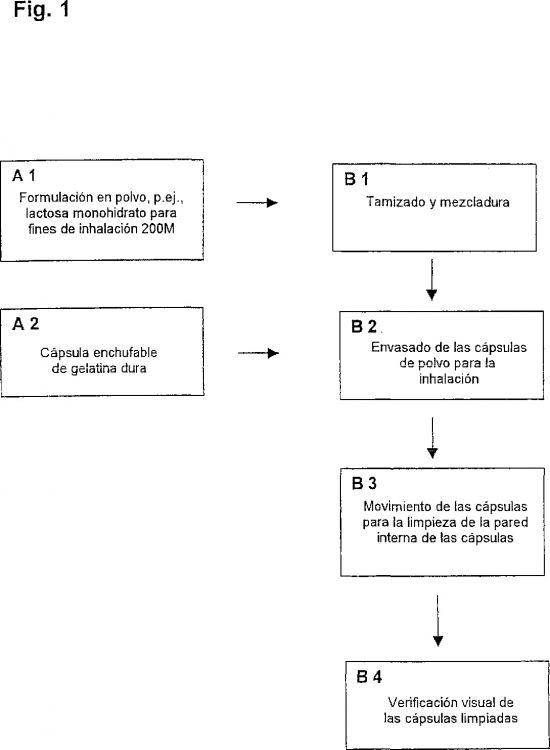
Por lo tanto, la invención se refiere a un procedimiento, aplicable a escala de laboratorio y asimismo técnicamente, para la limpieza de la pared interna de cápsulas de gelatina dura para empleo en la terapia de inhalación, siendo limpiadas las cápsulas mediante sacudimiento con una formulación en polvo.
Cápsulas adecuadas para el procedimiento de acuerdo con la invención son, por lo general, cápsulas de gelatina dura divisibles, consistentes en una parte superior y en una parte inferior, en las que, después de rellenar la parte inferior, se coloca la parte superior y la cápsula queda cerrada de esta manera. Cápsulas preferiblemente adecuadas son cápsulas enchufables de gelatina dura con cierre, preferiblemente cápsulas de gelatina dura exentas de polietilenglicol, de manera particularmente preferida cápsulas CONI-SNAP® del tamaño 3 (fabricante: Capsugel, Division of Warner Lambert N.V., Bélgica).
Se prefiere un procedimiento en el que la formulación en polvo sea farmacéuticamente compatible. La formulación en polvo puede contener uno o varios componentes. Componentes farmacéuticamente compatibles son, por ejemplo, lactosa, lactosa monohidrato, glucosa, sacarosa, manita y sorbita. Se prefiere particularmente un procedimiento en el que la formulación en polvo represente un componente de la formulación de sustancia activa. Componentes adecuados para la formulación en polvo de la formulación de sustancia activa son, por ejemplo, lactosa, lactosa monohidrato, glucosa, sacarosa, manita y sorbita, preferiblemente lactosa o lactosa monohidrato, en particular lactosa monohidra-to.
Se prefiere asimismo un procedimiento, en el que la formulación en polvo sea la formulación de sustancia activa para inhalación. Polvos para inhalación pueden contener, por ejemplo, las sustancias activas seleccionadas del grupo consistente en tiotropio, ácido cromoglicínico, reproterol, beclometasona, terbutalina, salbutamol, salmeterol, quetotifeno, orciprenalina, fluticasona, insulina, ipratropio, dexametasona, bambuterol, budesonida, fenoterol, clenbuterol, prednisolona, prednisona, prednilideno, metilprednisolona, formoterol, nedrocromil, así como una de sus sales o mezclas farmacéuticamente compatibles y otro preparado de cortisona o derivado de atropina adecuado para fines de inhalación, preferiblemente bromuro de ipratropio, bromuro de tiotropio y bromuro de tiotropio monohidrato, de manera particularmente preferida bromuro de tiotropio monohidrato.
Componentes típicos de polvos para inhalación son, junto a la sustancia activa, entre otros, lactosa, lactosa monohidrato o glucosa.
En particular, se prefiere un procedimiento en el que la limpieza se efectúe en cápsulas cerradas.
Es de particular importancia un procedimiento en el que la limpieza se efectúe sin empleo de disolventes.
Además, es de particular importancia un procedimiento, en el que la limpieza se efectúe en un mezclador de caída libre o en una mesa vibradora. Mezcladores de caída libre adecuados para el procedimiento de acuerdo con la invención son, por ejemplo, Rhönrad ELTE 560 o Rhönrad SA 1200 (razón social Engelsmann AG, Frankenthaler Straße 137-141, D 6700 Ludwigshafen/Rh), Turbula T2 C (razón social Bachofen AG, Basilea, Suiza) o Turbula T 10 B (razón social Bachofen AG, Basilea, Suiza), siendo particularmente adecuados Turbula T2 C o Turbula T 10B.
Además, es de particular importancia un procedimiento en el que la limpieza se efectúe a una temperatura de 15 a 50ºC, preferiblemente 17 a 40ºC, de preferencia 19 a 28ºC, de manera particularmente preferida a aproximadamente 22ºC.
Además, se prefiere particularmente un procedimiento, en el que una parte o todos los granos de la formulación en polvo acumulan impurezas.
Se prefiere, además, un procedimiento en el que una parte o todos los granos de la formulación en polvo acumulan agentes lubricantes y de separación. Agentes lubricantes y de separación de este tipo pueden contener, por ejemplo, ácido esteárico, estearato de magnesio, grasas, ceras, aceites o emulsionantes tales como lecitina de soja.
Además, se prefiere particularmente un procedimiento, en el que la cantidad de llenado de la formulación en polvo asciende a 6% (v/v) hasta 50% (v/v), preferiblemente a 10% (v/v) hasta 30% (v/v), preferiblemente a 15% (v/v) hasta 25% (v/v), de manera particularmente preferida a aproximadamente 20% (v/v) de la cantidad máxima de llenado de la cápsula.
Además, se prefiere particularmente un procedimiento, en el que la formulación en polvo contiene lactosa y/o lactosa monohidrato, preferiblemente lactosa monohidrato para fines de inhalación, preferiblemente lactosa monohidrato para fines de inhalación 200M. La lactosa monohidrato se puede adquirir, por ejemplo, de la razón social DMV International (Veghel/Holanda).
De acuerdo con la invención, se prefiere un procedimiento en el que la formulación en polvo contenga un coadyuvante con tamaños de partículas de un diámetro aerodinámico de 10 a 50 µm, (medido con un API Aerosizer LD mediante un método del tiempo de vuelo), por ejemplo lactosa monohidrato molida.
De acuerdo con la invención se prefiere particularmente un procedimiento, el cual abarca las etapas a) a e) consecutivas, en el que
La ventaja del procedimiento de acuerdo con la invención radica en la limpieza sencilla y económica de la pared interna de las cápsulas que, además, no requiere ningún control adicional del contenido en agente de limpieza, por ejemplo disolvente. En el caso de impurezas farmacológicamente compatibles de la pared interna de la cápsula, la limpieza puede efectuarse mediante la formulación de sustancia activa, de manera que la cápsula, después de la limpieza, no ha de ser abierta de nuevo, vaciada y llenada de nuevo con la formulación de sustancia activa. El proceso de limpieza garantiza también en este caso una...
Reivindicaciones:
1. Procedimiento para la limpieza de la pared interna de cápsulas de gelatina dura para su uso en la terapia de inhalación, caracterizado porque las cápsulas se limpian mediante sacudimiento con una formulación en polvo.
2. Procedimiento según la reivindicación 1, caracterizado porque la formulación en polvo es farmacéuticamente compatible.
3. Procedimiento según una de las reivindicaciones 1 ó 2, caracterizado porque la formulación en polvo representa un componente de la formulación de sustancia activa.
4. Procedimiento según una de las reivindicaciones 1 ó 2, caracterizado porque la formulación en polvo es la formulación de sustancia activa para inhalación.
5. Procedimiento según una de las reivindicaciones 1 a 4, caracterizado porque la limpieza se efectúa en cápsulas cerradas.
6. Procedimiento según una de las reivindicaciones 1 a 5, caracterizado porque la limpieza se efectúa sin empleo de disolventes.
7. Procedimiento según una de las reivindicaciones 1 a 6, caracterizado porque la limpieza se efectúa en un mezclador de caída libre o sobre una mesa vibratoria.
8. Procedimiento según una de las reivindicaciones 1 a 7, caracterizado porque la limpieza se efectúa a una temperatura de 15 a 50ºC.
9. Procedimiento según una de las reivindicaciones 1 a 8, caracterizado porque una parte o todos los granos de la formulación en polvo acumulan impurezas.
10. Procedimiento según una de las reivindicaciones 1 a 9, caracterizado porque una parte o todos los granos de la formulación en polvo acumulan agentes lubricantes y/o de separación.
11. Procedimiento según una de las reivindicaciones 1 a 10, caracterizado porque la cantidad de carga de la formulación en polvo asciende a 6% hasta 50% de la cantidad teórica total de llenado de las cápsulas.
12. Procedimiento según una de las reivindicaciones 1 a 11, caracterizado porque la formulación en polvo contiene al menos un coadyuvante con tamaños de partículas con un diámetro aerodinámico de 10 a 50 µm.
13. Procedimiento según una de las reivindicaciones 1 a 12, caracterizado porque la formulación en polvo contiene lactosa y/o lactosa monohidrato.
14. Procedimiento según una de las reivindicaciones 1 a 13, que abarca las etapas a) a e) consecutivas, en el que
Patentes similares o relacionadas:
Compuestos de 3-aminocicloalquilo como inhibidores de ROR-gamma-T y sus usos, del 17 de Febrero de 2020, de MERCK SHARP & DOHME CORP: Un compuesto según la fórmula I **Fórmula** o una de sus sales o solvatos farmacéuticamente aceptables, donde: a es una ausencia de enlace […]
Composiciones, métodos y sistemas para la administración respiratoria de dos o más agentes activos, del 11 de Diciembre de 2019, de Pearl Therapeutics, Inc: Una composicion farmaceutica que puede administrarse a partir de un inhalador de dosis medida, que comprende: un medio de suspension que comprende […]
Composiciones para el suministro respiratorio de agentes activos y métodos y sistemas asociados, del 11 de Diciembre de 2019, de Pearl Therapeutics, Inc: Una cosuspension que se puede obtener de un inhalador de dosis medida, comoprendiendo la cosuspension: un medio de suspension que comprende […]
Composiciones para administración pulmonar de antagonistas muscarínicos de acción prolongada y agonistas del receptor adrenérgico beta-2 de acción prolongada y métodos y sistemas asociados, del 20 de Noviembre de 2019, de Pearl Therapeutics, Inc: Una composicion farmaceutica que puede ser administrada desde un inhalador de dosis medida, que comprende: un medio de suspension que comprende un propulsor farmaceuticamente […]
Composiciones de películas sublinguales y orales, del 6 de Noviembre de 2019, de Indivior UK Limited: Una composición de dosificación de película que comprende: a. una matriz portadora polimérica; b. una cantidad terapéuticamente eficaz de buprenorfina […]
Antagonistas muscarínicos y combinaciones de estos para el tratamiento de enfermedades de las vías respiratorias en caballos, del 4 de Septiembre de 2019, de BOEHRINGER INGELHEIM VETMEDICA GMBH: Un antagonista muscarínico de acción prolongada (LAMA) o una sal farmacéuticamente aceptable del catión del mismo para uso en un método de tratamiento de […]
Modelo animal para ojo seco y métodos de uso de dichos animales, del 4 de Septiembre de 2019, de REGENERON PHARMACEUTICALS, INC.: Un método para inducir la enfermedad del ojo seco en un animal roedor, que comprende la administración de escopolamina y cloruro de benzalconio a dicho animal […]
Comprimidos sublinguales de disgregación rápida de sulfato de atropina, métodos para su fabricación, y métodos para su uso en el tratamiento de toxicidad aguda por organofosforados, del 28 de Agosto de 2019, de Nova Southeastern University: Un comprimido sublingual de disgregación rápida (RDST) que comprende sulfato de atropina, una carga, un superdisgregante y un lubricante.