PROCEDIMIENTO INDUSTRIAL PARA LA PREPARACION DE GAMMA-LACTONA DE ACIDO 17-HIDROXI-6-BETA, 7-BETA, 15-BETA, 16-BETA-BISMETILEN-3-OXO-17-ALFA-PREGN-4-ENO-21-CARBOXILICO E INTERMEDIOS CLAVE PARA ESTE PROCEDIMIENTO.
Procedimiento industrial para la preparación de ?-lactona de ácido 17-hidroxi-6ß,
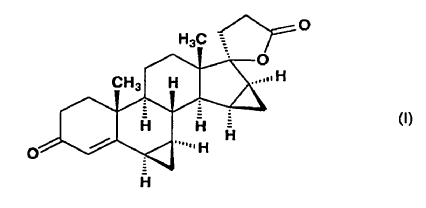
7ß;15ß,16ß-bismetilen-3-oxo-17a-pregn-4-eno-21-carboxílico de fórmula (I),
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/HU2005/000110.
Solicitante: RICHTER GEDEON NYRT.
Nacionalidad solicitante: Hungría.
Dirección: GYOMROI UT 19-21,1103 BUDAPEST.
Inventor/es: HORVATH, JUDIT, TUBA, ZOLTAN, BALOGH, GABOR, MAHO, SANDOR, BODI,JOZSEF, ARANYI,ANTAL, GALIK,GYORGY, SOROS,BELA.
Fecha de Publicación: .
Fecha Concesión Europea: 19 de Mayo de 2010.
Clasificación Internacional de Patentes:
- C07J53/00C1D
Clasificación PCT:
- C07J53/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07J ESTEROIDES (seco-steroides C07C). › Esteroides teniendo la estructura del ciclopenta [a] hidrofenantreno modificada por condensación con ciclos carbocíclicos o por formación de un ciclo adicional por un enlace directo entre dos átomos de carbono cíclicos.
Fragmento de la descripción:
Procedimiento industrial para la preparación de ?-lactona de ácido 17-hidroxi-6ß,7ß,15ß,16ß-bismetilen-3-oxo-17a-pregn-4-eno-21-carboxílico e intermedios clave para este procedimiento.
El objeto de la invención es un proceso industrial para la preparación de ?-lactona de ácido 17-hidroxi-6ß,7ß,15ß, 16ß-bismetilen-3-oxo-17a-pregn-4-eno-21-carboxílico (en adelante, drospirenona) de fórmula (I), así como los productos intermedios claves para la síntesis.
El compuesto de fórmula (I) es conocido con el nombre de drospirenona en la terapia y se tratade una progestina sintética que tiene también efectos antimineralocorticoides y antiandrogénicos. Combinada con etinilestradiol se comercializa bajo el nombre Yasmin como contraceptivo oral.
Para la preparación de drospirenona se conocen diversos procesos en la literatura química, los cuales difieren en el material de partida utilizado y en el orden de las etapas de reacción. La introducción de los grupos funcionales se lleva a cabo por métodos químicos conocidos. Todos los procesos son adecuados para la utilización a escala de laboratorio y su ampliación a escala industrial puede implicar diversos problemas inesperados.
Se describe en primer lugar una síntesis de drospirenona en la especificación de patente alemana DE 2.652.761. La síntesis comienza a partir de 3ß-hidroxi-15ß,16ß-metilenandrost-5-en-17-ona, que se somete a reacción con 1-bromo-3,3-dimetoxipropano en tetrahidrofurano, en presencia de litio, seguido de ciclación en la posición 17 en ácido acético al 70%, para producir el "lactol-éter". Los grupos hidroxilo y éter presentes en la mólécula se oxidan con ciclohexanona en presencia de isopropilato de aluminio, luego se izomeriza el doble enlace con ácido sulfúrico 2N, para producir la ?-lactona de ácido 17-hidroxi-15ß,16ß-metilen-3-oxo-17a-pregn-4-eno-21-carboxílico.
El derivado "lactona" se somete a reacción con cloranil (2,3,5,6-tetracloro-2,5-ciclohexadien-1,4-diona) en tert-butanol para formar el "3-oxoandrosta-4,6-dieno", en el que se introduce un grupo metileno en las posiciones 6, 7 (utilizando de yoduro de trimetilsulfoxonio e hidruro de sodio, produciendo un "metiluro" in situ), dando lugar a la drospirenona.
Para la preparación de 3ß-hidroxi-15ß,16ß-metilenandrost-5-eno-17-ona (material de partida para la síntesis mencionada anteriormente), en la especificación de patente alemana DE 1.593.500 se describe una vía de reacción en cinco etapas.
La primera síntesis de drospirenona incluye varias reacciones que no se pueden trasladar a escala industrial y produce rendimientos típicamente bajos. La purificación de los intermedios y el producto final obtenido por cromatografía produce también rendimientos bajos (40%, 26% y 16% respectivamente).
En la especificación de patente alemana DE 2.746.298, se describen los intermedios que se pueden utilizar también para la preparación de drospirenona. Para formar los dobles enlaces (que son necesarios para la introducción de los grupos metileno), primero se introdujeron los grupos hidroxilo en la molécula mediante un proceso microbiológico. La dehidroepiandrosterona -material de partida para la síntesis- fue hidroxilada microbiológicamente para producir 3ß-7a,15a-trihidroxiandrost-5-eno-17-ona, que, a su vez, fue oxidada en una etapa adicional de fermentación, para producir 7a,15a-dihidroxiandrost-4-eno-3,17-diona. La eliminación del grupo hidroxilo en la posición 15 se llevó a cabo con el catalizador ácido p-toluensulfónico, produciendo el "4,6,15-trieno".
Cuando el derivado 7a,15a-dihidroxilado se acetiló con anhídrido acético en piridina, se obtuvo, en una etapa, 3-acetoxi-7a-hidroxiandrost-5,15-dieno-17-ona, se introdujo a dicho compuesto una parte metileno en las posiciones 15, 16 mediante el proceso expuesto más arriba, se oxidó microbiológicamente el compuesto obtenido y, tras la eliminación de agua, se obtuvo la 15ß,16ß-metilenandrosta-4,6-dieno-3,17-diona. Después, el compuesto que tenía la estructura "dieno" en los anillos AB del esteroide fue tratado con etilenglicol, en presencia de ortoformiato de trialquilo y el catalizador ácido p-toluensulfónico, para producir el cetal de forma conocida, se sometió a reacción dicho cetal con dimetoxibromopropano en presencia de litio tal como se ha descrito anteriormente para producir el "17-acetal", que fue ciclado entonces para formar el "lactol-metil éter" correspondiente y el conjunto se sometió a oxidación de Jones para producir la "lactona" correspondiente. El intermedio así obtenido tenía un doble enlace en la posición 6,7, en el que se puede introducir de forma conocida un grupo metileno.
Teóricamente, se describe otra vía de síntesis para la preparación de drospirenona en la especificación de patente europea EP 051 143 y sus equivalentes (US 4.416.985 y US 4.614.616). El proceso está publicado también en Angew. Chem. 94, 718-719 (1982). La novedad radica en que el grupo 6ß,7ß-metileno se forma de forma estereoespecífica mediante la reacción de Simmons-Smith.
El material de partida del proceso es 3ß-hidroxi-15ß,16ß-metilenandrost-5-eno-17-ona. El hidroxilo en la posición 7ß se introduce en un proceso de fermentación utilizando Botryodiplodia malorum, se acetila el compuesto resultante de forma regioselectiva con anhídrido piválico en presencia de 4-dimetilaminopiridina, produciendo el derivado 3ß-pivaloiloxi. Dicho derivado pivaloiloxi se somete a reacción con hidroperóxido de tert-butilo en presencia del catalizador VO (acetonilacetonato)2, para producir el derivado 5ß,6ß-epoxi, que, a su vez, se somete a reacción con trifenilfosfina y tetracloruro de carbono en diclorometano para producir el derivado 7a-cloro. Dicho derivado 7a-cloro se somete a una reacción con zinc en una mezcla de ácido acético y tetrahidrofurano, produciendo la 5ß-hidroxi-15ß,16ß-metilen-3ß-pivaloiloxiandrost-6-eno-17-ona, que se hidroliza entonces con hidróxido de potasio para producir 3ß,5ß-dihidroxi-15ß,16ß-metilenandrost-6-eno-17-ona.
En el compuesto que tiene un doble enlace en la posición 6 se introduce el grupo metileno utilizando diyodometano en presencia de zinc, en el disolvente etilenglicol dimetil éter, y el derivado "6ß,7ß;15ß,16ß-dimetileno" así obtenido se propinila en la posición 17 en presencia de etilato de potasio en tetrahidrofurano. Dicho 17a-(3-hidroxi-1-propinil)-6ß,7ß;15ß,16ß-dimetilenandrostan-3ß,5ß,17ß-triol se hidrogena en una mezcla de tetrahidrofurano, metanol y piridina en presencia del catalizador Pd/CaCO3 o Pd/C y el compuesto obtenido se oxida, lactoniza y deshidrata en una etapa con trióxido de cromo en piridina acuosa.
De acuerdo con la EP 0 051 143, en lugar del grupo protector pivaloiloxi, es también adecuado el sustituyente tert-butil dimetilsililo, dimetil-(3-metilbutil)-sililo o tribencilsililo.
Más allá de que la síntesis consista en 15 etapas, la realización de la misma a escala industrial puede estar acompañada de varios problemas. En la etapa de epoxidación, la utilización de hidroperóxido de tert-butilo en grandes cantidades es peligrosa. Cuando se aplica polvo de zinc en un sistema heterogéneo bajo fuerte agitación, es necesario un aparato especial. El perclorato de sodio es un material peligroso, el tetracloruro de carbono como reactivo ya no se puede utilizar incluso a escala de laboratorio, mientras que el etilato de potasio es inflamable. En base a los experimentos, cuando un grupo etinilo es hidrogenado, aparte del producto completamente hidrogenado, siempre están presentes impurezas parcialmente hidrogenadas y dichas impurezas sólo se pueden separar con una pérdida considerable de compuesto útil ya sea una cadena recta o una cíclica.
Las especificaciones de patentes tanto EP 075 189 como US 4.435.327 se refieren a procesos sintéticos/microbioló- gicos combinados. El material de partida para la síntesis es, de nuevo, dehidroepiandrosterona, que es dihidroxilada mediante un proceso de fermentación (Colletotrichum phomodies) para producir la 3ß,7a,15a-trihidroxiandrost-5-en-17-ona; el sustituyente hidroxilo en la posición 7 de dicho compuesto es epimerizado entonces con ácido perclórico al 35% como catalizador, por ejemplo en una mezcla de acetona y diclorometano; finalmente el derivado 3ß,7ß,15a-trihidroxilo se somete a reacción con cloruro de pivaloílo en piridina, en presencia del catalizador 3-dimetilaminopiridina, para producir el derivado 3,15-pivaloilo. Se describe también un proceso alternativo para la preparación del compuesto.
Las...
Reivindicaciones:
1. Procedimiento industrial para la preparación de ?-lactona de ácido 17-hidroxi-6ß,7ß;15ß,16ß-bismetilen-3-oxo-17a-pregn-4-eno-21-carboxílico de fórmula (I),
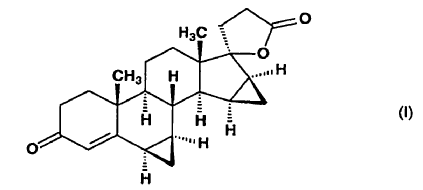
obtenida a partir de la conocida la 15a-hidroxiandrost-4-eno-3,17-diona de fórmula (III), caracterizado porque la 15a-hidroxiandrost-4-eno-3,17-diona de fórmula (III)
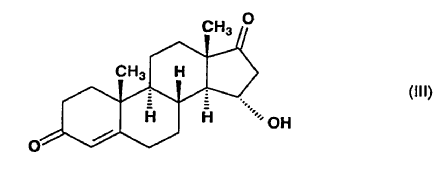
es esterificada sobre el hidroxi en la posición 15 con un derivado reactivo de un ácido alcanoico(C1-6) para producir una 15a-aciloxiandrost-4-eno-3,17-diona de fórmula general (IV),
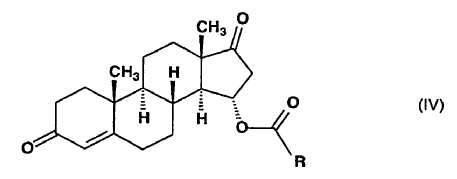
en la que R representa un átomo de hidrógeno o un grupo alquilo de 1-5 átomos de carbono,
y dicho compuesto de fórmula general (IV) se somete a reacción, en presencia de un catalizador ácido, con un ortoformiato de trialquilo que tiene 1-4 átomos de carbono en las partes alquilo, para producir el 15a-aciloxi-3-alcoxiandrosta-3,5-dieno-17-ona de fórmula general (V),
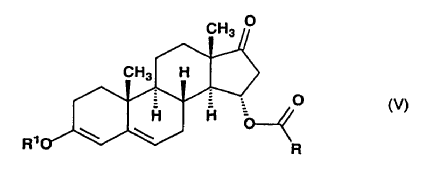
en la que R tiene el mismo significado definido anteriormente y R1 representa un grupo alquilo de 1-4 átomos de carbono,
dicho compuesto de fórmula general (V) se somete a reacción con metiluro de trimetilsulfoxonio preparado in situ en sulfóxido de dimetilo a partir de una sal de trimetilsulfoxonio y un hidróxido de metal alcalino, para producir la 15ß,16ß-metilen-3-alcoxiandrosta-3,5-dieno-17-ona de fórmula general (VI),
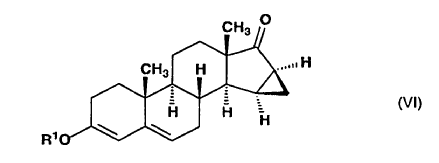
en la que R1 tiene el mismo significado definido anteriormente,
dicho compuesto de fórmula general (VI) se somete a reacción, en presencia de litio metal, con 2-(2-bromoetil)-1,3-dioxolano ó con un 2-(2-bromoetil)-dialcoxi-acetal que tiene 1-4 átomos de carbono en las partes alcoxi, para producir 1,2-etanodiil-acetal cíclico de 17-hidroxi-15ß,16ß-metilen-3-alcoxi-17a-pregna-3,5-dieno-21-carboxaldehído o dialcoxiacetal de 17-hidroxi-15ß,16ß-metilen-3-alcoxi-17a-pregna-3,5-dieno-21-carboxaldehído de fórmula general (VII),
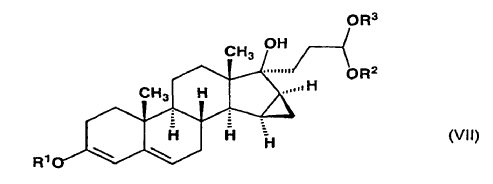
en la que R1 tiene el mismo significado definido anteriormente y R2 y R3 representan un grupo alquilo de 1-4 átomos de carbono o forman juntos un grupo 1,2-etileno,
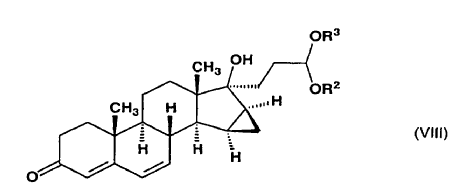
y dicho compuesto de fórmula general (VII) se oxida con cloranil (2,3,5,6-tetracloro-2,5-ciclohexadieno-1,4-diona) para formar 1,2-etanodiil-acetal cíclico de 17-hidroxi-15ß,16ß-metilen-3-oxo-17a-pregna-4,6-dieno-21-carboxaldehído o dialcoxiacetal de 17a-hidroxi-15ß,16ß-metilen-3-oxo-17a-pregna-4,6-dieno-21-carboxaldehído de fórmula general (VIII),
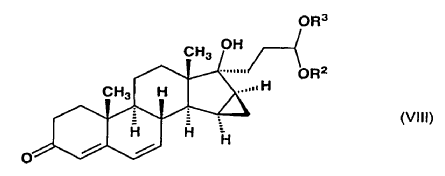
en la que R2 y R3 tienen el mismo significado definido anteriormente,
dicho compuesto de fórmula general (VIII)
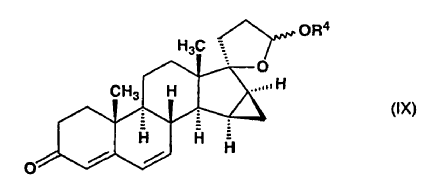
a) se cicla en un medio ácido para formar 15ß,16ß-metilen-3-oxoandrosta-4,6-dieno-[17(ß-1)spiro5']-perhidrofurano-2'?-ol alquil éter de fórmula general (IX),
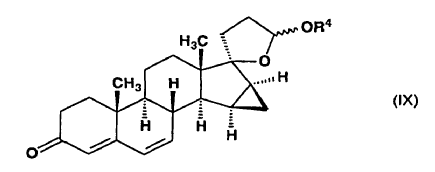
en la que R4 representa un grupo metilo, etilo o propilo y el enlace ~ representa la configuración a o ß,
y dicho compuesto de fórmula (IX) se somete a reacción con metiluro de trimetilsulfoxonio preparado in situ en sulfóxido de dimetilo a partir de una sal de trimetilsulfoxonio y un hidróxido de metal alcalino, o
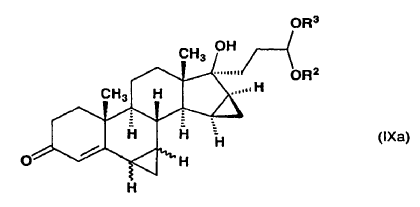
b) se somete a reacción con metiluro de trimetilsulfoxonio preparado in situ en sulfóxido de dimetilo a partir de una sal de trimetilsulfoxonio y un hidróxido de metal alcalino para producir un derivado bismetilen de fórmula general (IXa)
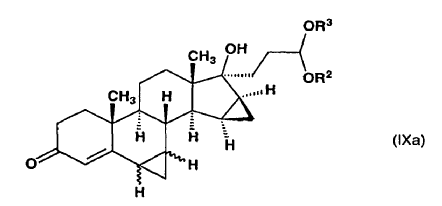
en la que R2 y R3 tienen el mismo significado definido anteriormente y el enlace ~ representa la configuración a o ß,
y dicho compuesto de fórmula (IXa) se cicla en un medio ácido,
y después, a partir de la mezcla de 6?,7?;15ß,16ß-bismetilen-3-oxo-androst-4-eno-[17(ß-1)spiro5']-perhidrofurano-2'?-ol alquil éter de fórmula general (X) obtenida al final en una cualquiera de las secuencias de la etapa alternativa anterior,
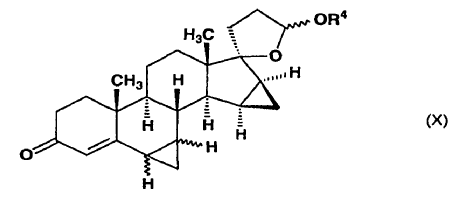
en la que R4 representa un grupo metilo, etilo o propilo y el enlace ~ representa la configuración a o ß,
el isómero 6ß,7ß se separa mediante cromatografía y se oxida con el reactivo de Jones para producir drospirenona, o
la mezcla de 6?,7?;15ß,16ß-bismetilen-3-oxoandrost-4-eno-[17(ß-1)spiro5']-perhidrofurano-2'?-ol alquil éter de fórmula general (X) obtenida al final en una cualquiera de las secuencias de la etapa alternativa anterior, en la que R4 representa un grupo metilo, etilo o propilo y el enlace ~ representa la configuración a o ß, se oxida con el reactivo de Jones para producir 6?,7?;15ß,16ß-bismetilen-3-oxoandrost-4-eno-[17(ß-1)spiro5']-perhidrofurano-2'-ona (?-lactona de ácido 17-hidroxi-6?,7?;15ß,16ß-bismetilen-3-oxo-17a-pregn-4-eno-21-carboxílico) de fórmula general (XI),
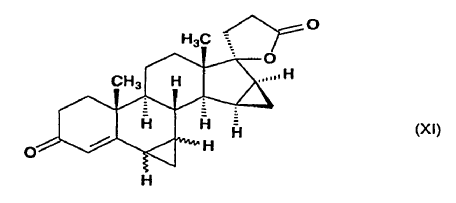
en la que el enlace ~ representa la configuración a o ß,
y a partir de esta mezcla isomérica se aísla el isómero 6ß,7ß, y si así se desea, la drospirenona de fórmula (I) obtenida por una cualquiera de las vías de síntesis anteriores se purifica por cristalización.
2. Procedimiento según la reivindicación 1, caracterizado porque la separación por cromatografía de los productos isoméricos de fórmula general (XI), en la que el enlace ~ representa la configuración a o ß, se lleva a cabo en un adsorbente de gel de sílice.
3. Procedimiento según la reivindicación 1, caracterizado porque la separación por cromatografía de los productos isoméricos de fórmula general (XI), en la que el enlace ~ representa la configuración a o ß, se lleva a cabo en dos etapas, es decir, en una etapa de precromatografía y en una etapa de cromatografía fina.
4. Procedimiento según la reivindicación 1, caracterizado porque la separación por cromatografía de los productos isoméricos de fórmula general (XI), en la que el enlace ~ representa la configuración a o ß, se lleva a cabo con una mezcla ciclohexano/acetato de etilo/acetona en una relación 64:18:18 en volumen o una mezcla ciclohexano/acetato de etilo/ acetonitrilo en una relación 55:35:10 en volumen o una mezcla ciclohexano/metil tert-butil éter/acetona en una relación 50:30:20 en volumen o una mezcla ciclohexano/acetona en una relación 73:27 en volumen o una mezcla diisopropil éter/acetato de etilo/diclorometano en una relación 57:33:10 en volumen como eluyente.
5. Procedimiento según la reivindicación 1, caracterizado porque la drospirenona de fórmula (I) se cristaliza a partir de metanol, etanol, propanol, isopropanol, acetato de etilo, o a partir de una mezcla de disolventes que contiene agua hasta un 10% en volumen seleccionada de entre metanol/agua, etanol/agua, propanol/agua, isopropanol/agua; una mezcla acetona/diisopropil éter que contiene acetona hasta un 50% en volumen; una mezcla ciclohexano/acetato de etilo que contiene acetato de etilo hasta un 50% en volumen; una mezcla diclorometano/diisopropil éter que contiene diclorometano hasta un 10% en volumen; y una mezcla diclorometano/hexano que contiene diclorometano hasta un 10% en volumen.
6. 6?,7?;15ß,16ß-bismetilen-3-oxoandrost-4-eno-[17(ß-1)spiro5']-perhidrofurano-2'?-ol alquil éteres de fórmula general (X), donde R4 representa un grupo metilo, etilo o propilo y el enlace ~ representa la configuración a o ß, como intermedios para el procedimiento según la invención.
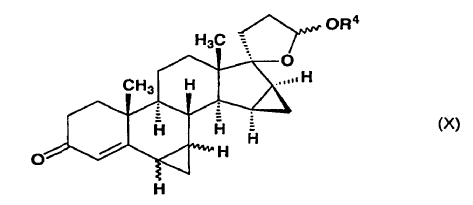
7. 15ß,16ß-metilen-3-oxoandrosta-4,6-dieno-[17(ß-1)spiro5']-perhidrofurano-2'?-ol alquil éteres, donde R4 representa un grupo propilo y el enlace ~ representa la configuración a o ß, como intermedios para el procedimiento según la invención.
8. Derivados de bismetileno de fórmula general (IXa), caracterizados porque R2 y R3 forman juntos un grupo 1,2-etileno y el enlace ~ representa la configuración a o ß, como intermedios para el procedimiento según la invención.
9. Derivados de acetal de 17-hidroxi-15ß,16ß-metilen-3-oxo-17a-pregna-4,6-dieno-21-carboxaldehído de fórmula general (VIII), donde R2 y R3 forman juntos un grupo 1,2-etileno, como intermedios para el procedimiento según la invención.
10. Intermedios siguientes utilizados en el procedimiento según la invención:
15a-pivaloiloxiandrost-4-eno-3,17-diona
15a-pivaloiloxi-3-metoxiandrosta-3,5-dieno-17-ona
15a-acetoxi-3-etoxiandrosta-3,5-dieno-17-ona
yoduro de dimetil-[(3-metoxi-17-oxoandrosta-3,5-dieno-15ß-il)metil]sulfoxonio
1,2-etanodiil-acetal cíclico de 17-hidroxi-15ß,16ß-metilen-3-metoxi-17a-pregna-3,5-dieno-21-carboxaldehído
1,2-etanodiil-acetal cíclico de 17-hidroxi-15ß,16ß-metilen-3-etoxi-17a-pregna-3,5-dieno-21-carboxaldehído
Dietil-acetal de 17-hidroxi-15ß,16ß-metilen-3-metoxi-17a-pregna-3,5-dieno-21-carboxaldehído
1,2-etanodiil-acetal cíclico de 17-hidroxi-15ß,16ß-metilen-3-oxo-17a-pregna-4,6-dieno-21-carboxaldehído
15ß,16ß-metilen-3-oxoandrosta-4,6-dieno-[17(ß-1')spiro-5']-perhidrofurano-2'?-ol propil éter
6?,7?;15ß,16ß-bismetilen-3-oxoandrost-4-eno-[17(ß-1')spiro-5']-perhidrofurano-2'?-ol metil éter
6?,7?;15ß,16ß-bismetilen-3-oxoandrost-4-eno-[17(ß-1')spiro-5']-perhidrofurano-2'?-ol propil éter
6ß,7ß;15ß,16ß-bismetilen-3-oxoandrost-4-eno-[17(ß-1')spiro-5']-perhidrofurano-2'?-ol metil éter
6ß,7ß;15ß,16ß-bismetilen-3-oxoandrost-4-eno-[17(ß-1')spiro-5']-perhidrofurano-2'?-ol propil éter
1,2-etanodiil-acetal cíclico de 17-hidroxi-6?,7?;15ß,16ß-bismetilen-3-oxo-17a-pregna-4-eno-21-carboxaldehído.
Patentes similares o relacionadas:
18-METIL-19-NOR-ANDROST-4-EN-17,17-ESPIROÉTERES (18-METIL-19-NOR-20-ESPIROX-4-EN-3-ONAS), ASÍ COMO PREPARACIONES FARMACÉUTICAS QUE LOS CONTIENEN, del 28 de Abril de 2011, de BAYER SCHERING PHARMA AKTIENGESELLSCHAFT: 18-metil-15ß,16ß-metilen-19-nor-20-espirox-4-en-3-onas de la fórmula general I **Fórmula** en donde Fórmula I Z es un átomo de oxígeno, dos átomos de hidrógeno, […]
PROCEDIMIENTO PARA LA PREPARACIÓN DE DROSPIRENONA, del 1 de Abril de 2011, de INDUSTRIALE CHIMICA S.R.L.: Procedimiento para la preparación de drospirenona, que comprende la oxidación de 17α-(3-hidroxipropil)6β, 7β,115aβ,16β-dimetilen-5β-androstan-3β,5,17β-triol […]
PROCEDIMIENTO DE PREPARACIÓN DE DROSPIRENONA, del 29 de Marzo de 2011, de NEWCHEM S.P.A: Un procedimiento para la preparación de 6 ,7 ,15 ,16 -dimetilen-3-oxo-17 -pregn-4-en-21,17-carbolactona (I) que comprende las siguientes etapas: 1) hacer reaccionar […]
PROCESO PARA LA PREPARACION DE LAMBDA-LACTONA DE ACIDO 17-HIDROXI-6-BETA,7-BETA; 15-BETA,16-BETA-BISMETILEN-17 ALFA-PREGN-4-ENO-3-ONA 21-CARBOXILICO Y DE INTERMEDIOS CLAVE PARA ESTE PROCESO, del 14 de Julio de 2010, de RICHTER GEDEON NYRT: Proceso para la preparación de ?-lactona de ácido 17-hidroxi-6ß,7ß; 15ß,16ß-bismetilen-3-oxo-17a-pregn-4-eno-21-carboxílico de fórmula (I):
PROCEDIMIENTO PARA LA PREPARACION DE 6BETA,7BETA;15BETA,16BETA-DIMETILEN-5BETA-HIDROXI-3-OXO-17ALFA-ANDROSTANO-21,17-CARBOLACTONA, del 6 de Abril de 2010, de SCHERING AKTIENGESELLSCHAFT: Procedimiento para la preparación de 6ß,7ß;15ß,16ß-dimetilen-5ß-hidroxi-3-oxo-17a-androstano-21,17-carbolactona (5ß-OH-DRSP) por oxidación del 17a-(3-hidroxi-1-propil)-6ß,7ß;15ß,16ß-dimetilen-5ß-androstano-3ß,5,17ß-triol […]
18-METIL-19-NOR-17-PREGN-4-ENO-21,17-CARBOLACTONAS, ASI COMO PREPARADOS FARMACEUTICOS QUE CONTIENEN ESTOS COMPUESTOS, del 29 de Diciembre de 2009, de BAYER SCHERING PHARMA AKTIENGESELLSCHAFT: 18-metil-19-nor-17-pregn-4-eno-21,17-carbolactonas de la fórmula general I **(Ver fórmula)** en la que Z significa un átomo de oxígeno, dos átomos de hidrógeno, una […]
Método para la separación de los constituyentes isoprénicos de guayule, del 6 de Noviembre de 2019, de versalis S.p.A: Método para la separación de al menos un constituyente isoprénico de la resina de una planta de guayule y/o de tipo guayule que comprende las etapas de: […]
 Composición farmacéutica que comprende una suspensión acuosa de un derivado de androstano para el tratamiento de afecciones inflamatorias y alérgicas, del 11 de Febrero de 2019, de GLAXO GROUP LIMITED: Una formulación farmacéutica que comprende:
(i) una suspensión acuosa de un compuesto en partículas de fórmula (I)**Fórmula**
o un solvato de […]
Composición farmacéutica que comprende una suspensión acuosa de un derivado de androstano para el tratamiento de afecciones inflamatorias y alérgicas, del 11 de Febrero de 2019, de GLAXO GROUP LIMITED: Una formulación farmacéutica que comprende:
(i) una suspensión acuosa de un compuesto en partículas de fórmula (I)**Fórmula**
o un solvato de […]