PROCEDIMIENTO PARA LA INACTIVACIÓN DE VIRUS CON ENVOLTURA LIPÍDICA.
Preparación viral que contiene virus inactivados, caracterizada porque los virus totales,
en particular las proteínas de envoltura virales, están intactos y presentan una integridad estructural y los virus proceden de un sobrenadante de cultivo celular, conteniendo la preparación un detergente no iónico del grupo de los polisorbatos, en particular Tween® 80, Tween® 20, Tween® 60, Tween® 40 y combinaciones de los mismos, oscilando la concentración del detergente no iónico del grupo de los polisorbatos entre el 10% y el 20%, preferentemente entre el 10% y el 15%
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E05112299.
Solicitante: BAXTER HEALTHCARE SA.
Nacionalidad solicitante: Suiza.
Dirección: THURGAUERSTRASSE 130 8152 GLATTPARK (OPFIKON) SUIZA.
Inventor/es: DORNER, FRIEDRICH, BARRETT, NOEL, KISTNER, OTFRIED, DR..
Fecha de Publicación: .
Fecha Solicitud PCT: 12 de Febrero de 1998.
Fecha Concesión Europea: 18 de Agosto de 2010.
Clasificación Internacional de Patentes:
- A61K39/12 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Antígenos virales.
- A61K39/145 A61K 39/00 […] › Orthomyxoviridae, p. ej. virus de la influenza.
- A61K39/155 A61K 39/00 […] › Paramyxoviridae, p. ej. virus de la parainfluenza.
- A61K39/21 A61K 39/00 […] › Retroviridae, p. ej. virus de la anemia infecciosa equina.
- A61K39/245 A61K 39/00 […] › Herpetoviridae, p. ej. virus del herpes simple.
- C12N7/06 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 7/00 Virus, p. ej. bacteriófagos; Composiciones que los contienen; Su preparación o purificación (preparaciones de uso médico que contienen virus A61K 35/76; preparación de composiciones de uso médico que contienen antígenos o anticuerpos virales, p. ej. vacunas virales, A61K 39/00). › por tratamiento químico.
Clasificación PCT:
Clasificación antigua:
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Italia, Liechtensein, Países Bajos, Suecia, Finlandia.
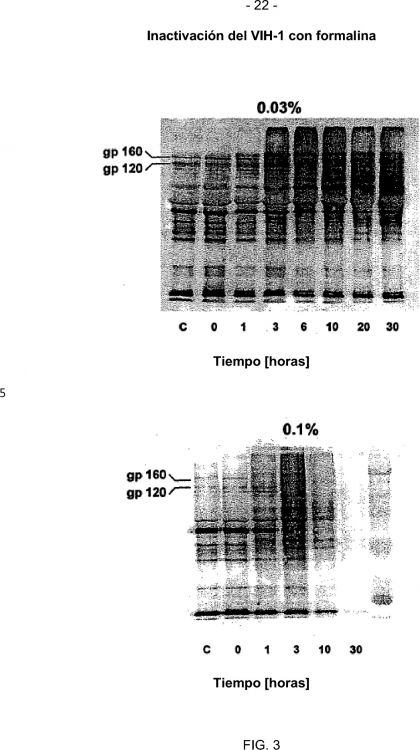
Fragmento de la descripción:
La invención se refiere a una preparación viral que contiene virus inactivados.
El desarrollo de vacunas eficientes para la profilaxis de enfermedades infecciosas virales ha sido uno de los objetivos principales de la medicina en las últimas décadas. Para la producción de vacunas de virus vivos se utilizan mutantes virales que tienen antígenos idénticos a los del virus de tipo salvaje pero que presentan una patogenicidad o virulencia reducida.
Para la producción de vacunas muertas los virus de tipo salvaje se inactivan mediante tratamiento físico o químico, por ejemplo con formalina, hidroxilamina, -propiolactona o rayos UV, siendo importante el tipo de inactivación, sobre todo en cuanto a la conservación de la inmunogenicidad de los antígenos virales. La técnica más utilizada para la inactivación viral en la producción de vacunas consiste en el tratamiento suave de los virus con formalina, pero éste requiere un tiempo de incubación largo, de hasta 15 días (por ejemplo en el caso del VHA), para lograr una reducción suficiente de la actividad viral.
En general, las vacunas de virus completo estimulan el desarrollo de anticuerpos circulantes contra las proteínas de envoltura del virus. Por ello, siempre se hace hincapié en que en el proceso de inactivación ha de asegurar el mantenimiento de la inmunogenicidad de las proteínas virales. Sin embargo, al mismo tiempo, también se ha de asegurar que todos los virus de la preparación estén inactivados para garantizar una vacuna segura.
Debido a algunos incidentes con vacunas de virus completo inactivados de forma incompleta o a contaminaciones en la preparación de la vacuna con componentes celulares o partículas virales no deseadas, se han buscado procedimientos de inactivación alternativos (Horaud, Develop. Biol. Standard. 75 (1991), 3-7; Brown, Develop. Biol. Standard. 81 (1993), 103-107).
Dado que la inactivación con formalina no siempre es completa y en algunas preparaciones de vacuna se han detectado virus infecciosos remanentes (Smith y col., Am. J. Hyg. 63 (1956), 150-164), Mussgay y col., Intervirology 1 (1973), 259-268) se ha propuesto un procedimiento de inactivación en dos etapas donde, después de una inactivación con formalina, se lleva a cabo un tratamiento con Tween 80/éter, NP 40 o desoxicolato. Sin embargo, se ha comprobado que el tratamiento adicional con el detergente o el disolvente/detergente influía negativamente en las propiedades protectoras de la vacuna inactivada con formalina.
Por ello, como alternativa a las vacunas que contienen virus completos inactivados, en los últimos años se han venido desarrollando vacunas de subunidades. En la producción de vacunas de subunidades, el virus intacto se solubiliza con un detergente fuerte, las proteínas virales se separan del virus por disolución y se aíslan los antígenos selectivos capaces de estimular anticuerpos protectores, que se utilizan para la producción de vacunas. Al mismo tiempo se eliminan proteínas no virales y componentes de la membrana viral, que probablemente podrían tener efectos secundarios no deseados en la administración de la vacuna. Igualmente, la vacuna puede contener los antígenos aislados para la vacuna de subunidades en forma altamente purificada y en alta concentración. Sin embargo, la inmunogenicidad se puede reducir en comparación con una vacuna de virus completo, ya que sólo hay disponibles algunos antígenos como inmunógenos.
Por ello, para inducir una respuesta inmune suficiente con la vacunación, se han producido las llamadas vacunas split (de virus fraccionados). En este proceso, el virus se solubiliza por completo con un detergente o con una mezcla de detergente y disolvente, la integridad del virus se destruye y el virus se descompone en sus componentes individuales, como proteínas de núcleo, proteínas de envoltura y componentes de membrana. La mezcla de componentes virales así producida se utiliza después para la vacunación.
Algunos ensayos de inactivación de virus de productos plasmáticos humanos han demostrado que, mediante un tratamiento con disolvente/detergente, con TNBP/Tween® 80, se pueden inactivar virus de envoltura lipídica, por ejemplo VIH, VHC, VHB o virus de Sindbis (Piet y col., Transfusion 30 (1990), 591-598).
En la producción comercial de vacunas de subunidades virales de la gripe se utilizan diferentes procedimientos para la inactivación con disolventes lipídicos como Triton® X-100, bromuro de cetiltrimetil-amonio, TNBP/Tween® 80
o dietil éter/Tween® 80. Se ha comprobado que, especialmente al utilizar dietil éter en el paso de inactivación, se produce una caída significativa de la actividad de la hemaglutinina. Danihelkova y col. (Acta Virol. 28 (1984), 26-32) comprobaron que la actividad de la hemaglutinina y la neuraminidasa de virus de la gripe inactivados se conserva bajo determinadas condiciones después del tratamiento con TNBP/Tween® 80 o dietil éter/Tween®. Sin embargo, también observaron que la separación del disolvente, en particular del dietil éter, de la preparación resulta problemática y, por ello, se considera preferible un proceso de inactivación con TNBP/Tween® 80.
Para evitar la costosa separación del disolvente, en la producción de una vacuna split de la gripe se ha utilizado únicamente Triton X-100 como detergente no iónico (Gross y col., J. clin. Microbiol. 14 (1981), 534-538).
Los detergentes no iónicos no tienen ningún grupo cargado. El carácter hidrófilo de estos detergentes se debe al grupo hidroxilo. A diferencia de los detergentes iónicos, solubilizan las proteínas de membrana de forma considerablemente más suave. El detergente no iónico disuelve compuestos tipo lípido-lípido y lípido-proteína, mientras que no influye en las interacciones proteína-proteína. Así, se conserva la estructura nativa de las proteínas. Además, el detergente sustituye a los lípidos que normalmente están unidos a la parte hidrófoba de las proteínas, con lo que crean un entorno similar a los lípidos y de este modo pueden estabilizar las proteínas solubilizadas.
En la US 4 314 997 se describe un procedimiento para la destrucción de endotoxinas y sustancias con actividad coagunte y para la inactivación del virus de la hepatitis utilizando entre un 0,25% y un 10% de anfífilos no desnaturalizadores. El documento US 4 673 733 A se refiere a un procedimiento para la inactivación de virus y pirógenos en el que se utiliza un gen de inactivación. En el documento US 4 164 565, se trata una vacuna contra la hepatitis viral con antígenos superficiales de la hepatitis B, incluyendo “antígenos e”.
Los estudios sobre las propiedades protectoras de las vacunas contra el VIS después de tratamiento con formalina, psoraleno, Triton® X-100 o Tween®/éter han demostrado que las preparaciones de VIS inactivadas con formalina y psoraleno no proporcionan ninguna protección contra una infección por VIS y que la inactivación con Triton® X-100 sólo conduce a una protección parcial. Sin embargo, con una vacuna split de VIS inactivada con Tween® 80/éter sólo se pudo observar un efecto protector a dosis elevadas de antígenos y en presencia de un potente adyuvante (Stahl-Hennig y col., Virology 186 (1992), 588-596).
En especial cuando se utilizan virus patógenos humanos infecciosos para producir una vacuna de virus completo es necesario disponer de un procedimiento eficaz y seguro para la inactivación viral. Esto es particularmente aplicable a virus en los que la inactivación con métodos convencionales se considera insuficiente, por ejemplo VIH. Como ya se ha mencionado anteriormente, la inactivación del VIS con formalina conduce a una posible pérdida de la antigenicidad.
El objetivo de la presente invención consiste en proponer una preparación viral que contiene virus inactivados.
La presente invención se refiere a una preparación viral o a una vacuna de acuerdo con las reivindicaciones que contiene un virus inactivado, caracterizándose el virus por la integridad estructural del virus completo y en particular por la integridad de las proteínas de envoltura. En el marco de la presente invención se ha comprobado que el tratamiento y la inactivación de una partícula viral con envoltura lipídica con un detergente no iónico seleccionado de entre el grupo de los polisorbatos no influye negativamente en la integridad del virus completo y, en particular, no influye en la actividad biológica de las glicoproteínas de envoltura. Esto ha resultado sorprendente sobre todo porque otros detergentes...
Reivindicaciones:
1. Preparación viral que contiene virus inactivados, caracterizada porque los virus totales, en particular las proteínas de envoltura virales, están 5 intactos y presentan una integridad estructural y los virus proceden de un sobrenadante de cultivo celular, conteniendo la preparación un detergente no iónico del grupo de los polisorbatos, en particular Tween® 80, Tween® 20, Tween® 60, Tween® 40 y combinaciones de los mismos, oscilando la concentración del detergente no iónico del grupo de los polisorbatos entre el 10% y el 20%, preferentemente entre el 10% y el 15%.
2. Preparación viral según la reivindicación 1, caracterizada porque la actividad biológica de las proteínas de envoltura del virus inactivado no resulta afectada negativamente.
3. Vacuna que contiene una preparación viral según la reivindicación 1 ó 2.
5. Vacuna según la reivindicación 3 ó 4, que contiene un vehículo fisiológicamente aceptable y/o un adyuvante. 7. Preparación viral según la reivindicación 1 ó 2 como medicamento. 15 4. Vacuna según la reivindicación 3, caracterizada porque contiene polisorbato, preferentemente Tween® 80, en una concentración entre el 0,05% y el 0,5%, preferentemente igual al 0,2%.
20 6. Vacuna según una de las reivindicaciones 3 a 5, caracterizada porque la concentración del virus inactivado en la vacuna oscila entre 106 y 109 pfu/ml, preferentemente es igual a 107 pfu/ml.
Patentes similares o relacionadas:
Péptidos que incluyen un dominio de unión de la subunidad de la fosfoproteína (P) viral a la nucleoproteína (N0) libre de ARN viral, del 10 de Junio de 2020, de INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE: Un péptido aislado de 100 aminoácidos como máximo, que tiene la capacidad de inhibir la replicación viral de Paramyxovirinae, que comprende una […]
Proteínas F del RSV modificadas y métodos de su uso, del 13 de Mayo de 2020, de NOVAVAX, INC.: Una proteína de fusión (F) del virus sincitial respiratorio (RSV) que comprende: (i) una deleción de uno o más aminoácidos que se alinean con los […]
Anticuerpos específicos del vrs y partes funcionales de los mismos, del 1 de Abril de 2020, de Medlmmune, LLC: Un anticuerpo o fragmento de union a antigeno del mismo, en donde el anticuerpo o fragmento de union a antigeno del mismo, se une especificamente al virus respiratorio […]
 Vacuna de virus vaccinia modificado de Ankara (MVA) recombinante para el virus sincicial respiratorio (VRS), del 27 de Noviembre de 2019, de BAVARIAN NORDIC A/S: Un virus vaccinia modificado de Ankara (MVA) recombinante que comprende:
(a) al menos una secuencia de nucleótidos que codifica un determinante antigénico de una […]
Vacuna de virus vaccinia modificado de Ankara (MVA) recombinante para el virus sincicial respiratorio (VRS), del 27 de Noviembre de 2019, de BAVARIAN NORDIC A/S: Un virus vaccinia modificado de Ankara (MVA) recombinante que comprende:
(a) al menos una secuencia de nucleótidos que codifica un determinante antigénico de una […]
Vacunas genéticas contra el virus Hendra y el virus Nipah, del 11 de Septiembre de 2019, de Boehringer Ingelheim Animal Health USA Inc: Composición para usar en un procedimiento de vacunación de un animal, comprendiendo dicha composición un vector de expresión, en la que el vector comprende […]
Vacuna contra el virus respiratorio sincitial (RSV), del 3 de Julio de 2019, de CureVac AG: Secuencia de ARNm que comprende una región codificante que codifica un mutante de la proteína de fusión F del virus respiratorio sincitial (RSV), […]
Polipéptidos F de prefusión del virus sincicial respiratorio (RSV) solubles y estabilizados, del 4 de Junio de 2019, de Janssen Vaccines & Prevention B.V: Un polipéptido de fusión (F) recombinante de prefusión del virus sincicial respiratorio (RSV), que comprende al menos un epitope que presenta especificidad por […]
Vacuna contra el virus respiratorio sincicial, del 28 de Mayo de 2019, de VIB VZW: Una vacuna para su uso en un procedimiento de vacunacion contra la infeccion por el VRS, comprendiendo la vacuna una composicion inmunogena […]