PROCEDIMIENTO PARA LA EXTRACCION Y EL AISLAMIENTO DE POLISACARIDOS CAPSULARES BACTERIANOS PARA SU USO COMO VACUNAS O LIGANDOS A PROTEINAS COMO VACUNAS DE CONJUGADOS.
Un procedimiento de purificación de un polisacárido capsular de componentes celulares de bacterias Gram negativas y Gram positivas,
en el que la purificación comprende:
- proporcionar para la extracción células bacterianas aisladas, sobrenadantes bacterianos concentrados de células bacterianas homogenizadas o medio acondicionado, o sedimentos celulares;
- extraer el polisacárido capsular de los componentes celulares, componentes celulares que incluyen proteína y ácido nucleico, mediante la puesta en contacto de las células bacterianas aisladas, los sobrenadantes bacterianos concentrados de células bacterianas homogenizadas o medio acondicionado, o los sedimentos celulares, con un reactivo básico en un intervalo de pH de 9 a 14, mediante lo que se degrada el ADN o el ARN bacteriano; y
- separar el polisacárido capsular extraído de las impurezas que resultan de los componentes celulares que comprenden proteínas y ácidos nucleicos, y recuperar los polisacáridos capsulares purificados
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US98/27375.
Solicitante: NORTH AMERICAN VACCINE, INC.
Nacionalidad solicitante: Canadá.
Dirección: 10150 OLD COLUMBIA ROAD,COLUMBIA, MD 21046.
Inventor/es: MICHON, FRANCIS, BLAKE,MILAN.
Fecha de Publicación: .
Fecha Concesión Europea: 19 de Mayo de 2010.
Clasificación Internacional de Patentes:
- C08B37/00 QUIMICA; METALURGIA. › C08 COMPUESTOS MACROMOLECULARES ORGANICOS; SU PREPARACION O PRODUCCION QUIMICA; COMPOSICIONES BASADAS EN COMPUESTOS MACROMOLECULARES. › C08B POLISACARIDOS; SUS DERIVADOS (polisacáridos que contienen menos de seis radicales sacáridos unidos entre sí por enlaces glucosídicos C07H; procesos de fermentación o procesos que utilizan enzimas C12P 19/00; producción de celulosa D21). › Preparación de polisacáridos no previstos en los grupos C08B 1/00 - C08B 35/00; Sus derivados (celulosa D21).
- C12P19/04 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › C12P 19/00 Preparación de compuestos que contienen radicales sacárido (ácido cetoaldónico C12P 7/58). › Polisacáridos, es decir, compuestos que contienen más de cinco radicales sacárido unidos entre ellos por enlaces glucosídicos.
- C12P19/26 C12P 19/00 […] › Preparación de hidratos de carbono que contienen nitrógeno.
Clasificación PCT:
- C08B37/00 C08B […] › Preparación de polisacáridos no previstos en los grupos C08B 1/00 - C08B 35/00; Sus derivados (celulosa D21).
- C12P19/04 C12P 19/00 […] › Polisacáridos, es decir, compuestos que contienen más de cinco radicales sacárido unidos entre ellos por enlaces glucosídicos.
- C12P19/26 C12P 19/00 […] › Preparación de hidratos de carbono que contienen nitrógeno.
Clasificación antigua:
- C08B37/00 C08B […] › Preparación de polisacáridos no previstos en los grupos C08B 1/00 - C08B 35/00; Sus derivados (celulosa D21).
- C12P19/04 C12P 19/00 […] › Polisacáridos, es decir, compuestos que contienen más de cinco radicales sacárido unidos entre ellos por enlaces glucosídicos.
- C12P19/26 C12P 19/00 […] › Preparación de hidratos de carbono que contienen nitrógeno.
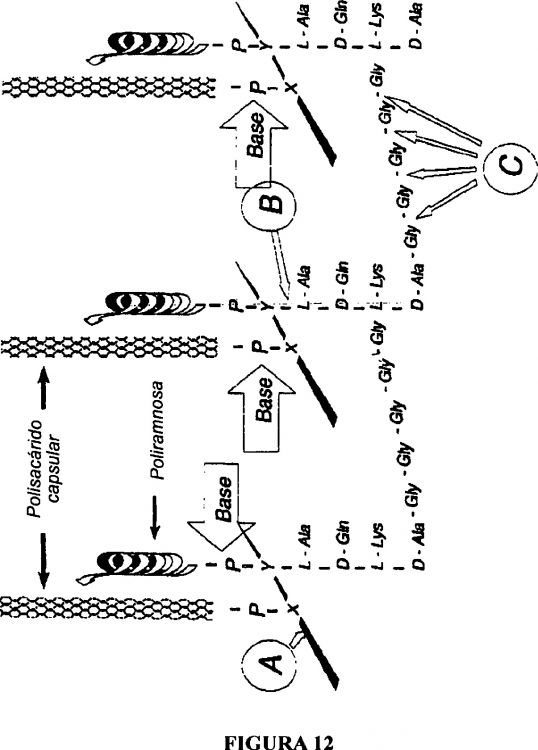
Fragmento de la descripción:
Procedimiento para la extracción y el aislamiento de polisacáridos capsulares bacterianos para su uso como vacunas o ligandos a proteínas como vacunas de conjugados.
Campo de la invención
La presente invención se refiere a procedimientos para extraer y aislar polisacáridos capsulares (PC) de bacterias tanto Gram negativas y Gram positivas. Los polisacáridos extraídos son útiles para producir vacunas que comprenden los polisacáridos solos o conjugados con proteínas.
Antecedentes de la invención
Las infecciones bacterianas provocadas por bacterias Gran positivas, tales como Streptococcus, Staphylococcus, Enterococcus, Bacillus, Corynebacterium, Listeria, Erysipelothrix y Clostridium, y por bacterias Gram negativas, tales como Haemophilus, Shigella, Vibrio cholerae, Neisseria, y ciertos tipos de Escherichia coli, causan una alta morbilidad en todo el mundo. Esto, asociado con la resistencia emergente mostrada por las bacterias a los antibióticos, indica la necesidad de desarrollar vacunas bacterianas. Streptococcus, por ejemplo, es un género amplio y variado de bacterias Gram positivas que han sido ordenadas en varios grupos en base a la antigenicidad y la estructura del polisacárido de su pared cellar (26, 27). Dos de estos grupos han sido asociados a graves infecciones humanas. Los estreptococos del grupo A provocan una variedad de trastornos infecciosos que incluyen "inflamación de garganta", fiebre reumática, impétigo causado por estreptococos y sepsis.
Los estreptococos del grupo B no fueron conocidos como patógenos humanos en los libros de texto de Medicina estándar hasta principios de 1970. Desde entonces, los estudios han demostrado que los estreptococos del grupo B son importantes patógenos perinatales en Estados Unidos, así como en países en vías de desarrollo (37). Las infecciones sistémicas por estreptococos del grupo B durante los dos primeros meses de vida afectan a aproximadamente tres de cada 1.000 nacimientos (12), dando como resultado 11.000 casos al año en Estados Unidos. Estas infecciones provocan síntomas de neumonía congénita, sepsis y meningitis. Un número considerable de estos bebés muere o tiene secuelas neurológicas permanentes. Además, las infecciones por estreptococos del grupo B pueden estar implicadas en la elevada morbilidad relacionada con la gestación que se produce en casi 50.000 mujeres cada año. Otras personas susceptibles a las infecciones por estreptococos del grupo B son aquéllas que tienen una respuesta inmune alterada, bien congénitamente, quimioterapéuticamente o por otras razones.
Los estreptococos del grupo B se pueden clasificar además en varios tipos diferentes en base al polisacárido capsular bacteriano. Los tipos Ia, Ib, II, III, IV, V, VI, VII y VIII son responsables de la mayoría de la patogenicidad debida a la infección por el grupo B, siendo los estreptococos del grupo B de tipo Ia, Ib, II, III y V representantes de más del 90% de todos los casos publicados. Se ha caracterizado la estructura de cada uno de estos diversos tipos de polisacáridos (19-22, 44). De manera similar a los descubrimientos encontrados con otros muchos patógenos bacterianos humanos, los polisacáridos capsulares de los estreptococos del grupo B, cuando se usan en vacunas, pueden proporcionar una protección eficaz frente a infecciones con estas bacterias. Véase 4, 6, 24, 29, 30, 42, 43, 45.
Las bacterias Gram negativas también son una causa relevante de enfermedad. Hasta el desarrollo y el uso recientes de vacunas de polisacárido-proteína dirigidas contra las bacterias Haemophilus influenzae de tipo b (Hib), las infecciones por bacterias Hib eran responsables de muchos casos de retraso mental en bebés. Las infecciones por N. meningitidis y E. coli K1 son responsables de la meningitis neonatal. Se han asociado cepas de bacterias Gram negativas, de E. coli, con enfermedades graves, incluyendo la muerte por ingestión de carne contaminada con cepas de E. coli.
La producción a gran escala de vacunas de polisacáridos capsulares y vacunas de conjugados de polisacáridos capsulares requiere suministros adecuados de polisacáridos capsulares purificados. Los procedimientos de la técnica anterior (40, 42) para aislar polisacáridos capsulares de células bacterianas se basan en el tratamiento de las células con la enzima mutanolisina. La mutanolisina escinde la pared celular bacteriana, lo que libera los componentes celulares. Este procedimiento implica tratar los lisados celulares con otras enzimas para eliminar las proteínas y los ácidos nucleicos, y purificar mediante precipitación diferencial y cromatografía. Tras la cromatografía, se somete la preparación a una hidrólisis alcalina antes del análisis de los azúcares. Son deseables procedimientos más eficientes, de un mayor rendimiento y más sencillos para obtener polisacáridos capsulares purificados.
El documento EP 0 238 739 A1 revela la purificación de polisacáridos capsulares de Klebsiella mediante la co-precipitación desde un sobrenadante de cultivo libre de células con un detergente, la precipitación en etanol, la extracción con disolventes orgánicos y la ultracentrifugación. Entonces se tratan los polisacáridos capsulares purificados en hidróxido de sodio diluido para eliminar la toxicidad de los lipopolisacáridos tóxicos co-purificados.
El documento US 4.413.057 describe la preparación de polisacáridos específicos de un tipo antigénico de estreptococo del grupo B mediante un procedimiento que comprende la precipitación y luego la cromatografía sobre gel. El eluido del mismo se trata con cloruro de calcio para precipitar el polisacárido que, a su vez, es disuelto en una cantidad mínima de solución tamponadora básica a un pH de aproximadamente 8 a 9. La solución resultante se eluye a través de una columna empaquetada de celulosa, y se mezclan y concentran las fracciones activas para someterlas a una diálisis.
El documento GB 1 107 693 A revela un procedimiento para preparar un secado a partir de cuerpos microbianos o licores de fermentación que comprende las etapas de descomponer las paredes celulares de al menos una parte de los microorganismos cultivados en un medio débilmente alcalino, hidrolizar la proteína microbiana a un pH aproximadamente neutro por medio de una enzima proteasa y aislar la fracción descompuesta que tenga propiedades de secado o de aromatización.
En el documento US 4.644.059, el polisacárido capsular purificado se somete a una activación mediante bromuro de cianógeno en condiciones alcalinas.
El documento WO 94/06467 se refiere a vacunas de conjugados de polisacáridos de tipo II y tipo V de estreptococos del grupo B y proteínas. La realización de la purificación del polisacárido se describe usando el procedimiento descrito en Wessels et al., "Immunogenicity in Animals of a Polysaccharide-Protein Conjugate Vaccine Against Type III Group B Streptococcus", J. Clin. Invest., 86: 1428-1433 (1990), que implica la precipitación usando etanol y un tratamiento enzimático con RNasa, DNasa y Pronasa. El polisacárido del grupo B contaminante fue despolimerizado en ese procedimiento mediante el tratamiento de la solución con NaOH 1N. Posteriormente, se volvió a N-acetilar el material mediante el tratamiento con anhídrido acético.
Resumen de la invención
Esta invención proporciona un procedimiento para purificar polisacáridos capsulares (PC) de los componentes celulares de bacterias tanto, Gram negativas como Gram positivas, según la reivindicación 1. Según esta invención, los PC se pueden extraer bien de sobrenadantes bacterianos o de células bacterianas mediante la hidrólisis del enlace lábil a bases que conecta los PC con otros componentes celulares. Una ventaja del procedimiento de extracción proporcionado por esta invención es que los PC extraídos permanecen intactos en buena parte.
Una realización de esta invención proporciona un procedimiento para obtener polisacáridos capsulares purificados mediante la desacetilación de un porcentaje de los grupos N-acetilo de los PC durante la extracción básica para facilitar la separación de los PC de otros componentes celulares. Se puede volver a introducir un porcentaje de los grupos acetilo para proporcionar PC purificados que tengan la misma estructura de las unidades de repetición con respecto a los grupos N-acetilo que un polisacárido nativo o, alternativamente, se puede usar la acilación con grupos alquilo modificados para obtener PC modificados.
En una realización preferida, los...
Reivindicaciones:
1. Un procedimiento de purificación de un polisacárido capsular de componentes celulares de bacterias Gram negativas y Gram positivas, en el que la purificación comprende:
- proporcionar para la extracción células bacterianas aisladas, sobrenadantes bacterianos concentrados de células bacterianas homogenizadas o medio acondicionado, o sedimentos celulares;
- extraer el polisacárido capsular de los componentes celulares, componentes celulares que incluyen proteína y ácido nucleico, mediante la puesta en contacto de las células bacterianas aisladas, los sobrenadantes bacterianos concentrados de células bacterianas homogenizadas o medio acondicionado, o los sedimentos celulares, con un reactivo básico en un intervalo de pH de 9 a 14, mediante lo que se degrada el ADN o el ARN bacteriano; y
- separar el polisacárido capsular extraído de las impurezas que resultan de los componentes celulares que comprenden proteínas y ácidos nucleicos, y recuperar los polisacáridos capsulares purificados.
2. El procedimiento según la reivindicación 1, en el que un porcentaje de los grupos N-acetilo presentes en el polisacárido capsular se hidroliza durante la extracción y luego se vuelve a acilar, de modo que el polisacárido capsular re-N-acilado recuperado tras la purificación genera la producción de anticuerpos que reaccionan de forma cruzada con el polisacárido capsular nativo.
3. El procedimiento según la reivindicación 1 que comprende además las etapas:
4. El procedimiento según la reivindicación 1, en el que el pH es 12.
5. El procedimiento según la reivindicación 1, en el que el polisacárido capsular procede de cualquier bacteria del género Streptococcus.
6. El procedimiento según la reivindicación 1, en el que polisacárido capsular procede de estreptococos del grupo B.
7. El procedimiento según la reivindicación 1, en el que los polisacáridos capsulares proceden de estreptococos del grupo B de tipo Ia, Ib, II, III, V, VI y VIII.
8. El procedimiento según la reivindicación 1, en el que el reactivo básico comprende una base orgánica.
9. El procedimiento según la reivindicación 1, en el que el reactivo básico comprende una base inorgánica.
10. El procedimiento según la reivindicación 3, en el que el reactivo básico comprende NaOH, KOH o LiOH.
11. El procedimiento según la reivindicación 3, en el que la separación mediante la etapa de cromatografía es una cromatografía de interacción hidrófoba.
12. El procedimiento según la reivindicación 3, en el que el agente de acilación es anhídrido acético, cloruro de acetilo, acetato de pentafluorofenilo o acetato de 4-nitrofenilo.
13. El procedimiento según la reivindicación 3, en el que la purificación del polisacárido capsular mediante la etapa de cromatografía es una cromatografía de permeación en gel.
14. El procedimiento según la reivindicación 3, en el que el reactivo básico comprende una base inorgánica, la separación mediante la etapa de cromatografía es una cromatografía hidrófoba, el reactivo de acilación es anhídrido acético, cloruro de acetilo, acetato de pentafluorofenilo o acetato de 4-nitrofenilo, y la purificación del polisacárido capsular mediante la etapa de cromatografía es una cromatografía de permeación en gel.
15. El procedimiento según la reivindicación 3, en el que el reactivo básico comprende NaOH, la separación mediante la etapa de cromatografía implica Phenyl Sepharose®, el agente de acilación es anhídrido acético y la purificación del polisacárido capsular mediante la etapa de cromatografía implica Superdex®.
16. El procedimiento según la reivindicación 1, en el que el polisacárido capsular procede de cualquier bacteria del género Neisseria.
17. El procedimiento según la reivindicación 1, en el que el polisacárido capsular procede de N. meningitidis de tipo C.
18. El procedimiento según cualquiera de las reivindicaciones 1 a 17, en el que la etapa de separación es una separación cromatográfica.
19. El procedimiento según cualquiera de las reivindicaciones 1 a 18, que comprende además conjugar el polisacárido así purificado con un polipéptido o una proteína, mediante lo cual se produce una vacuna de conjugado de polisacárido.
20. El procedimiento según la reivindicación 19, en el que la conjugación se realiza introduciendo grupos aldehído terminales en el polisacárido capsular mediante escisión oxidativa de los dioles vecinales del polisacárido capsular, y luego conjugando los grupos aldehídos terminales con los grupos amino del polipéptido mediante una aminación reductora.
Patentes similares o relacionadas:
Diversificación de los oligosacáridos de la leche humana (HMO) o sus precursores, del 8 de Julio de 2020, de Glycom A/S: Un metodo de preparacion de una mezcla diversificada que comprende dos o mas oligosacaridos de la leche humana (HMO), el metodo comprende las etapas de […]
Método de producción de compuestos de inclusión de flavonoide, del 3 de Junio de 2020, de TAIYO KAGAKU CO., LTD.: Un método de producción de un compuesto de inclusión de flavonoide, que comprende una etapa de escisión que comprende tratar un flavonoide escasamente […]
Métodos para la degradación o la conversión de polisacáridos de la pared celular vegetal, del 6 de Mayo de 2020, de NOVOZYMES, INC.: Metodo para degradar o convertir los polisacaridos de la pared celular vegetal en uno o mas azucares, que comprende: tratar los polisacaridos de la pared celular vegetal con […]
Construcción de nuevas variantes de dextransacarasa DSR-S por ingeniería genética, del 6 de Mayo de 2020, de CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE: 1. Una dextransacarasa que consiste en una secuencia que tiene el 90 %, el 95 % o el 98 % de similitud de secuencia con una secuencia de aminoácidos seleccionada del fragmento […]
Procedimiento para la purificación de hidrolizado de biomasa, del 29 de Abril de 2020, de CLARIANT INTERNATIONAL LTD.: Un procedimiento para la purificación de hidrolizado de biomasa que comprende las etapas a) Proporcionar un hidrolizado de biomasa, en el que el hidrolizado […]
Construcción de nuevas variantes de dextransacarasa DSR-S por ingeniería genética, del 22 de Abril de 2020, de CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE: Una secuencia de nucleótidos que consiste en una secuencia de nucleótidos como se define en SEQ ID NO: 1 o la secuencia complementaria a la secuencia como […]
Transsialidasas de photobacterium mutadas, del 15 de Abril de 2020, de Glycom A/S: Una α2,6-transsialidasa que tiene una secuencia de aminoácidos que es por lo menos un 90% idéntica a la secuencia de aminoácidos de la SEQ ID […]
Exopolisacárido para el tratamiento y/o cuidado de la piel, mucosas, cabello y/o uñas, del 11 de Marzo de 2020, de LUBRIZOL ADVANCED MATERIALS, INC.: Uso del exopolisacárido de la cepa de las especies de Vibrio sp. con número de depósito CNCM I-4277, para mejorar la hidratación de la piel, mucosas, […]