PROCEDIMIENTO EX VIVO PARA INTRODUCCION DE GENES.
Un procedimiento ex vivo de introducción de un agente en una célula diana,
comprendiendo el procedimiento las etapas de:
(a) dirigir partículas magnéticas que comprenden el agente hacia la célula usando un medio magnético para aplicar una fuerza magnética a dichas partículas magnéticas para tender a mover dichas partículas magnéticas hacia dicho medio magnético, y
(b) hacer oscilar al mismo tiempo dicho medio magnético
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB2006/001477.
Solicitante: KEELE UNIVERSITY
UNIVERSITY OF FLORIDA RESEARCH FOUNDATION, INC.
Nacionalidad solicitante: Reino Unido.
Dirección: KEELE,STAFFORDSHIRE ST5 5BG.
Inventor/es: DOBSON,JON, BATICH,CHRISTOPHER,D.
Fecha de Publicación: .
Fecha Concesión Europea: 9 de Junio de 2010.
Clasificación Internacional de Patentes:
- A61N2/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61N ELECTROTERAPIA; MAGNETOTERAPIA; RADIOTERAPIA; TERAPIA POR ULTRASONIDOS (medida de corrientes bioeléctricas A61B; instrumentos quirúrgicos, dispositivos o métodos para transferir formas no mecánicas de energía hacia o desde el cuerpo A61B 18/00; aparatos de anestesia en general A61M; lámparas incandescentes H01K; radiadores de infrarrojos utilizados como calefactores H05B). › Magnetoterapia.
Clasificación PCT:
- A61N2/00 A61N […] › Magnetoterapia.
Fragmento de la descripción:
Procedimiento ex vivo para introducción de genes.
Campo de la invención
La presente invención se refiere a procedimientos para la introducción de agentes terapéuticos en células diana.
Antecedentes de la invención
La fibrosis quística hace que el cuerpo produzca secreciones espesas que afectan a los pulmones y al tracto digestivo. 1 de cada 10 bebés que nacen con fibrosis quística son sometidos a una operación los primeros días de vida debido a obstrucción intestinal. Los niños y adultos padecen infecciones respiratorias reiteradas y problemas con la función pancreática. Esta última complicación hace que los que padecen fibrosis quística tengan dificultades para digerir los alimentos. Esto puede producir malnutrición, poco crecimiento, debilidad física y un retraso de la pubertad. En los pacientes más mayores, la producción de insulina puede ser insuficiente debido al aumento de trastornos pancreáticos, lo cual produce diabetes. La fibrosis quística también puede producir bloqueos de los conductos hepáticos. Esto se produce aproximadamente en el 8% de los que la padecen; sin embargo, el riesgo para la salud es tan grave que son necesarios trasplantes de hígado. Aunque la enfermedad tiene efectos graves en el intestino, páncreas, hígado y aparato reproductor, el efecto que tiene en los pulmones es el más grave. Ciclos reiterados de infección conducen a una inflamación continua y daños en los pulmones, lo que, en última instancia, conduce a fallo respiratorio y fallecimiento.
La fibrosis quística es una enfermedad genética producida por una mutación en un único gen, CFTR (regulador de la conductancia transmembrana de la fibrosis quística). Por tanto, tratando a los pacientes usando terapia génica es posible tratar la causa subyacente de la enfermedad y no los síntomas. La introducción del CFTR ha mostrado que corrige el defecto de la fibrosis quística in vitro. La terapia génica se ha ensayado en humanos usando virus y liposomas como vectores de transfección. Los virus recombinantes usados para la transferencia génica tienen que ser capaces de infectar las células tanto en división como en no división, integrarse en el genoma del huésped y proporcionar expresión génica a largo plazo. De todos los vectores víricos ensayados hasta ahora (adenovirus, retrovirus, virus adeno-asociados y virus sendai), ninguno tiene estas características. Los vectores víricos usados como sistemas de introducción de genes también tienen potenciales problemas de seguridad y son ineficaces a largo plazo debido a que desencadenan una respuesta inmunitaria. Son aplicables problemas de transfección similares a una amplia gama de enfermedades genéticas.
La presente invención trata la necesidad de un agente de transfección génica no vírico que mitigue las desventajas asociadas con los vectores víricos recombinantes. Los agentes no víricos son no infecciosos, relativamente no inmunogénicos, tienen baja toxicidad, pueden llevar plásmidos de ADN más grandes y se pueden producir de forma más barata a gran escala. Un tipo de agente es partículas magnéticas recubiertas de ADN.
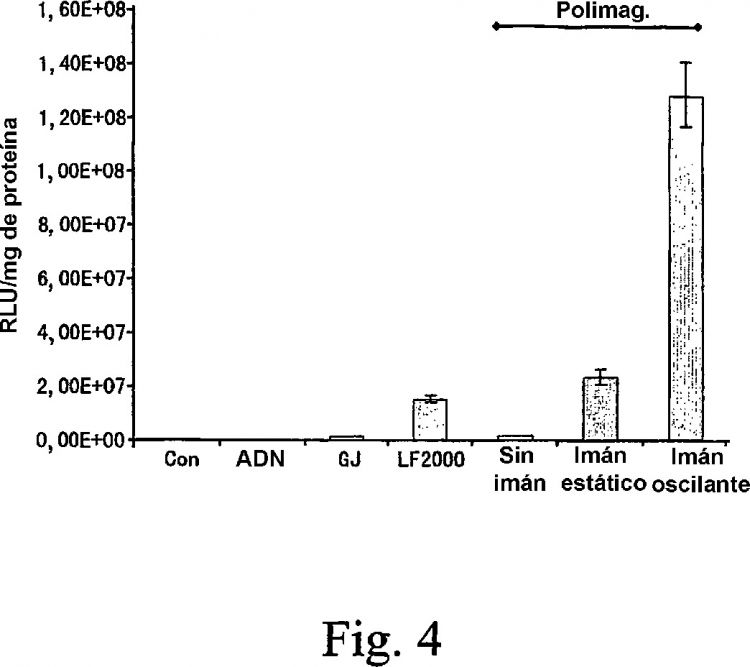
Los actuales sistemas magnéticos de transfección tienen una baja eficacia de transformación. Los presentes inventores han desarrollado un sistema de introducción basado en partículas magnéticas que, sorprendentemente, ha mostrado tener una eficacia de transformación 10 veces mayor que la de los actuales sistemas, basada en estudios iniciales in vitro.
El documento WO2004/034876 se refiere a terapia radiactiva y describe un procedimiento que usa un campo magnético no alterno para guiar un componente magnético hasta un lugar diana y depositar energía en el lugar diana.
El documento US4.652.257 describe un procedimiento de introducción de un agente en una zona diana usando vesículas lipídicas que encapsulan partículas magnéticas y agentes terapéuticos. Se describe la oscilación de un campo magnético para controlar la velocidad de liberación del agente terapéutico encapsulado en el lugar diana.
Breve resumen de la memoria descriptiva
Según un primer aspecto de la invención, se proporciona un procedimiento ex vivo de introducción de un agente en una célula diana, comprendiendo el procedimiento las etapas de (a) dirigir partículas magnéticas que comprenden el agente hasta la célula usando un medio magnético para aplicar una fuerza magnética a dichas partículas magnéticas para tender a mover dichas partículas magnéticas hacia dicho medio magnético, y (b) hacer oscilar al mismo tiempo dicho medio magnético.
Según otro aspecto de la invención, se proporciona el uso de una partícula magnética en la fabricación de un medicamento para uso en un procedimiento de tratamiento de una enfermedad, en el que la partícula magnética comprende un agente terapéutico y el procedimiento implica la introducción del agente terapéutico en células diana, en el que el procedimiento comprende (a) dirigir partículas magnéticas que comprenden el agente terapéutico hacia las células in vivo usando un medio magnético para aplicar una fuerza magnética a dichas partículas para tender a mover dichas partículas hacia dicho medio magnético, y (b) hacer oscilar al mismo tiempo dicho medio magnético.
Según un aspecto preferido de la invención, el medio magnético se usa para aplicar una fuerza magnética a las partículas para tender a mover las partículas en una primera dirección hacia el medio magnético y, al mismo tiempo, mover el medio magnético respecto a las partículas en una segunda dirección con una ángulo respecto a la primera dirección.
El movimiento del medio magnético en una segunda dirección es generalmente con ángulos distintos de cero respecto a la primera dirección, por ejemplo, con un ángulo entre 0 y 180º, tal como un ángulo de entre 0 y 90º, respecto a la primera dirección.
El movimiento del medio magnético en una segunda dirección es un movimiento oscilante. La frecuencia de oscilación a la cual se activa el (los) imán(es) habitualmente variará y generalmente estará en el intervalo de 0 hasta 100 Hz, aunque también se pueden usar valores fuera de este intervalo.
Según un aspecto preferido de la invención, el movimiento del medio magnético en una segunda dirección es básicamente perpendicular a la primera dirección en la cual las partículas tienden a moverse.
La fuerza magnética aplicada a las partículas para mover las partículas hacia el medio magnético se puede describir como una fuerza de traslación. La fuerza de traslación es producida por un campo magnético con un gradiente. Preferiblemente, la dirección de la fuerza de traslación es hacia el imán.
Según un aspecto preferido de la invención, el medio magnético es un imán o conjunto de imanes. El imán puede ser un electroimán.
Las partículas pueden ser atraídas hacia el medio magnético.
Según un aspecto preferido adicional de la invención, la partícula es una partícula magnética. Preferiblemente, la partícula está hecha de un material magnetizable. La partícula magnetizable puede ser inherentemente magnética o puede ser una que reaccione en un campo magnético.
Generalmente, se puede usar cualquier material magnético; sin embargo, con el término magnético nos referimos, por ejemplo, a un material que sea paramagnético, superparamagnético, ferromagnético y/o antiferromagnético, ejemplos de los cuales incluyen hierro elemental, manganeso de cromo, cobalto, níquel o un compuesto de los mismos. El compuesto de hierro puede ser una sal de hierro que se puede seleccionar del grupo que incluye magnetita (Fe3O4), magemite (?Fe2O3) y greigita (Fe3S4), o cualquier combinación de las mismas. El compuesto de cromo puede ser dióxido de cromo.
Las partículas se pueden proporcionar dentro de los poros de un polímero. Alternativamente, las partículas pueden comprender un núcleo magnético con un recubrimiento biocompatible. El recubrimiento biocompatible puede comprender un polímero, p. ej. dextrano, alcohol de polivinilo (PVA), polietilenimina (PEI) o sílice.
Según un aspecto preferido adicional de la invención, las partículas tienen un tamaño medio de entre 10 µm y 5 nm, por ejemplo, entre 1 µm y 10 nm.
Preferiblemente, las partículas son nanopartículas.
Partículas mas grandes magnéticamente bloqueadas (> 30 nm para la magnetita) experimentarán un par torsor...
Reivindicaciones:
1. Un procedimiento ex vivo de introducción de un agente en una célula diana, comprendiendo el procedimiento las etapas de:
(a) dirigir partículas magnéticas que comprenden el agente hacia la célula usando un medio magnético para aplicar una fuerza magnética a dichas partículas magnéticas para tender a mover dichas partículas magnéticas hacia dicho medio magnético, y
(b) hacer oscilar al mismo tiempo dicho medio magnético.
2. Un procedimiento según la reivindicación 1, en el que la dirección de oscilación del medio magnético es básicamente perpendicular a la dirección de atracción de las partículas magnéticas hacia dicho medio magnético.
3. Un procedimiento según la reivindicación 1 o la reivindicación 2, en el que el agente es ADN, ARN, ARN de interferencia, un péptido, polipéptido, un anticuerpo, un fragmento de anticuerpo de una sola cadena, un aptamero, una molécula pequeña, un poli nucleótido o un análogo de poli nucleótido.
4. Un procedimiento según la reivindicación 1 o 2, en el que el agente es un poli nucleótido, ADN o ARN y el procedimiento es un procedimiento de transformación genética de la célula diana.
5. Un procedimiento según una cualquiera de las reivindicaciones 1 a 4, en el que el agente es un agente terapéutico.
6. Un procedimiento según una cualquiera de las reivindicaciones 1 a 5, en el que el medio magnético oscila con una frecuencia en el intervalo de 0 a 100 Hz.
7. Un procedimiento según una cualquiera de las reivindicaciones precedentes, en el que el medio magnético es un campo magnético.
8. Un procedimiento según una cualquiera de las reivindicaciones 1 a 6, en el que el medio magnético es un electroimán o un imán permanente.
9. Un procedimiento según la reivindicación 8, en el que el medio magnético es un único imán o un conjunto de imanes.
10. Un procedimiento según una cualquiera de las reivindicaciones 1 a 9, en el que la amplitud de oscilación del medio magnético está en el intervalo de manométrico a milimétrico.
11. Un procedimiento según una cualquiera de las reivindicaciones precedentes, en el que la célula es una célula bacteriana, vegetal o animal.
12. Un procedimiento según una cualquiera de las reivindicaciones 1 a 10, en el que la célula es de mamífero o humana.
13. Un procedimiento según cualquiera de las reivindicaciones precedentes, en el que la partícula magnética está hecha de un material magnetizable.
14. Un procedimiento según la reivindicación 13, en el que el material magnetizable se selecciona del grupo que incluye hierro elemental, manganeso de cromo, cobalto, níquel o un compuesto de los mismos.
15. Un procedimiento según una cualquiera de las reivindicaciones precedentes, en el que las partículas magnéticas tienen un tamaño medio entre 10 µm y 5 nm.
16. Un procedimiento según una cualquiera de las reivindicaciones 1 a 15, en el que las partículas magnéticas tienen un tamaño medio entre 1 µm y 10 nm.
17. Uso de una partícula magnética en la fabricación de un medicamento para uso en un procedimiento de tratamiento de una enfermedad, en el que la partícula magnética comprende un agente terapéutico y el procedimiento implica la introducción del agente terapéutico en células diana, en el que el procedimiento comprende:
(a) dirigir partículas magnéticas que comprenden el agente terapéutico hacia células in vivo usando un medio magnético para aplicar una fuerza magnética a dichas partículas para tender a mover dichas partículas hacia dicho medio magnético, y
(b) hacer oscilar al mismo tiempo dicho medio magnético.
18. Una partícula magnética para uso en un procedimiento de tratamiento de una enfermedad, en el que la partícula magnética comprende un agente terapéutico y el procedimiento implica la introducción del agente terapéutico en células diana, en el que el procedimiento comprende:
(a) dirigir partículas magnéticas que comprenden el agente terapéutico hacia las células in vivo usando un medio magnético para aplicar una fuerza magnética a dichas partículas para tender a mover dichas partículas hacia dicho medio magnético, y
(b) hacer oscilar al mismo tiempo dicho medio magnético.
19. Un uso o partícula según la reivindicación 17 o 18, en el que el medio magnético se mueve externo al cuerpo.
20. Un uso o partícula según una cualquiera de las reivindicaciones 17 a 19, en el que la dirección de oscilación del medio magnético es básicamente perpendicular a la dirección de atracción de las partículas hacia dicho medio magnético.
21. Un uso o partícula según una cualquiera de las reivindicaciones 17 a 20, en el que el agente es ADN, ARN, ARN de interferencia, un péptido, polipéptido, un anticuerpo, un fragmento de anticuerpo de una sola cadena, un aptamero, una molécula pequeña, un poli nucleótido o un análogo de poli nucleótido.
22. Un uso o partícula según una cualquiera de las reivindicaciones 17 a 20, en el que el agente es un poli nucleótido, ADN o ARN y el procedimiento o uso dan como resultado la transformación genética de la célula diana.
23. Un uso o partícula según una cualquiera de las reivindicaciones 17 a 22, en el que el medio magnético oscila con una frecuencia en el intervalo de 0 a 100 Hz.
24. Un uso o partícula según una cualquiera de las reivindicaciones 17 a 23, en el que el medio magnético es un campo magnético.
25. Un uso o partícula según una cualquiera de las reivindicaciones 17 a 23, en el que el medio magnético es un electroimán o un imán permanente.
26. Un uso o partícula según la reivindicación 25, en el que el medio magnético es un único imán o un conjunto de imanes.
27. Un uso o partícula según una cualquiera de las reivindicaciones 17 a 26, en el que la amplitud de oscilación del medio magnético está en el intervalo de manométrico a milimétrico.
28. Un uso o partícula según una cualquiera de las reivindicaciones 17 a 27, en el que la célula es una célula bacteriana, vegetal o animal.
29. Un uso o partícula según una cualquiera de las reivindicaciones 17 a 27, en el que la célula es de mamífero o humana.
30. Un uso o partícula según una cualquiera de las reivindicaciones 17 a 29, en el que la partícula magnética está hecha de un material magnetizable.
31. Un uso o partícula según la reivindicación 30, en el que el material magnetizable se selecciona del grupo que incluye hierro elemental, manganeso de cromo, cobalto, níquel o un compuesto de los mismos.
32. Un uso o partícula según una cualquiera de las reivindicaciones 17 a 31, en el que las partículas magnéticas tienen un tamaño medio entre 10 µm y 5 nm.
33. Un uso o partícula según una cualquiera de las reivindicaciones 17 a 31, en el que las partículas magnéticas tienen un tamaño medio entre 1 µm y 10 nm.
Patentes similares o relacionadas:
Sistemas para el tratamiento de enfermedades del ojo, del 22 de Julio de 2020, de ALCON, INC: Un dispositivo para tratar un ojo de mamífero que tiene un párpado , que comprende: un escudo escleral que puede posicionarse cerca de una superficie […]
Antena para implantes y aparatos y procedimientos asociados, del 17 de Junio de 2020, de CAMBRIDGE CONSULTANTS LIMITED: Un procedimiento para diseñar una antena para un dispositivo de implante para implante en un cuerpo humano o animal, comprendiendo […]
 Bobinas circulares para estimulación magnética transcraneal profunda, del 27 de Mayo de 2020, de Brainsway, Ltd: Una bobina para la estimulación magnética transcraneal de una cabeza humana, en donde la bobina comprende:
una parte de base que incluye múltiples […]
Bobinas circulares para estimulación magnética transcraneal profunda, del 27 de Mayo de 2020, de Brainsway, Ltd: Una bobina para la estimulación magnética transcraneal de una cabeza humana, en donde la bobina comprende:
una parte de base que incluye múltiples […]
Mapeo cognitivo utilizando estimulación magnética transcraneal, del 29 de Abril de 2020, de Nexstim Oy: Un método de mapeo cognitivo que comprende las etapas de: - determinar una respuesta de línea de base cognitiva para una función cognitiva de un sujeto como respuesta […]
Núcleo magnético para procedimientos médicos, del 8 de Abril de 2020, de NEURONETICS, INC: Un dispositivo para tratar a un paciente usando estimulación magnética transcraneal, TMS, comprendiendo el dispositivo: un núcleo magnético que tiene una estructura de núcleo […]
Bobinas de base central para estimulación magnética transcraneal profunda, del 1 de Abril de 2020, de Brainsway, Ltd: Bobina para la estimulación magnética transcraneal, comprendiendo la bobina : una porción de base que incluye un eje central que define un lado derecho […]
 Lámina de microagujas, del 25 de Marzo de 2020, de HISAMITSU PHARMACEUTICAL CO. INC.: Método para preparar una lámina de microagujas con microagujas elevadas , que comprende las etapas que consisten en:
proporcionar una lámina […]
Lámina de microagujas, del 25 de Marzo de 2020, de HISAMITSU PHARMACEUTICAL CO. INC.: Método para preparar una lámina de microagujas con microagujas elevadas , que comprende las etapas que consisten en:
proporcionar una lámina […]
Sistema de estimulación craneal multisitio, del 12 de Febrero de 2020, de STARLAB BARCELONA SL: El método comprende aplicar unos estímulos individuales a diferentes zonas de un cerebro, mediante la aplicación de unas señales de estímulo determinadas a unos correspondientes […]