PROCEDIMIENTO PARA LA DETECCIÓN Y ELIMINACIÓN DE ENDOTOXINAS.
Procedimiento para la eliminación de endotoxina de una muestra,
que comprende las etapas de: a) incubación o puesta en contacto de una muestra con proteínas de cola de bacteriófago que están inmovilizadas en un portador sólido de forma inespecífica o dirigida, siendo capaces las proteínas de cola de bacteriófago de unirse a endotoxina tanto en presencia como en ausencia de iones positivos divalentes e independientemente de la concentración de iones positivos divalentes, y a continuación b) separación del complejo de proteína de cola de bacteriófago-endotoxina de la muestra
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/DE2006/000098.
Solicitante: HYGLOS INVEST GMBH.
Nacionalidad solicitante: Alemania.
Dirección: AM NEULAND 1 82347 BERNRIED ALEMANIA.
Inventor/es: GRASSL, RENATE, MEYER, ROMAN, MILLER, STEFAN, GRALLERT,HOLGER, BIEBL,Manfred.
Fecha de Publicación: .
Fecha Solicitud PCT: 23 de Enero de 2006.
Clasificación Internacional de Patentes:
- G01N33/569D
- G01N33/92 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › en los que intervienen lípidos, p. ej. colesterol.
Clasificación PCT:
- G01N33/569 G01N 33/00 […] › para microorganismos, p. ej. protozoarios, bacterias, virus.
- G01N33/92 G01N 33/00 […] › en los que intervienen lípidos, p. ej. colesterol.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia.
PDF original: ES-2357759_T3.pdf




Fragmento de la descripción:
La presente invención se refiere a proteínas de cola de bacteriófago que pueden unirse a endotoxinas tanto en presencia como en ausencia de iones positivos divalentes, particularmente Ca2+ o Mg2+. La presente invención se refiere además a procedimientos para el empobrecimiento de endotoxinas en disoluciones y muestras mediante las proteínas de cola de bacteriófago según la invención, así como a un procedimiento de detección de endotoxinas.
Los bacteriófagos reconocen estructuras (proteínas de membrana, moléculas de azúcar, etc.) sobre la superficie de sus bacterias hospedadoras mediante las correspondientes proteínas que los bacteriófagos portan sobre su superficie. Varios bacteriófagos poseen solo un tipo de proteína de reconocimiento como, por ejemplo, el fago P22 de Salmonella, otros al menos dos o más. Las proteínas de reconocimiento pueden poseer actividad enzimática, como en el fago P22 (Seckler, J. Struct. Biol. 1998; 122(1-2): 216-222), o también no ser enzimáticamente activas. Actividad enzimática significa que estas proteínas como, por ejemplo, la proteína de punta de cola de P22, pueden hidrolizar la molécula receptora que reconocen, es decir en P22 el antígeno O de Salmonella. El bacteriófago más conocido que posee dos proteínas de reconocimiento es el fago T4 específico de E. coli. Este fago posee fibras de cola largas y cortas. Las fibras de cola largas sirven para el reconocimiento específico de su bacteria hospedadora E. coli mediante la proteína de membrana OmpC o mediante el lipopolisacárido en E.coli B. Mientras que las fibras de cola largas de los fagos T4, T2 y K3 se unen específicamente a OmpC o lipopolisacárido de E. coli B (T4), OmpF (T2; Hantke K., Mol. Gen. Genet. 1978; 164 (2):131-135) y OmpA (K3; Hancock RE, Reeves P, J. Bacteriol. 1975; 121(3): 983-993; Riede I, Eschbach ML, Henning U., Mol. Gen. Genet. 1984; 195 (1-2): 144-152), las fibras de cola cortas se encuentran en el lado inferior de la placa basal del fago y no participan en la especificidad de hospedador, sino que son intercambiables entre los fagos T4, T2 y K3 (Riede, Mol. Gen. Genet. 1987; 206(1): 110-115). Solo después de haberse unido al menos tres fibras de cola largas, se despliegan las fibras de cola cortas de la placa basal y son responsables de la unión irreversible del fago T4 a las bacterias hospedadoras E. coli (Leiman y col., Cell. Mol. Life Sci. 2003; 60(11): 2356-2370). Estas proteínas de fibra de cola corta se unen, como se muestra para el fago T4 (documento WO 2004/001418), en la región central del lipopolisacárido y son por tanto adecuadas para el reconocimiento y unión de endotoxina.
Endotoxina (ET) designa una familia de lipopolisacáridos que, junto con proteínas y fosfolípidos, forman la membrana celular externa de bacterias gramnegativas. Las endotoxinas aparecen exclusivamente en este grupo de bacterias y desempeñan un papel importante en la organización, estabilidad y función de barrera de la membrana externa. Numerosos bacteriófagos hacen uso de endotoxinas o lipopolisacáridos en general para el reconocimiento específico de sus bacterias hospedadoras.
Las endotoxinas son biomoléculas que se encuentran en prácticamente todas las disoluciones acuosas sin las correspondientes medidas de protección. Las endotoxinas actúan en hombre y animales de forma fuertemente pirogénica, causan así reacciones febriles y pueden conducir a sepsis, una fuerte reacción anómala del sistema inmunitario que está acompañada por una alta tasa de mortalidad. Por tanto, por ejemplo, en la preparación de proteínas para uso médico o farmacéutico, han de detectarse exactamente las impurezas de endotoxina y eliminarse completamente a continuación. La endotoxina representa un problema en medicamentos preparados por ingeniería genética, productos de terapia génica o sustancias que se inyectan en personas o animales (por ejemplo, tratamiento de medicina veterinaria o en ensayos en animales). No solo en aplicaciones médicas, sino también de investigación como en experimentos de transfección de células de mamífero, puede observarse una inhibición o una reducción de la eficacia de transfección por endotoxina.
Todas las variantes de endotoxina están compuestas por un heteropolisacárido que está unido covalentemente a lípido A (Holst, O., 1999, en: “Endotoxin in health and disease” (Brade, H. y col.; eds.), Marcel Dekker Inc. Nueva York)). El lípido A ancla la endotoxina en la membrana bacteriana externa. El heteropolisacárido, que está compuesto por un oligosacárido central y el antígeno O, se muestra en la disolución circundante y determina la identidad serológica de la bacteria. El antígeno O está compuesto por unidades repetidas de oligosacárido cuya composición es específica de cepa (véase para ello Holst y col., supra). Los componentes característicos del oligosacárido central son ácido 3desoxi-D-mano-2-octulosónico (KDO) y L-glicero-D-manoheptosa (Hep).
La parte más conservada de endotoxinas de distintos géneros es el lípido A. Igualmente conservada que el lípido A está la región central interna, mientras que la región central externa presenta ya una mayor variación. La región central interna, KDO y lípido A portan en sí varios grupos fosfato como sustituyentes y son así responsables de la carga negativa de la endotoxina. Además, los grupos fosfato pueden estar sustituidos variablemente en el lípido A y la región central con arabinosa, etanolamina y fosfato. Los componentes sacáridos individuales del antígeno O están acetilados, sializados o glucosilados. El antígeno O varía además respecto al número de unidades repetidas, por lo que la población de endotoxinas de cada bacteria presenta una cierta heterogeneidad (Palva E.T. y Makela P.H., Eur. J. Biochem. 1980; 107(1): 137-43; Goldman R.C. y Leive L., Eur. J. Biochem. 1980; 107(1): 145-53).
Para poder utilizar proteínas en el ámbito de los estudios clínicos, las farmacopeas europea y estadounidense demandan que las proteínas estén por debajo de determinados valores límite de carga de endotoxina (por ejemplo, globulina de inmunosuero ≤ 0,91 UE/ml, esto corresponde a ≤ 5 UE/kg de peso corporal y hora (dosis = UE/kg x h); UE= unidad de endotoxina; “FDA (Food and Drug Administration): Guideline on Validation of LAL as End Product”). En caso de un medicamento o proteínas contenidas en el mismo que presenten una carga de endotoxina demasiado alta, esto puede conducir a la muerte del paciente. Una defensa inmunitaria mal dirigida daña a los pacientes por una sobrerreacción. Esto puede conducir a inflamaciones de tejidos, caída de la presión sanguínea, taquicardias, trombosis hasta choque séptico con fallo multiorgánico. Ya una exposición sostenida largo tiempo a endotoxina en cantidades de picogramos puede conducir a efectos secundarios crónicos como, por ejemplo, inmunodeficiencia, síntomas sépticos, etc. En el ámbito de la preparación de sustancias, particularmente en procesos en condiciones de “Buenas prácticas de fabricación” (BPF), se intenta por tanto reducir o eliminar lo más posible las endotoxinas. Sin embargo, la eliminación de endotoxinas de proteínas, polisacáridos y ADN es problemática. Precisamente en proteínas, hay grandes problemas por sus propiedades intrínsecas como estado de carga o hidrofobicidad, que pueden casi impedir la eliminación de endotoxinas o conducir a grandes pérdidas de producto en el procedimiento de eliminación.
Además, la detección así como eliminación de endotoxinas están influidas por el entorno, ya que factores como, por ejemplo, la composición iónica, el pH, la temperatura o la presencia de otras sustancias pueden cambiar decisivamente la interacción de un ligando con la endotoxina. A este respecto, ha de considerarse que la interacción de ligandos puede realizarse con distintas partes estructurales de las endotoxinas, como el lípido A hidrófobo o la parte polisacárida hidrófila. Estas interacciones se basan correspondientemente en general en fuerzas iónicas o hidrófobas que están influidas diferentemente por la composición de la disolución.
La estructura polisacárida de las endotoxinas se estabiliza mediante iones divalentes cargados positivamente, como calcio o magnesio (Galanos C. y Lüderitz O., Eur. J. Biochem. 1975; 54: 603-610). Estos iones pueden mediar también la interacción con ligandos (“efecto puente”).
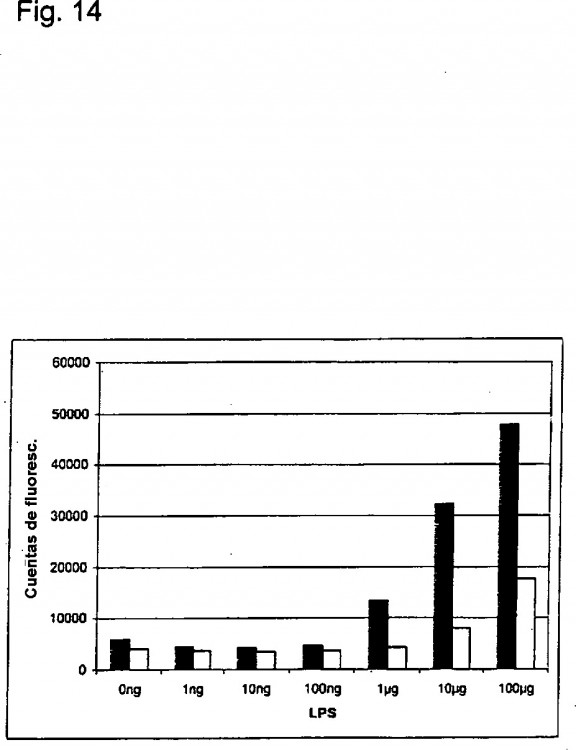
Para el empobrecimiento o eliminación de endotoxinas en disoluciones biológicas, hay en general una serie de procedimientos. Particularmente en proteínas, no hay sin embargo hasta ahora procedimientos estándar aplicables... [Seguir leyendo]
Reivindicaciones:
1. Procedimiento para la eliminación de endotoxina de una muestra, que comprende las etapas de:
a) incubación o puesta en contacto de una muestra con proteínas de cola de bacteriófago que están inmovilizadas en un portador sólido de forma inespecífica o dirigida, siendo capaces las proteínas de cola de bacteriófago de unirse a endotoxina tanto en presencia como en ausencia de iones positivos divalentes e independientemente de la concentración de iones positivos divalentes, y a continuación
b) separación del complejo de proteína de cola de bacteriófago-endotoxina de la muestra.
2. Procedimiento según la reivindicación 1, en el que las etapas a) y b) se llevan a cabo en un procedimiento de circulación por columnas de cromatografía.
3. Procedimiento según la reivindicación 1, en el que los portadores sólidos son celulosa, medios de filtración, partículas de vidrio, partículas magnéticas, materiales de centrifugación o sedimentación o materiales de carga para columnas cromatográficas.
4. Procedimiento según una de las reivindicaciones precedentes, en el que las proteínas de cola de bacteriófago están inmovilizadas sobre el portador sólido mediante grupos de acoplamiento.
5. Procedimiento según una de las reivindicaciones precedentes, en el que las proteínas de cola de bacteriófago están inmovilizadas covalentemente sobre el portador sólido mediante enlaces químicos.
6. Procedimiento según una de las reivindicaciones precedentes, en el que la proteína de cola de bacteriófago presenta un marcador Strep o un marcador His.
7. Procedimiento según una de las reivindicaciones precedentes, en el que la proteína de cola de bacteriófago es una proteína de cola de bacteriófago corta.
8. Procedimiento según una de las reivindicaciones precedentes, en el que la proteína de cola de bacteriófago procede de la familia de los Myoviridae.
9. Procedimiento según una de las reivindicaciones precedentes, en el que la proteína de cola de bacteriófago procede del grupo de fagos seudo-T-par, esquizo-T-par o T-par.
10. Procedimiento según una de las reivindicaciones precedentes, en el que la proteína de cola de bacteriófago es capaz de unirse al ácido 3-desoxi-D-mano-2-octulosónico en la región central de la endotoxina.
11. Procedimiento según una de las reivindicaciones precedentes, en el que la proteína de cola de bacteriófago se selecciona de las SEC ID Nº 2, 4, 6, 8, 10, 12 y 14.
12. Procedimiento según una de las reivindicaciones precedentes, en el que la concentración de iones positivos divalentes libres no unidos es menor de 0,1 µM.
13. Procedimiento según una de las reivindicaciones precedentes, en el que los iones positivos divalentes son Ca2+ y/o Mg2+.
14. Polipéptido según las SEC ID Nº 2, 4, 6, 8, 10, 12 o 14.
15. Molécula de ácido nucleico con una secuencia según las SEC ID Nº 1, 3, 5, 7, 9, 11 o 13.
16. Procedimiento para la detección de endotoxina que comprende las etapas de: a) puesta en contacto de una muestra que contiene endotoxina con una superficie, a continuación b) incubación de proteínas de cola de bacteriófago con endotoxinas inmovilizadas sobre la superficie,
siendo capaces las proteínas de cola de bacteriófago de unirse tanto en presencia como en ausencia de iones positivos divalentes e independientemente de la concentración de iones positivos divalentes, y a continuación c) detección de las proteínas de cola de bacteriófago unidas a endotoxina.
17. Procedimiento según la reivindicación 16, que comprende además, después de la etapa a) y antes de la etapa b), la etapa adicional de
a') eliminación de la muestra.
18. Procedimiento según la reivindicación 16 o 17, que comprende además, después de la etapa b) y antes de
la etapa c), la etapa adicional de b') eliminación de las proteínas de cola de bacteriófago no unidas.
19. Procedimiento para la detección de endotoxina, que comprende las etapas de: a) puesta en contacto de una muestra que contiene endotoxina con una superficie, a continuación b) incubación de las proteínas de cola de bacteriófago con endotoxinas inmovilizadas sobre la superficie,
siendo capaces las proteínas de cola de bacteriófago de unirse tanto en presencia como en ausencia de iones positivos divalentes e independientemente de la concentración de iones positivos divalentes, y a continuación c) eliminación de las proteínas de cola de bacteriófago no unidas y d) detección de las proteínas de cola de bacteriófago unidas a endotoxina no unidas obtenidas en la etapa c).
20. Procedimiento según la reivindicación 19, que comprende después además, de la etapa a) y antes de la etapa b), la etapa adicional de
a') eliminación de la muestra de la superficie.
21. Procedimiento según una de las reivindicaciones 16 a 20, en el que la superficie está recubierta mediante adsorción o acoplamiento covalente con un ligando que se une a endotoxina.
22. Procedimiento según la reivindicación 21, en el que el ligando que se une a endotoxina es una proteína de cola de bacteriófago que es capaz de unirse a endotoxina tanto en presencia como en ausencia de iones positivos divalentes.
23. Procedimiento para la detección de endotoxina, que comprende las siguientes etapas:
a) puesta en contacto de una muestra que contiene endotoxina con una superficie sobre la que se han inmovilizado las primeras proteínas de cola de bacteriófago, que son capaces de unirse a endotoxina tanto en presencia como en ausencia de iones positivos divalentes e independientemente de la concentración de iones positivos divalentes, y a continuación dado el caso
b) eliminación de la muestra de la superficie, a continuación
c) incubación de las segundas proteínas de cola de bacteriófago con endotoxinas unidas a las primeras proteínas de cola de bacteriófago, uniéndose las segundas proteínas de cola de bacteriófago a endotoxinas solo en presencia de iones positivos divalentes, y a continuación dado el caso
d) eliminación de las segundas proteínas de cola de bacteriófago no unidas, y a continuación
e) detección de las segundas proteínas de cola de bacteriófago unidas a endotoxina.
24. Procedimiento para la detección de endotoxina que comprende las siguientes etapas:
a) puesta en contacto de una muestra que contiene endotoxina con una superficie sobre la que se han inmovilizado proteínas de cola de bacteriófago que son capaces de unirse a endotoxina tanto en presencia como en ausencia de iones positivos divalentes e independientemente de la concentración de iones positivos divalentes, y a continuación dado el caso a. eliminación de la muestra de la superficie, a continuación
f) detección de las endotoxinas unidas en la etapa a).
25. Procedimiento según una de las reivindicaciones 16 a 24, en el que la detección se lleva a cabo mediante procedimientos espectroscópicos, ELISA, reacción de detección química o enzimática de endotoxinas o componentes de endotoxina escindidos o mediante medida de capacidad.
26. Procedimiento para la detección de endotoxina, que comprende las etapas de:
a) mezclado de la muestra con endotoxinas que están acopladas con un marcador, a continuación
b) aplicación de la mezcla de la etapa a) sobre una superficie con proteínas de cola de bacteriófago inmovilizadas, siendo capaces las proteínas de cola de bacteriófago de unirse a endotoxina tanto en presencia como en ausencia de iones positivos divalentes e independientemente de la concentración de iones positivos divalentes, a continuación
c) retirada de la mezcla de la superficie, a continuación d) lavado de la superficie, y a continuación e) detección de la endotoxina marcada sobre la superficie y/o de la endotoxina marcada libre de las
muestras combinadas después de la etapa c) y d).
27. Procedimiento según una de las reivindicaciones 16 a 26, en el que las proteínas de cola de bacteriófago están inmovilizadas en el portador sólido mediante grupos de acoplamiento.
28. Procedimiento según una de las reivindicaciones 16 a 27, en el que las proteínas de cola de bacteriófago están inmovilizadas covalentemente en el portador sólido mediante enlaces químicos.
29. Procedimiento según una de las reivindicaciones 16 a 28, en el que la proteína de cola de bacteriófago 10 presenta un marcador Strep o un marcador His.
30. Procedimiento según una de las reivindicaciones 16 a 29, en el que la proteína de cola de bacteriófago es una proteína de cola de bacteriófago corta.
31. Procedimiento según una de las reivindicaciones 16 a 30, en el que la proteína de cola de bacteriófago proviene de la familia Myoviridae.
15 32. Procedimiento según una de las reivindicaciones 16 a 31, en el que la proteína de cola de bacteriófago proviene del grupo de fagos seudo-T-par, esquizo-T-par o T-par.
33. Procedimiento según una de las reivindicaciones 16 a 32, en el que la proteína de cola de bacteriófago es capaz de unirse al ácido 3-desoxi-D-mano-2-octulosónico en la región central de las endotoxinas.
34. Procedimiento según una de las reivindicaciones 16 a 33, en el que la proteína de cola de bacteriófago se 20 selecciona de las SEC ID Nº 2, 4, 6, 8, 10, 12 y 14.
Patentes similares o relacionadas:
Método para llevar a cabo el seguimiento de la enfermedad de Gaucher, del 15 de Julio de 2020, de Centogene GmbH: Un método para determinar la evolución de la enfermedad de Gaucher en un sujeto, que comprende la etapa de determinar en varios puntos en el […]
TEST DIAGNÓSTICO BIOQUÍMICO PARA TRASTORNO POR DÉFICIT ATENCIONAL E HIPERACTIVIDAD (TDAH)., del 9 de Julio de 2020, de PONTIFICIA UNIVERSIDAD CATÓLICA DE CHILE: La invención apunta a una Prueba diagnóstica bioquímica realizada en sangre periférica, que permite el diagnóstico de Trastorno por Déficit […]
ANTICUERPO SÉRICO IGM-PC COMO BIOMARCADOR DE LA ESCLEROSIS MÚLTIPLE, Y NUEVA ELISA ULTRASENSIBLE PARA EL DIAGNÓSTICO DE ESTA ENFERMEDAD, del 2 de Julio de 2020, de FUNDACION UNIVERSITARIA SAN PABLO CEU: Anticuerpo sérico IgM frente a fosfatidilcolina (IgM-PC) para ser utilizado como biomarcador de la esclerosis múltiple (EM) y de las diferentes fases de esta enfermedad, […]
Determinación de lipocalina asociada a gelatinasa de neutrófilos (NGAL) como marcador diagnóstico para trastornos renales, del 17 de Junio de 2020, de ANTIBODYSHOP A/S: Un método de distinción entre una afección que no afecta al riñón, en donde la afección que no afecta al riñón es un trastorno inflamatorio, un […]
Uso de ácidos grasos en procedimientos para detectar cáncer, del 27 de Mayo de 2020, de UNIVERSITY OF LOUISVILLE RESEARCH FOUNDATION, INC.: Un procedimiento para determinar la presencia o ausencia de al menos un tipo de cáncer en un animal, que comprende - determinar las cantidades de lípidos de los lípidos en […]
Solución de sustrato para medir la actividad de lipasa y método y reactivo para medir la actividad lipasa en una muestra, del 11 de Marzo de 2020, de Shino-Test Corporation: Uso de una composicion que comprende un aceite de silicona modificado de tipo modificado con polieter no reactivo de tipo cadena lateral junto con ester de (6'-metilresorufina) […]
Diagnóstico diferencial de enfermedad hepática, del 21 de Noviembre de 2019, de THE REGENTS OF THE UNIVERSITY OF CALIFORNIA: Un método para predecir o evaluar el riesgo de progresión de enfermedad hepática en un paciente diagnosticado de enfermedad hepática, que comprende medir el nivel de […]
Métodos y sistemas de uso en diagnósticos neonatales, del 7 de Noviembre de 2019, de Sime Diagnostics Ltd: Un procedimiento para diagnosticar el síndrome de dificultad respiratoria (SDR), el procedimiento comprende los pasos de: a) proporcionar menos […]