PROCEDIMIENTO PARA EL CRIBADO DE ANTICUERPOS ESPECÍFICOS DE GLICOFORMA.
Procedimiento de cribado de anticuerpos específicos de glicoforma de entre anticuerpos generados contra una primera glicoproteína que es TSH humana hipofisaria o sanguínea,
que comprende una etapa de determinación de la unión entre a. anticuerpos generados contra la primera glicoproteína, b. por lo menos una glicoforma de una segunda glicoproteína que es TSH humana recombinante producida por células de mamífero, siendo dicha segunda glicoproteína por sí misma una glicoforma de la primera glicoproteína, en el que dicha glicoforma de la segunda glicoproteína se selecciona de entre un grupo de glicoformas de la segunda glicoproteína, correspondiendo cada glicoforma de dicho grupo a un estado de glicosilación determinado que está a. esencialmente más sialilada, más ramificada y menos fucosilada que dicha segunda glicoproteína, o b. esencialmente más sialilada, menos ramificada y menos fucosilada que dicha segunda glicoproteína, para producir anticuerpos que pueden unirse a por lo menos una glicoforma dada de la segunda glicoproteína
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2005/001160.
Solicitante: CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE
UNIVERSITE DE PROVENCE (AIX-MARSEILLE 1).
Nacionalidad solicitante: Francia.
Dirección: 3, RUE MICHEL-ANGE 75794 PARIS CEDEX 16 FRANCIA.
Inventor/es: RONIN,CATHERINE, DONADIO,SANDRINE.
Fecha de Publicación: .
Fecha Solicitud PCT: 4 de Febrero de 2005.
Fecha Concesión Europea: 4 de Agosto de 2010.
Clasificación Internacional de Patentes:
- C07K16/26 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra hormonas.
- G01N33/68B
Clasificación PCT:
- C07K14/59 C07K […] › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Hormona estimulante del folículo (FSH); Gonadotropinas coriónicas, p. ej. HCG; Hormona luteinizante (LH); Hormona estimulante del tiroides (TSH).
- C07K16/26 C07K 16/00 […] › contra hormonas.
- G01N33/76 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › Gonadotropina coriónica humana.
Clasificación antigua:
- C07K14/59 C07K 14/00 […] › Hormona estimulante del folículo (FSH); Gonadotropinas coriónicas, p. ej. HCG; Hormona luteinizante (LH); Hormona estimulante del tiroides (TSH).
- C07K16/00 C07K […] › Inmunoglobulinas, p. ej. anticuerpos mono o policlonales.
- C07K16/26 C07K 16/00 […] › contra hormonas.
- G01N33/569 G01N 33/00 […] › para microorganismos, p. ej. protozoarios, bacterias, virus.
- G01N33/76 G01N 33/00 […] › Gonadotropina coriónica humana.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania.
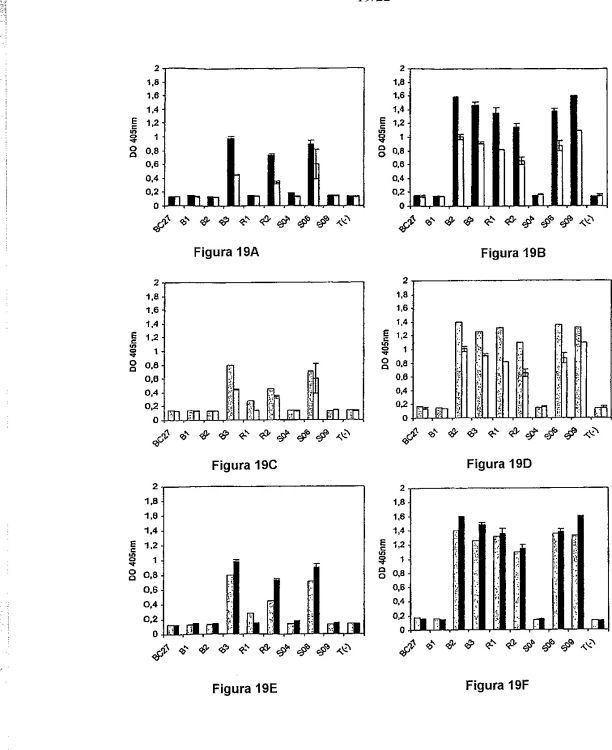
Fragmento de la descripción:
La presente invención se refiere a un procedimiento para el cribado de anticuerpos específicos de glicoforma. La presente solicitud se refiere también a un procedimiento para optimizar el reconocimiento de glicoformas específicas de una glicoproteína dada.
Actualmente, existe una demanda creciente de sistemas de medición en los que los anticuerpos distingan glicoproteínas que presentan un patrón de glicosilación particular (es decir, distinguir glicoformas específicas de una glicoproteína dada). Tales anticuerpos son particularmente útiles para ensayos inmunológicos destinados a detectar y medir la concentración de glicoformas particulares de una glicoproteína dada en fluidos y/o tejidos corporales.
Por ejemplo, la concentración, glicosilación y/o fuente tisular de hormonas glicoproteicas, tales como TSH, LH o FSH, pueden ser indicativas de ciertas patologías (Spencer, C.A. et al., 1995; Spencer, C.A., y Demers, L.M., 2003).
Sin embargo, varios obstáculos impiden la obtención de tales anticuerpos, el más importante de los cuales se refiere a la glicoproteína que va a utilizarse para cribar y/o generar la producción de anticuerpos.
Es difícil obtener glicoproteínas con un patrón de glicosilación deseado, especialmente con un patrón de glicosilación de tipo humano, de manera fiable y en grandes cantidades. Por tanto, las fuentes humanas o animales de glicoproteínas proporcionan cantidades muy escasas de proteína. Además, el patrón de glicosilación de las glicoproteínas que se originan a partir de animales es relativamente diferente del de las de origen humano.
Las glicoproteínas recombinantes no son una alternativa interesante, porque las líneas celulares utilizadas para producir glicoproteínas recombinantes son en su mayor parte de origen animal. Por tanto, estas líneas celulares conducen a la obtención de un patrón de glicosilación que es notablemente diferente del patrón de glicosilación de tipo humano. Además, las líneas celulares humanas no pueden producir todas las diversas glicoproteínas glicosiladas específicas de tejido.
Por consiguiente, están realizándose actualmente investigaciones para diseñar genéticamente nuevas líneas celulares de modo que se produzcan glicoproteínas que portan patrones de glicosilación de tipo humano particulares. Sin embargo, estas líneas no son adecuadas todavía para la producción de proteínas en grandes cantidades y el sistema de líneas celulares no es suficientemente versátil como para reproducir toda la gama de tipos de glicosilación humanos.
En otro caso, se estudió la inmunorreactividad de TSH recombinante desialilada producida en células CHO (Zerfaoui, M., y Ronin, C., 1996). Sin embargo, el interés de utilizar esta modificación sencilla para cribar anticuerpos específicos de glicoforma es pésimo porque la mayoría de las glicoproteínas naturales, especialmente las que circulan en la sangre, están sialiladas en un cierto grado.
Además, se ha establecido desde hace mucho tiempo que los ensayos inmunométricos de TSH actuales representan el enfoque más sensible y fiable para someter a prueba la función tiroidea. Sin embargo, varios estudios comparativos revelaron variaciones significativas entre y dentro de los procedimientos inmunológicos en las mediciones de TSH, que posiblemente dan como resultado pacientes que no se diagnostican o con diagnóstico erróneo y, en consecuencia, tratamientos inadaptados. Cuando se produjo por primera vez TSH recombinante (recTSH) en células CHO (Price, A., et al., 2001), se consideró que este compuesto era un supuesto nuevo candidato para sustituir la 2ª preparación de referencia internacional (IRP) utilizada rutinariamente de TSH extraída de la hipófisis. En 1999, la Organización Mundial de la Salud ordenó un estudio mundial para validar el compuesto recombinante como nuevo material de referencia. Se realizaron mediciones de una preparación de recTSH (94/674) en 38 procedimientos inmunológicos diferentes por medio de diferentes formatos, es decir, RIA, IRMA, ELISA, IFMA y/o ICLMA y se normalizaron con respecto al 2º IRP de pitTSH (80/558). El estudio reveló una variabilidad significativa de desde 5,51 mUI (3,95-7,67 mUI) por ampolla mediante RIA hasta 7,15 mUI (6,7-7,63 mUI) por ampolla mediante IFMA (Rafferty, B., et al., 1999). La posible utilización de este compuesto como nuevo calibrador en mediciones de TSH no se documentó adicionalmente.
Por tanto, la presente invención se dirige a:
- proporcionar un nuevo procedimiento para cribar anticuerpos específicos de glicoforma entre anticuerpos generados contra una primera glicoproteína que es TSH humana hipofisaria o sanguínea, que comprende una etapa de determinación de la unión entre
a. anticuerpos generados contra la primera glicoproteína,
b. por lo menos una glicoforma de una segunda glicoproteína que es TSH humana recombinante producida por células de mamífero, siendo dicha segunda glicoproteína por sí misma una glicoforma de la primera glicoproteína,
seleccionándose dicha glicoforma de la segunda glicoproteína de un grupo de glicoformas de la segunda glicoproteína, correspondiendo cada glicoforma de dicho grupo a un estado de glicosilación determinado que es
a. esencialmente más sialilado, más ramificado y menos fucosilado que dicha segunda glicoproteína, o
b. esencialmente más sialilado, menos ramificado y menos fucosilado que dicha segunda glicoproteína,
para producir anticuerpos que pueden unirse a por lo menos una glicoforma dada de la segunda glicoproteína.
La mayoría de las glicoproteínas pueden encontrarse en varias formas que varían entre sí por su contenido en glicano respectivo, siendo su secuencia de proteína respectiva esencialmente similar, es decir, siendo la similitud de la secuencia de aminoácidos de cada glicoproteína en comparación entre sí superior al 90%, preferentemente superior al 95%, siempre que ambas glicoproteínas presenten las mismas propiedades biológicas; esas formas se denominan glicoformas de una glicoproteína dada.
La expresión “anticuerpos generados contra una primera glicoproteína” significa 5 que dichos anticuerpos se obtienen tras la inmunización de un animal mediante dicha primera glicoproteína.
Ventajosamente, esos anticuerpos son anticuerpos monoclonales.
10 El estado de glicosilación de una glicoproteína dada corresponde al número de cadenas de glicano portadas por dicha glicoproteína y a las respectivas estructuras de esas cadenas.
Como regla general, una glicoforma dada puede caracterizarse por un estado de glicosilación determinado. Sin embargo, merece la pena indicar que debido a la notable diversidad de los diversos procesos de glicosilación de proteínas en las células, una glicoforma dada no corresponde a un patrón de glicosilación único, sino a un conjunto de varios patrones de glicosilación relacionados estrechamente que pueden representarse por su estructura de glicano promedio. En la presente memoria se entenderá que esta estructura de glicano promedio corresponde a dicho estado de glicosilación.
El estado de sialilación corresponde al número de grupos sialilo que porta una
glicoproteína dada. En glicoproteínas humanas, el ácido siálico corresponde lo más a
menudo a ácido N-acetilneuramínico (NeuAc).
**(Ver fórmula)**
Ácido N-acetilneuramínico (NeuAc) 30 La expresión “estado sustancialmente no sialilado” se refiere a un patrón de glicosilación que carece esencialmente de grupos sialilo.
Se dice que un estado de glicosilación “no está exclusivamente definido por un 35 estado sustancialmente no sialilado” o bien si no está sialilado o bien si su no sialilación está asociada con otra modificación del estado de glicosilación.
Una glicoforma, cuyo estado de glicosilación está definido exclusivamente por un estado sustancialmente no sialilado, no es de relevancia en el marco de la presente 40 invención dado que esta característica no es una característica de glicosilación natural, en
particular en la circulación humana.
El estado de fucosilación corresponde al número de grupos fucosilo que porta una glicoproteína dada. En glicoproteínas humanas, la fucosa corresponde a 45 L-desoxigalactosa.
El estado de ramificación corresponde al número de residuos de N-acetilglucosamina unidos en β-1,2/4/6 establecidos...
Reivindicaciones:
Reivindicaciones
1. Procedimiento de cribado de anticuerpos específicos de glicoforma de entre anticuerpos generados contra una primera glicoproteína que es TSH humana hipofisaria o sanguínea, que comprende una etapa de determinación de la unión entre
a. anticuerpos generados contra la primera glicoproteína,
b. por lo menos una glicoforma de una segunda glicoproteína que es TSH humana recombinante producida por células de mamífero, siendo dicha segunda glicoproteína por sí misma una glicoforma de la primera glicoproteína,
en el que dicha glicoforma de la segunda glicoproteína se selecciona de entre un grupo de glicoformas de la segunda glicoproteína, correspondiendo cada glicoforma de dicho grupo a un estado de glicosilación determinado que está
a. esencialmente más sialilada, más ramificada y menos fucosilada que dicha segunda glicoproteína, o
b. esencialmente más sialilada, menos ramificada y menos fucosilada que dicha segunda glicoproteína,
para producir anticuerpos que pueden unirse a por lo menos una glicoforma dada de la segunda glicoproteína.
2. Procedimiento según la reivindicación 1, en el que los anticuerpos generados contra la primera glicoproteína se unen a la segunda glicoproteína con una afinidad igual a
o superior a la afinidad de unión de dichos anticuerpos a la primera glicoproteína.
3. Procedimiento según la reivindicación 1 ó 2, en el que una glicoforma de la segunda glicoproteína que está:
a. esencialmente más sialilada, más ramificada y menos fucosilada que dicha segunda glicoproteína, o
b. esencialmente más sialilada, menos ramificada y menos fucosilada que dicha segunda glicoproteína,
se obtiene mediante una combinación de por lo menos una modificación enzimática de la segunda glicoproteína y/o de por lo menos un fraccionamiento con lectinas.
4. Procedimiento según la reivindicación 3, en el que la lectina se selecciona de entre el grupo que comprende lectinas específicas de manosa, tales como las lectinas ConA o de la lenteja, lectinas específicas de fucosa, tales como la lectina Ulex, lectinas
específicas de gactosa, tales como ricina, o lectinas específicas de ácido siálico, tales como la limulina o la lectina de Sambucus nigra.
5. Procedimiento según la reivindicación 3 ó 4, en el que la modificación enzimática se lleva a cabo mediante una enzima seleccionada de entre el grupo que comprende una glicosidasa, en particular una neuraminidasa o fucosidasa, o una glicosiltransferasa, en particular una sialiltransferasa.
6. Procedimiento según cualquiera de las reivindicaciones 3 a 5, en el que una glicoforma menos fucosilada de la segunda glicoproteína en comparación con la segunda glicoproteína se obtiene mediante fraccionamiento con lenteja de la segunda glicoproteína recogiendo la fracción que no se une a lenteja.
7. Procedimiento según cualquiera de las reivindicaciones 3 a 6, en el que se realiza un fraccionamiento con ConA de la segunda glicoproteína recogiendo tres fracciones, A, B y C, cuya unión a ConA es tal que,
C se une a ConA más fuertemente que B, y
B se une a ConA más fuertemente que A,
siendo el estado de ramificación de una fracción dada esencialmente diferente del estado de ramificación de las otras dos fracciones.
8. Procedimiento según cualquiera de las reivindicaciones 1 a 7, en el que una glicoforma más sialilada de la segunda glicoproteína en comparación con la segunda glicoproteína se obtiene mediante tratamiento con sialiltransferasa de dicha segunda glicoproteína o mediante tratamiento con neuraminidasa seguido por tratamiento con sialiltransferasa de dicha segunda glicoproteína.
9. Procedimiento según la reivindicación 5 u 8, en el que la sialiltransferasa es una α-2,6-sialiltransferasa, en particular una sialiltransferasa ST6GalI, más particularmente una sialiltransferasa ST6GalI acortada en el extremo N-terminal con una deleción de como máximo sus primeros 99 residuos, tal como se representa mediante la SEC ID nº: 1.
10. Procedimiento según cualquiera de las reivindicaciones 1 a 9, en el que, en una etapa preliminar, los anticuerpos que van a cribarse se clasifican en conjuntos, caracterizándose cada conjunto porque dos anticuerpos seleccionados de entre un mismo conjunto no pueden unirse a la misma glicoproteína al mismo tiempo.
11. Procedimiento según cualquiera de las reivindicaciones 1 a 10, en el que en una primera etapa, precediendo dicha primera etapa a la etapa preliminar de la reivindicación 10, se comprueba que los anticuerpos generados contra la primera glicoproteína se unen a la segunda glicoproteína.
12. Procedimiento según cualquiera de las reivindicaciones 1 a 11, en el que la unión de los anticuerpos a la primera glicoproteína, a la segunda glicoproteína y a las glicoformas de las segundas glicoproteínas se determina utilizando inmunoensayos, en particular formatos de inmunoensayos que utilizan un sistema de amplificación para la detección, tales como un ELISA.
13. Procedimiento según la reivindicación 12, en el que el inmunoensayo es un inmunoensayo de tipo “sándwich”, en particular una prueba de ELISA de tipo “sándwich”, que comprende las etapas siguientes: - fijar un anticuerpo de captura, seleccionado de entre un conjunto tal como se define en la reivindicación 10, sobre un soporte, - poner en contacto una glicoproteína, correspondiente a la primera glicoproteína, a la segunda glicoproteína o a las glicoformas de la segunda glicoproteína, con dicho anticuerpo de captura, para formar, si resulta adecuado, un complejo binario anticuerpo de captura-glicoproteína, - poner en contacto un anticuerpo trazador, seleccionado de entre un conjunto tal como se define en la reivindicación 10, siempre que dicho conjunto sea diferente del utilizado para la selección de dicho anticuerpo de captura, con dicho complejo binario anticuerpo de captura-glicoproteína, para formar, si resulta adecuado, un complejo ternario anticuerpo de captura-glicoproteínaanticuerpo trazador, - detectar el anticuerpo trazador para medir el número de complejos ternarios.
Patentes similares o relacionadas:
Ligandos que potencian la bioactividad de las gonadotrofinas, del 8 de Abril de 2020, de ReproPharm Vet: Ligando de la hormona foliculoestimulante (FSH) que potencia la bioactividad de FSH, hormona luteinizante (LH) y gonadotropina coriónica (CG), caracterizado […]
Anticuerpos antineurotensina y usos los mismos, del 12 de Febrero de 2020, de INSERM (INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE): Un anticuerpo neutralizante que se une a neurotensina humana y que comprende una región variable de cadena pesada que comprende la SEQ ID […]
Método y kit para detectar 1,25-dihidroxivitamina D y anticuerpos relacionados, del 15 de Enero de 2020, de DIASORIN S.P.A: Anticuerpo monoclonal que se une al dominio de unión a ligando del complejo receptor de vitamina D (VDR-LBV)/1,25-dihidroxivitamina D, en el que las secuencias […]
Anticuerpo antiadrenomedulina (ADM) o fragmento de anticuerpo anti-ADM o andamiaje no Ig anti-ADM para la prevención o la reducción de una disfunción orgánica o una insuficiencia orgánica en un paciente que presenta una enfermedad crónica o aguda o una afección aguda, del 5 de Noviembre de 2019, de AdrenoMed AG: Anticuerpo antiadrenomedulina (ADM) o fragmento de anticuerpo anti-ADM que se une a adrenomedulina o andamiaje no Ig anti-ADM que se une a la adrenomedulina para […]
 Anticuerpo anti-adrenomedulina (ADM) o fragmento de anticuerpo anti-ADM o armazón no Ig anti-ADM para uso en la terapia de una enfermedad aguda o una afección aguda de un paciente para estabilizar la circulación, del 25 de Septiembre de 2019, de AdrenoMed AG: Un anticuerpo anti-adrenomedulina (ADM) o un fragmento de anticuerpo anti-ADM que se une a adrenomedulina o un armazón no Ig anti-ADM que se une a […]
Anticuerpo anti-adrenomedulina (ADM) o fragmento de anticuerpo anti-ADM o armazón no Ig anti-ADM para uso en la terapia de una enfermedad aguda o una afección aguda de un paciente para estabilizar la circulación, del 25 de Septiembre de 2019, de AdrenoMed AG: Un anticuerpo anti-adrenomedulina (ADM) o un fragmento de anticuerpo anti-ADM que se une a adrenomedulina o un armazón no Ig anti-ADM que se une a […]
Profilaxis de cáncer colorrectal y gastrointestinal, del 21 de Agosto de 2019, de Progastrine et Cancers S.à r.l: Anticuerpo monoclonal antiprogastrina humana (hPG) neutralizante para la utilización en la prevención del cáncer gastrointestinal en un sujeto humano, que comprende administrar […]
Anticuerpos anti-neurotensina y usos de los mismos, del 21 de Agosto de 2019, de INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE (INSERM): Un anticuerpo neutralizador que se une al fragmento largo de la neurotensina humana como se expone en SEQ ID NO:9, y que tiene una región variable de la cadena pesada que comprende […]
Medios y métodos de medición de la hormona paratiroidea en pacientes que sufren de estrés oxidativo, del 11 de Junio de 2019, de IMMUNDIAGNOSTIK AG: Método para obtener moléculas de anticuerpos monoclonales específicos para el péptido de la hormona paratiroidea humana (hPTH) inactivada oxidativamente y sus […]